Bloque 2: Aspectos cuantitativos da Química

Lo que hay que saber
• FQB2.1.1. Xustifica a teoría atómica de Dalton e a descontinuidade da materia a partir das leis fundamentais da química, e exemplifícao con reaccións.
• FQB2.2.1. Determina as magnitudes que definen o estado dun gas aplicando a ecuación de estado dos gases ideais.
• FQB2.2.2. Explica razoadamente a utilidade e as limitacións da hipótese do gas ideal.
• FQB2.3.1. Determina presións totais e parciais dos gases dunha mestura, relacionando a presión total dun sistema coa fracción molar e a ecuación de estado dos gases ideais.
• FQB2.3.2. Relaciona a fórmula empírica e molecular dun composto coa súa composición centesimal, aplicando a ecuación de estado dos gases ideais.
• FQB2.4.1.Expresa a concentración dunha disolución en g/L, mol/L, porcentaxe en peso e en volume, molalidad, fracción molar...; leva a cabo e describe o procedemento de preparación no laboratorio de disolucións dunha concentración determinada e realiza os cálculos necesarios, tanto para o caso de solutos en estado sólido como a partir doutra de concentración coñecida.
• FQB2.5.1. Experimenta e interpreta a variación das presión de vapor, temperaturas de fusión e ebulición dun líquido ao que se lle engade un soluto, relacionándoo con algún proceso de interese no contorno.
• FQB2.5.2. Utiliza o concepto de presión osmótica para describir o paso de ións a través dunha membrana semipermeable.
• FQB2.6.1. Describe o espectrógrafo de masas e calcula a masa atómica dun elemento a partir dos datos espectrométricos obtidos para os diferentes isótopos deste.
• FQB2.7.1. Describe as aplicacións da espectroscopía na identificación de elementos e compostos.


Clasificación da materia
Teoría atómica de Dalton
1. Los elementos químicos están formados por partículas pequeñísimas, llamadas átomos, que son indivisibles e inalterables.
2. Todos los átomos de un mismo elemento son iguales y, por tanto, tienen la misma masa y propiedades, mientras que los átomos de diferentes elementos tienen distinta masa y propiedades.
3. Los compuestos químicos están formados por la unión de átomos de diferentes elementos, y estos átomos se combinan entre sí en una relación de números enteros sencillos.
4. Los átomos no se crean ni se destruyen en una reacción química, solo se redistribuyen.
La teoría atómica de Dalton justifica las leyes ponderales

Actividades
4 Xustifica, a partir da teoría de Dalton, por que a composición porcentual dun composto é fixa e constante.
5 Por que as substancias non reaccionan entre si en cantidades en masa iguais, por exemplo, 1 g de cobre con 1 g de xofre, ou 1 kg de osíxeno con 1 kg de cobre?
6 Cada unha das seguintes proposicións cuestiona algunha das hipóteses de Dalton. Indícaas. a) O osíxeno ten varios isótopos.
b) Os electróns e os protóns son partículas subatómicas.
c) A fórmula molecular da sacarosa (azucre) é C12H22O11.


2. Leis ponderais
- Lei de conservación da masa: Lavoisier (1789)
- Lei das proporcións definidas: J. Proust (1799)
- Lei das proporcións múltiples: Dalton (1803)
Actividades
2 O osíxeno combínase co silicio nunha relación de masa 1,14 :1:
a) Que masa de silicio é necesaria para reaccionar con 1 g de osíxeno?
b) Que masa de óxido de silicio se formará?
Solución: a) m = 0,877 g; b) m = 1,877 g.
3 De acordo cos datos do exercicio resolto 1, explica que acontecerá se facemos reaccionar:
a) 3,0 g de Fe con 5,0 g de S.
b) 4,0 mg de Fe con 2,0 mg de S.
c) 6,09 kg de Fe con 3,5 kg de S.
Solución: a) 4,72 g de FeS; 3,28 g de S. b) 5,5 mg de FeS; 0,5 mg de Fe. c) 9,59 kg de FeS.



Problemas con Dalton
4 Xustifica, a partir da teoría de Dalton, por que a composición porcentual dun composto é fixa e constante.
5 Por que as substancias non reaccionan entre si en cantidades en masa iguais, por exemplo, 1 g de cobre con 1 g de xofre, ou 1 kg de osíxeno con 1 kg de cobre?
6 Cada unha das seguintes proposicións cuestiona algunha das hipóteses de Dalton. Indícaas. a) O osíxeno ten varios isótopos.
b) Os electróns e os protóns son partículas subatómicas.
c) A fórmula molecular da sacarosa (azucre) é C12H22O11.

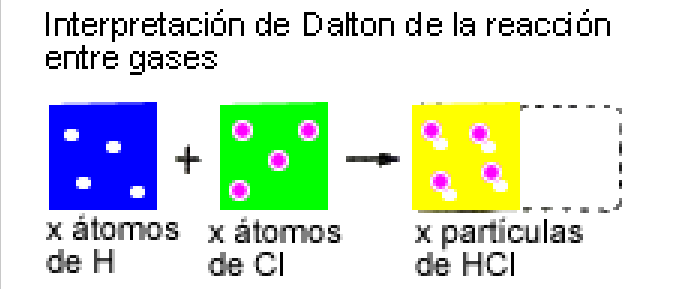
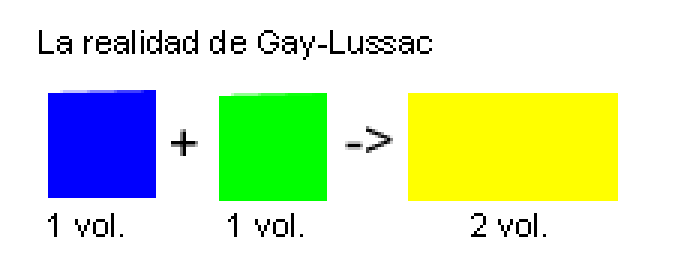
Lei dos volumes de combinación
En iguais condicións de presión (p) e temperatura (T), os volumes das substancias gasosas que interveñen nunha reacción química gardan entre si unha relación numérica sinxela. (Gay-Lussac, 1808)
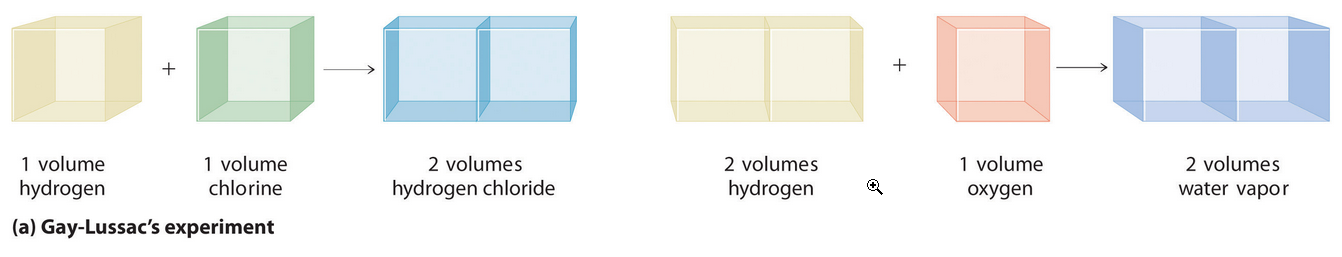
Interpretación da lei dos gases
-
Lei de Avogadro
Para tratar de encaixar a lei de Gay-Lussac dentro da teoría atómica, o químico italiano A. AVOGADRO (1776-1856) considerou as seguintes hipoteses:
■ Volumes iguais de gases diferentes, nas mesmas condicións de presión e temperatura, conteñen idéntico número de partículas.
■ As partículas dos gases elementais non son átomos senón agregados de dous ou máis átomos, denominados moléculas.
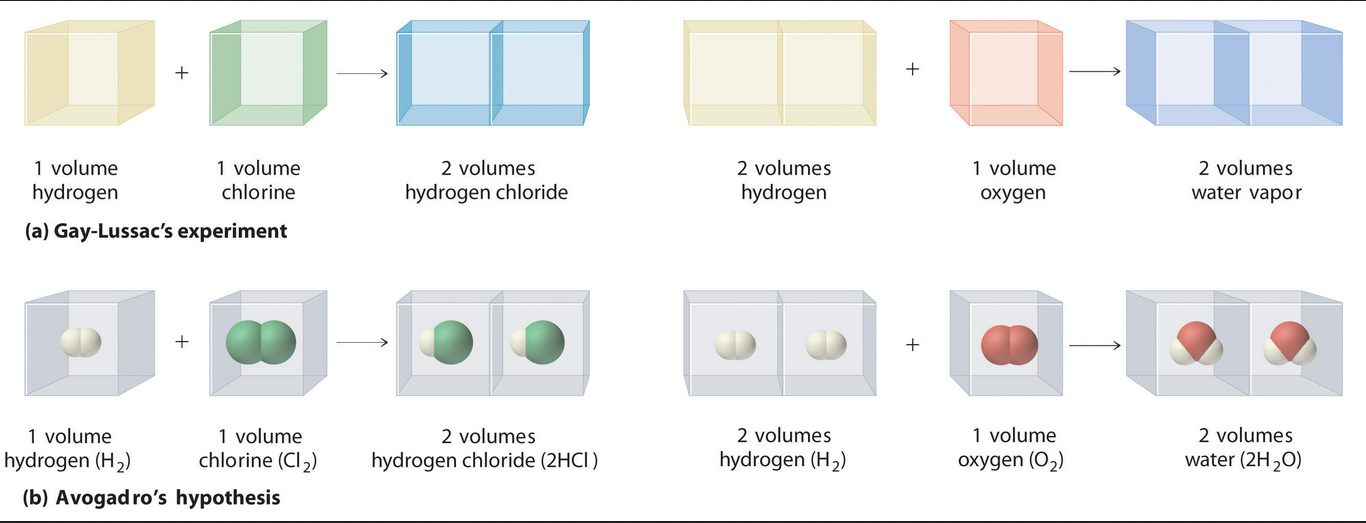

Actividades
7 Experimentalmente encóntrase que 1 L de hidróxeno reacciona con 1 L de cloro para dar 2 L de cloruro de hidróxeno. Determina a fórmula molecular do cloruro de hidróxeno.
8 Temos dous recipientes de igual volume e en idénticas condicións de presión e temperatura. No primeiro hai 0,391 g de cloro, e no segundo, 0,143 g de acetileno:
a) Onde hai maior número de moléculas? Por que?
b) Que relación existe entre as masas dunha molécula de acetileno e unha de cloro?
Solución: b) 0,366.
9 Por que unhas veces se fala de hipótese de Avogadro e outras de lei de Avogadro?


5 Medida de cantidades en Química
- Masa atómica e molecular
- Fórmula empírica e molecular
- Número de avogadro
- Cantidade de substancia: o mol
- Masa molar
- Volume molar:
- A 0 ºC e 1 atm de presión (cn) 1 mol de calquera gas ocupa 22,414 L
NOTA: NON SE RECOMENDA FALAR DO PESO-FÓRMULA, XA QUE PODE INDUCIR AO ALUMNO A PENSAR QUE EXISTEN MOLÉCULAS DE COMPOSTOS IÓNICOS. POR OUTRA PARTE, É UN CONCEPTO TOTALMENTE INNECESARIO.
Actividades
-
10 Xustifica o valor da masa atómica do cloro que aparece nas táboas, 35,453 u, sabendo que está formado por dous isótopos:
35Cl: masa 34,969 u abundancia relativa: 75,78%
37Cl de 36,966 u e abundancia relativa: 24,22%.
11 indica en cal ou cales das seguintes substancias non sería adecuado falar de masa molecular: a) cloruro de potasio; b) nitrato de sodio; c) glicosa; d) amoníaco; e) sulfato de cromo (III).
12 Calcula a masa molar do sulfato de aluminio e do dicromato de potasio.
Solución: Al2(SO4)3: 342,142 g; K2Cr2O7: 294,189 g.
13 Un composto ten de masa molecular 60 u. Sabendo que a súa fórmula empírica é CH2O, determina a súa fórmula molecular.
Na web: Podes consultar a animación « Isótopos do átomo de hidróxeno » e realizar as actividades propostas.



14. Atopa a relación entre a unidade de masa atómica e o gramo.
15. Calculade o número de moléculas que hai en 25 mL de etanol :
sabendo que a súa densidade é de 0.789 g/mL.
16. Que ten máis masa átomos de sodio ou 1 L de amoníaco en cn?
17. Calcula a masa, en g, dunha molécula de e dunha molécula de peróxido de hidróxeno,


6 Fórmulas químicas
- Fórmulas empíricas
-
Unha fórmula empírica é aquela que expresa a relación numérica máis sinxela na que aparecen os distintos átomos que forman un composto.
-
-
Fórmulas moleculares
- Unha fórmula molecular indica sempre o número exacto de átomos de cada elemento químico que conforman a entidade elemental de substancia, que é a molécula.
Determinación de fórmulas micasquí
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
Actividades
25 Calcula a composición centesimal destes compostos:
- a) Etanal.
- b) Ácido butanoico.
- c) Sulfato de cromo (III).
24 Xustifica por que o etanal e o ácido butanoico teñen a mesma composición centesimal.
25 Calcula a masa de ferro que se pode extraer dunha mostra que contén 3,75 kg de disulfuro de ferro.


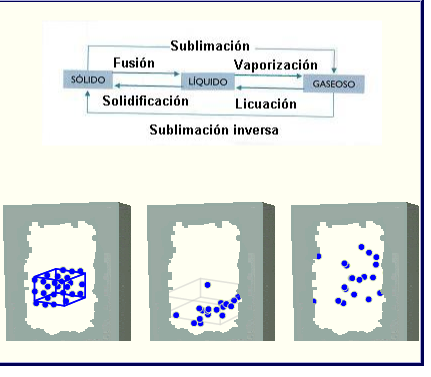
Os estados de agregación
Propiedades do estado sólido
* Teñen forma e volume constantes.
* As súas partículas ordénanse en redes cristalinas e están dotadas de movemento de vibración.
Propiedades do estado líquido
* Teñen volume constante pero adoptan a forma do recipiente que os contén
* As súas partículas teñen liberdade de movemento pero está moi xuntas.
Propiedades do estado gaseoso
* Teñen volume variable e adoptan a forma do recipiente que os contén. Ocupan todo o volume do recipiente que os contén.
* As súas partículas teñen liberdade de movemento e están moi separadas debido a que as forzas entre elas é pequeñísima.
Os estados de agregación



Densidad del mercurio: 13600 kg/m3
densidad
altura
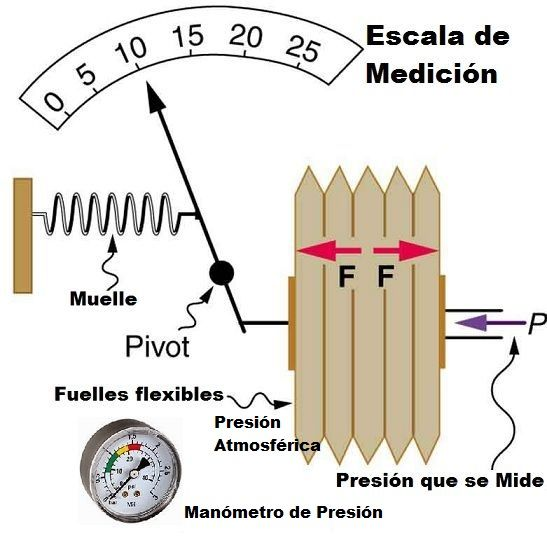
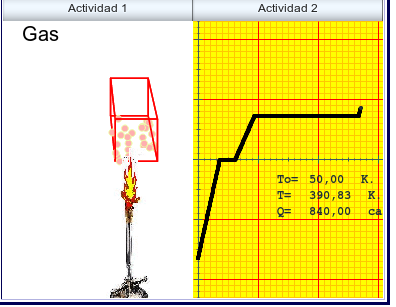
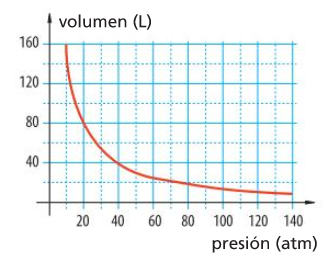
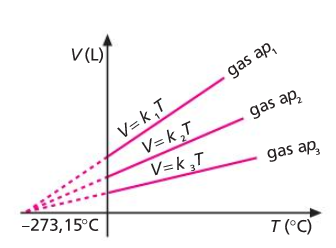
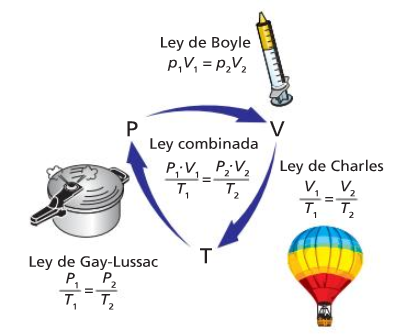
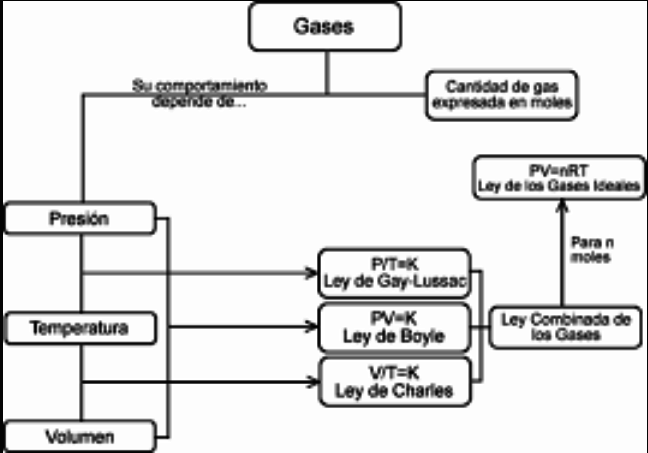
Leis dos gases
Lei de Boyle V=f(P)
Lei de Avogadro V=f(n)
Lei de Gay-Lussac P=f(T)
Lei de Charles-GayLussac V=kT
Lei combinada dos gases

Leis dos gases



Ley de Dalton de las presiones parciales

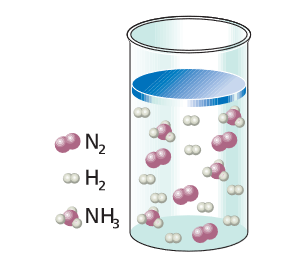
La presión total de la mezcla es igual a la suma de las presiones parciales
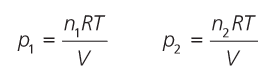
Ley de Dalton de las presiones parciales

La presión total de la mezcla es igual a la suma de las presiones parciales
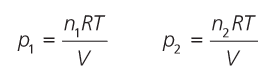

3 Ecuación de estado dun gas ideal
Que é un gas ideal?
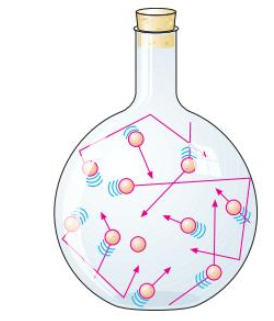
Teoría cinético-molecular

Como ampliación de la teoría atómico-molecular:
1. Los gases están formados por partículas (átomos o moléculas). El tamaño de estas es despreciable comparado con las distancias que las separan, de modo que las interacciones entre ellas también pueden despreciarse.
2. Las moléculas del gas se mueven de forma continua y al azar, chocando entre sí y con las paredes del recipiente que las contiene
3. Los choques que se originan son completamente elásticos, es decir, no hay variación en su energía cinética.
4. La energía cinética media de las moléculas gaseosas Ec = 1/2 m v2 es directamente proporcional a la temperatura de la muestra = kT.
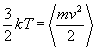
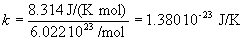
4 Os gases reais
En realidade hai interación entre as moléculas dos gases reais, é por iso que poden chegar a licuarse
4 Ecuación de los gases reales de Van der Waals
p es la presión del gas,
V es el volumen total del recipiente en que se encuentra el gas,
a mide la atracción entre las partículas
b es el volumen disponible de un mol de partículas
n es el número de moles,
R es la constante de los gases ideales,
T es la temperatura, en kelvin.
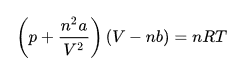
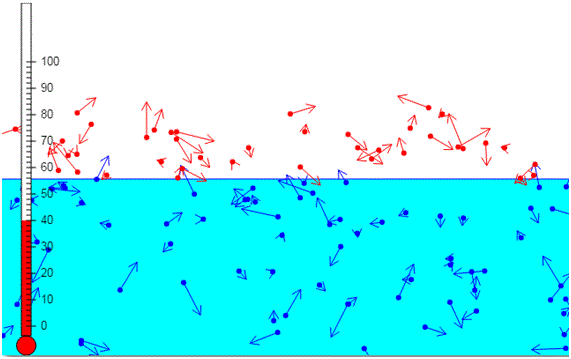
A presión de vapor
Actividades
16 A idea clave da idealidade dun gas supón que non hai interaccións entre as moléculas que o compoñen. Razoa por que estas interaccións son desprezables ou non existen (gas ideal) a baixas presións e altas temperaturas.
17 Calcula a presión que exercen 71,0 g de CI, cando se encontran a 32 °F e ocupando un volume de 2,0•10-3 m3. Compara este valor co obtido supoñendo comportamento ideal.
Solución: preal = 9,9 atm; pideal = 11,2 atm.

Actividades
16 A idea clave da idealidade dun gas supón que non hai interaccións entre as moléculas que o compoñen. Razoa por que estas interaccións son desprezables ou non existen (gas ideal) a baixas presións e altas temperaturas.
17 Calcula a presión que exercen 71,0 g de CI, cando se encontran a 32 °F e ocupando un volume de 2,0•10-3 m3. Compara este valor co obtido supoñendo comportamento ideal.
Solución: preal = 9,9 atm; pideal = 11,2 atm.


Actividades
16 A idea clave da idealidade dun gas supón que non hai interaccións entre as moléculas que o compoñen. Razoa por que estas interaccións son desprezables ou non existen (gas ideal) a baixas presións e altas temperaturas.
17 Calcula a presión que exercen 71,0 g de CI, cando se encontran a 32 °F e ocupando un volume de 2,0•10-3 m3. Compara este valor co obtido supoñendo comportamento ideal.
Solución: preal = 9,9 atm; pideal = 11,2 atm.



Presión de vapor, kPa a 21.1°C: 213.7


Introdución
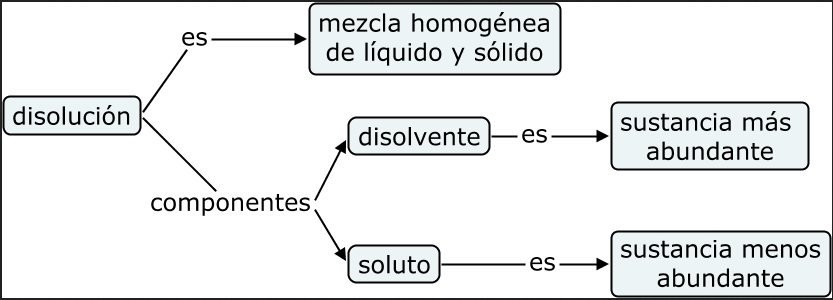
1 Propón tres exemplos de disolucións acuosas, indicando que substancia actúa como soluto e cal como disolvente.
2 Explica brevemente o que significa que unha disolución de sulfato de potasio: a) estea ao 7% en masa; b) sexa 0,5 M.

Disolucións
Tabla
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
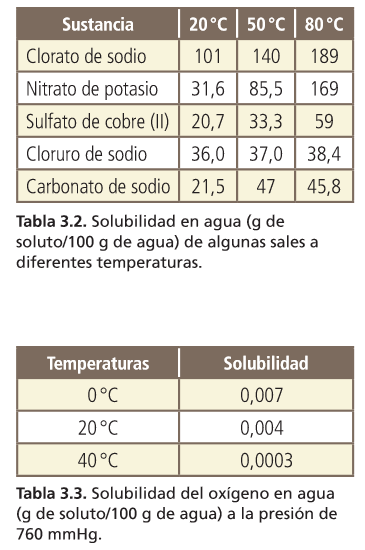
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).
Proceso de disolución
25 Disólvense 0,892 g de KCI en 0,0546 kg de auga. Calcula o% en masa da disolución.
Solución: 1,61 %.
26 Prepárase unha disolución acuosa de etanol disolvendo 20 g desta substancia en 100 g de auga. Calcula:
a) A fracción molar do soluto e do disolvente.
b) A molalidade da disolución.
Solución: a) Xs= 0,07; Xd = 0,93. b) 4,3 mol/kg.
27 A etiquetaxe dun frasco de ácido sulfúrico comercial indica 94,72% e 1,833 g/cm3. Calcula: a) A molaridade da disolución.
b) A masa (en g) de ácido sulfúrico presente en 5 cm3 de disolución.
Solución: a) M = 17,72 mol/L. b) m = 8,68 g.
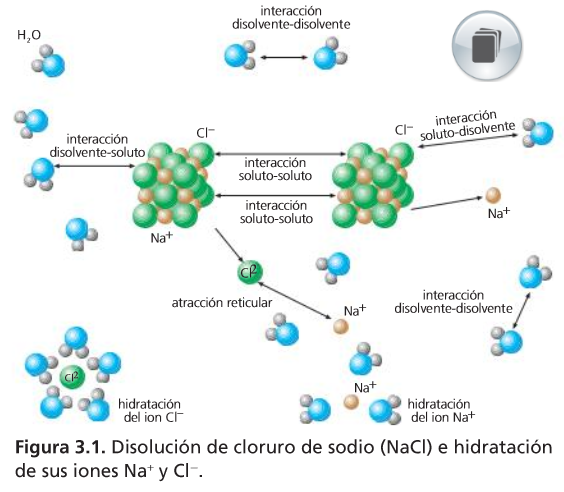
Factores que favorecen la disolución de solutos sólidos
28 Téñense 30 mL dunha disolución acuosa de HCI ao 1,5% en masa e densidade 1,1 g/cm3. Calcula:
a) A masa (en g) de soluto no devandito volume.
b) A molaridade da disolución acuosa.
Solución: a) m = 0,495 g de HCI. b) M = 0,452 mol/L
29 Disponse de dous frascos con disolucións de ácido sulfúrico. O primeiro contén 25 mL de ácido 1,5 M, e o segundo, 50 mL de ácido ao 87,0% e 1,795 g/cm3 de densidade. En que frasco haberá maior número de moléculas de ácido sulfúrico?
30 Calcula as masas de soluto e de disolvente que necesitas para preparar 150 g dunha disolución acuosa de azucre ao 3% en masa.
Solución: 4,5 g de azucre e 145,5 g de auga.
Los factores que favorecen la disolución de lo sólidos son: pulverización, agitación y calentamiento.
I Al pulverizar se aumenta el área superficial del soluto y, con ello, el número de iones o moléculas de disolvente que están en contacto y colisionan con él, de modo que se disolverá antes.
I Al agitar la disolución impedimos que esta se sature alrededor de los cristales de soluto.
I Al calentar incrementamos la agitación molecular y, por tanto, favorecemos la destrucción de la estructura cristalina del soluto.
Los tres factores juntos hacen que el proceso de disolución sea más rápido.
Concentración de una disolución
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).
Se denomina concentración de una disolución a la cantidad de soluto que está disuelto en una determinada cantidad de disolución o de disolvente.
Los términos saturada, concentrada y diluida son aproximaciones cualitativas a la concentración de una disolución. Las formas más comunes de expresar la concentración de una disolución son:
I En unidades físicas (en este caso, no hace falta tener en cuenta la composición de la sustancia disuelta): porcentaje en masa, porcentaje en volumen y masa de soluto por volumen de disolución.
I En unidades químicas (hay que tener en cuenta la composición de la sustancia disuelta): molaridad, molalidad y fracción molar.
Concentración de una disolución
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).


Concentración de una disolución
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).



Solubilidad
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).
Hay sustancias que, en un determinado disolvente, no se disuelven o se disuelven muy poco; en estos casos se dice que son insolubles en él.
También puede ocurrir que una sustancia sea soluble en un disolvente, pero llegue un momento en que el disolvente no admita más cantidad de soluto; si se añade más, el exceso no se disuelve, sino que se deposita en el fondo del recipiente.
Se denomina solubilidad de una sustancia en un determinado disolvente y a una determinada temperatura a la concentración del soluto en su disolución saturada.
Es decir, a la máxima cantidad de soluto que, a esa temperatura, puede disolverse en una cantidad fija de disolvente.
La solubilidad suele expresarse en g de soluto/100 g de disolvente o en g de soluto/L de disolvente.
Variación de la solubilidad con la temperatura
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).
Como la mayoría de los sólidos se disuelven por procesos endotérmicos, en general son más solubles en caliente que en frío (tabla 3.2). El motivo es que se dispone de
más energía para el proceso de disolución. Sin embargo, muchos líquidos y gases, al disolverse mediante procesos exotérmicos, experimentan una disminución de su solubilidad cuando aumenta la temperatura (tabla 3.3).
La representación gráfica de la solubilidad de una sustancia en función de la temperatura, a presión normal, se denomina curva de solubilidad de esa sustancia.
Sobresaturación
Se dice que una disolución está sobresaturada cuando, a una determinada temperatura, tiene disuelta más cantidad de soluto de lo que corresponde a su solubilidad a dicha temperatura.
Variación de la solubilidad con la temperatura
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).
Variación de la solubilidad con la presión
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).
La presión solo influye en la solubilidad de los solutos gaseosos. En general, la solubilidad de un gas en un líquido aumenta cuando se incrementa la presión del mismo sobre el líquido.
Actividades
22 Unha disolución está formada por 15 g de alcohol e 50 g de benceno. Indica de forma razoada que substancia actúa como disolvente. E se tivésemos só 5 g de benceno?
23 A partir das curvas de solubilidade, razoa se poderiamos disolver 30 g de sulfato de sodio en 50 g de auga a 50 °C.
24 Preparamos unha disolución de bromuro de potasio disolvendo 0,25 mol en 50 g de auga a 20°C:
a) É unha disolución saturada?
b) Se baixamos a temperatura a 0 °C, que masa de soluto iría ao fondo do recipiente?
Solución: b) m = 2,25 g de soluto (KBr).

9 Propiedades coligativas das disolucións
Chámanse coligativas aquelas propiedades que só dependen do número de partículas do soluto presentes na disolución e non da súa natureza química.
- Presión de vapor
- Temperatura de conxelación
- Temperatura de ebulición
- Presión osmótica
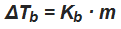
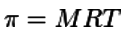
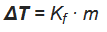
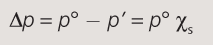
Advertir que estas fórmulas só serven para solutos non iónicos e non volátiles
9 Propiedades coligativas das disolucións iónicas

Actividades
Chámanse coligativas aquelas propiedades que só dependen do número de partículas do soluto presentes na disolución e non da súa natureza química.
- Presión de vapor
- Temperatura de conxelación
- Temperatura de ebulición
- Presión osmótica

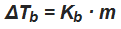
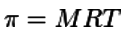
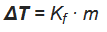
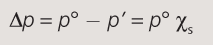
Actividades
Chámanse coligativas aquelas propiedades que só dependen do número de partículas do soluto presentes na disolución e non da súa natureza química.
- Presión de vapor
- Temperatura de conxelación
- Temperatura de ebulición
- Presión osmótica


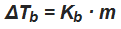
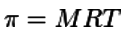
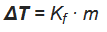
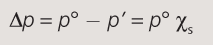
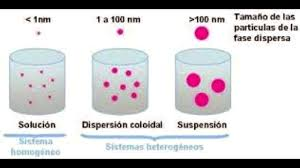
Disoluciones, suspensiones y coloides
Zumo de frutas,
Calima atmosférica
Barro
Pegamento,
Espuma de cerveza,
Crema batida,
Queso,
Gelatina,
Tinta china.
Agua marina,
Agua con alcohol.
8 Técnicas espectrométricas de análise química
Interacción entre a luz e a materia
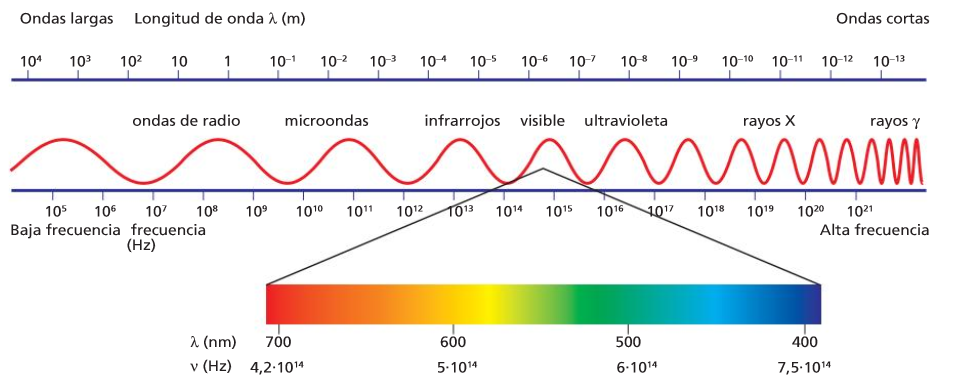
- A espectroscopía óptica é unha técnica de análise, baseada na interacción da luz coa materia, que proporciona información, cualitativa e cuantitativa, dunha substancia obxecto de estudo.
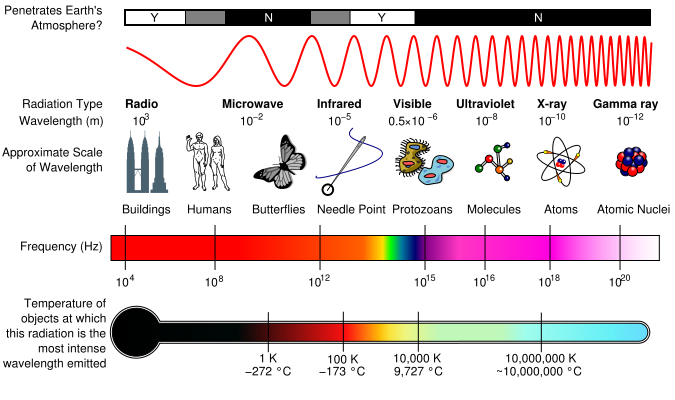
Natureza electromagnética da luz

Historia de los modelos atómicos
Concepto de longitud de onda
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
La radiación electromagnética
Introducción
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
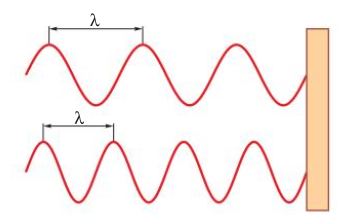
Concepto de longitud de onda
La velocidad de las ondas electromagnéticas
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
Si estamos en el vacío
Longitud de onda
Frecuencia
La radiación electromagnética
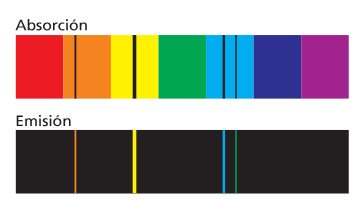
Los espectros discontinuos
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
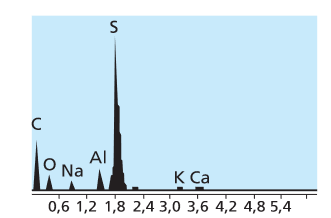
Espectrometría atómica
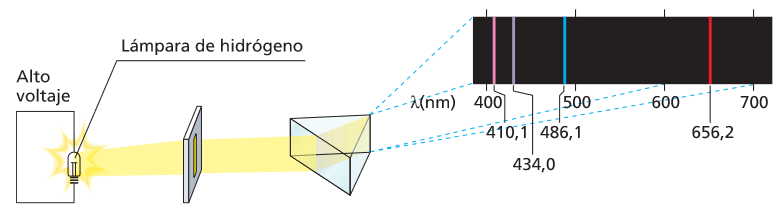
Cando os átomos son excitados cunha fonte de enerxía externa, por exemplo, térmica, emiten luz. Ao descompoñer e analizar esa Iuz obtense un espectro de emisión atómica.
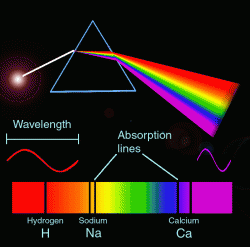
Os espectros atómicos son descontinuos, porque non conteñen todas as frecuencias (ou lonxitudes de onda), senón só algunhas. A cada frecuencia correspóndelle no espectro unha fina raia chamada liña
Actividades
Na web: Busca información para construír o teu propio espectroscopio cun CD. Utilízao para analizar e comparar os espectros de diferentes fontes de luz.
• Busca información sobre a resonancia magnética nuclear (RMN) e as súas aplicacións. Visualiza as simulacións sobre os espectros atómicos que atoparás na web de Anaya.
Actividades
Na web: Busca información para construír o teu propio espectroscopio cun CD. Utilízao para analizar e comparar os espectros de diferentes fontes de luz.
• Busca información sobre a resonancia magnética nuclear (RMN) e as súas aplicacións. Visualiza as simulacións sobre os espectros atómicos que atoparás na web de Anaya.
Outros tipos de espectroscopía
Algunhas técnicas espectroscópicas relevantes |
||
Tipo |
Radiación |
Aplicacións |
|
Espectroscopía atómica |
VISIBLE-UV |
Análise elemental cualitativas e cuantitativa |
|
Espectroscopía Raman |
VISIBLE |
Identificación de grupos e
|
|
Colorimetría |
VISIBLE-UV |
Análise cuantitativa de ións
|
Algunhas técnicas espectroscópicas relevantes |
||
|
Espectroscopía de raios X |
Raios X |
Análise superficial de sólidos e estrutura cristalina |
|
Resonancia magnética nuclear (RMN) |
Ondas radio |
Moléculas inorgánicas, orgánicas e biolóxicas |
|
Espectroscopía de absorción infravermella |
IV |
Enlaces, grupos funcionais, moléculas, polímeros, macromoléculas |
|
Espectroscopía Mossbauer |
Raios γ |
Análise nuclear, detección de isótopos |
Actividades
28 Os fornos de microondas traballan a unha frecuencia de 2,45 GHz. Determina a lonxitude de onda da radiación electromagnética que usan.
Solución: λ= 0,122 m = 12,2 cm.
29 Son certas ou falsas estas proposicións?
a) A luz ultravioleta é visible.
b) A frecuencia do vermello é menor que a do azul.
Actividades
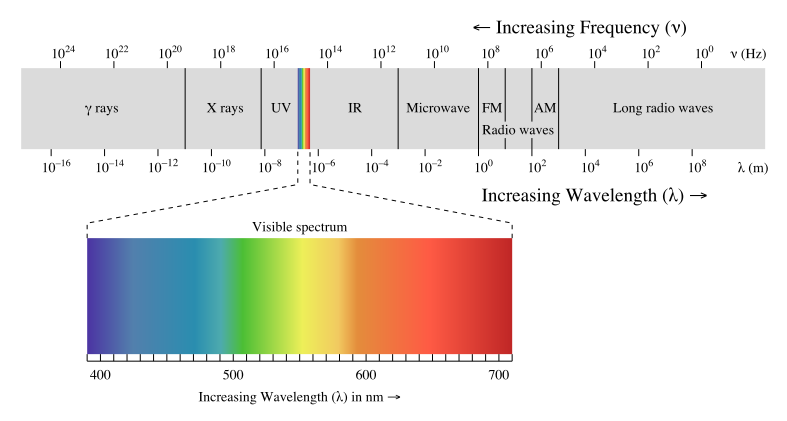
30 Calcula que valores de lonxitude de onda comprende a radiación IV (expresa o resultado en mm e µm).
31 Que significa a palabra «transmitancia» do espectro IV? Por que se expresa en porcentaxe?
32 Normalmente, para a asignación das bandas de absorción utilízase nos espectros IV o número de ondas, n', que se define como n' = 1/λ e adóitase expresar en cm -1. Calcula o valor de n' para unha radiación de frecuencia de 30 THz.
Solución: 1000 cm -1
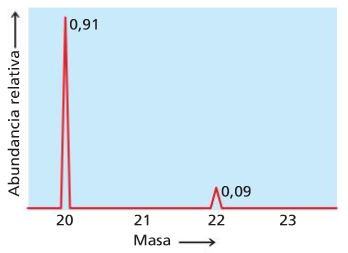
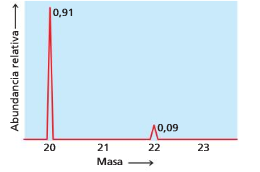
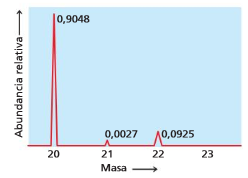
33 Calcula a masa atómica media do neon a partir destes datos de espectrometría de masas:
Ne-20 (90,48%) Ne-21 (0,27%) Ne-22 (9,25%)
19,9924 u |
20,9938 u |
21,9914 u |
Solución: 20,180 u.
34 O espectro de masas do flúor só presenta unha liña. Que indica este feito?
35 Para analizar mesturas, o espectrómetro de masas pode adaptarse a outra técnica que separe os seus compoñentes previamente, como a cromatografía de gases; busca información sobre ela.
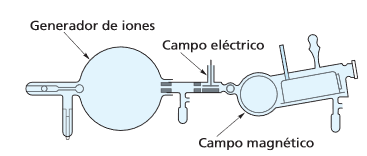
Espectrografía de masas
Introducción
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular


Espectrografía de masas
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
Espectrografía de masas
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular

Espectrografía de masas
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular

Espectrografía de masas
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
Espectrografía de masas
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular

Interacción carga en movimiento-campo magnético
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
Isótopos
- Composición centesimal
- A composición centesimal en masa dun composto expresa a porcentaxe en masa de cada un dos elementos químicos que forman parte del
- Determinación de fórmulas
- A análise química elemental dunha mostra dun composto pode proporcionarnos a súa composición centesimal, e a partir dela pódese determinar a súa fórmula empírica que, xunto co dato da masa molecular (ou, no seu caso, da masa fórmula) permite obter a súa fórmula molecular
Actividades
31 Indica como prepararías 125 cm3 dunha disolución 0,2 M de sulfato de sodio. Necesitamos para certa reacción 1,0 g desta substancia, que volume de disolución debemos tomar? Solución: V = 35,21 cm3.
32 Disponse dun ácido nítrico ao 78,07 % en masa e 1,445 g/cm3 de densidade.
- a) Que volume (en mL) desta disolución será necesario para preparar 250 mL de disolución 2,5 M do devandito ácido?
- b) Tomamos 50 mL da disolución diluída, cal será a súa concentración? Que masa de ácido nítrico puro haberá no devandito volume?
Solución: a) V= 34,9 mL. b) C= 2,5 M; m = 7,875 g.
Actividades
31 Indica como prepararías 125 cm3 dunha disolución 0,2 M de sulfato de sodio. Necesitamos para certa reacción 1,0 g desta substancia, que volume de disolución debemos tomar? Solución: V = 35,21 cm3.
32 Disponse dun ácido nítrico ao 78,07 % en masa e 1,445 g/cm3 de densidade.
- a) Que volume (en mL) desta disolución será necesario para preparar 250 mL de disolución 2,5 M do devandito ácido?
- b) Tomamos 50 mL da disolución diluída, cal será a súa concentración? Que masa de ácido nítrico puro haberá no devandito volume?
Solución: a) V= 34,9 mL. b) C= 2,5 M; m = 7,875 g.
Actividades
33 Que significa a seguinte frase?: « Sumar un soluto non volátil a un disolvente ».
34 Calcula a presión de vapor dunha disolución preparada ao disolver 125 g de sacarosa, C12H22011, en 100 g de auga a 25 °C. Solución: p = 22,37 mmHg.
35 Ao engadir 1 g de urea a 100 mL de auga a 20 °C, a presión de vapor pasa de 17,54 mmHg a 17,49 mmHg. Determina a masa molecular da urea.
Solución: M = 64,17 u.
36 É posible que a auga no laboratorio ferva a 98 °C? Explica brevemente a túa resposta.
37 Dos anticonxelantes da táboa da páxina anterior, indica: Cal garante mellor a non conxelación da auga do radiador por kg de disolvente?
As fórmulas moleculares de benceno, ciclohexano, e alcanfor son C6H6, C6H12 e C10H16O
Actividades
38 O etilenglicol, CH2OHCH2OH, é un anticonxelante usado comunmente nos automóbiles. Ata que temperatura está asegurada a non conxelación da auga do radiador, se este contén 600 g desta substancia en 2,5 kg de auga?
Solución: t = -7,2 °C.
39 Unha mostra de 1,20 g dun soluto non iónico disólvese en 50,0 g de benceno. Sabendo que o punto de conxelación do benceno puro é de 5,48 °C e que, agora, a disolución conxela a 4,92 °C, determina a masa molecular do soluto.
Solución: M = 218,2 u.
40 Calcula a presión osmótica, a 37 °C, dunha disolución acuosa que contén 10 g de sacarosa, C12H22O11, en 250 cm3 da devandita disolución.
Solución: π = 2,97 atm.
TIC: Laboratorios virtuais en Química
Actividades
18 Explica, a partir da TCM, por que ao aumentar a temperatura dun gas aumenta a presión que este exerce (o volume permanece constante).
19 Como sabes, a evaporación é o paso de líquido a gas, pero que só afecta á superficie do líquido. Utiliza a TCM e explica este fenómeno.
20 O proceso de disolución é un fenómeno físico que depende, entre outros factores, da temperatura. No caso das substancias iónicas, obsérvase que a solubilidade aumenta de forma moi xeral coa devandita magnitude física. Como explica a TCM este feito?
Actividades
21 A efusión é un fenómeno físico relacionado coa difusión e consiste no paso das moléculas dun gas do recipiente que o contén ao exterior a través dun pequeno orificio. A lei de Graham establece a relación entre as velocidades de efusión de dous gases distintos, A e B, coas súas respectivas masas molares mediante a expresión . Nunha mestura de O2 e H2 o primeiro gas verte 2•10-2 mol por segundo. Que cantidade de H2 vertería a través do mesmo orificio cada segundo?
Solución: n = 8 • 10-2 mol.
Actividades
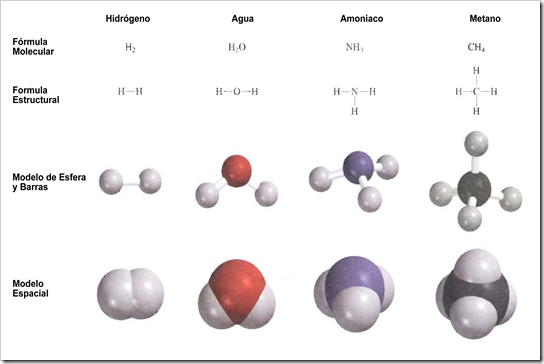
18 Indica a fórmula empírica do ácido acético, o metanol, o amoníaco e o ácido oxálico, cuxas fórmulas moleculares son C2H4O2, CH4O, NH3 e C2H2O4, respectivamente. En cales dos compostos anteriores coinciden a fórmula empírica e a fórmula molecular?
19 Por que nos compostos iónicos utilizamos o concepto de fórmula empírica para dar a súa fórmula química? Cal sería a fórmula do óxido de magnesio, formado por ións e Mg2+ e O2-? E a do cloruro de magnesio, constituído por ións Mg2+ e Cl-? Define brevemente que é unha fórmula estrutural e explica que información adicional proporciona respecto a unha fórmula molecular.
21 A molécula de auga ten forma angular, cun ángulo de enlace HOH, aproximado, de 104°. Debuxa o seu modelo molecular.
22 A partir do código de cores da figura desta páxina, escribe a fórmula molecular dos compostos representados á dereita dela.
Na web:Traballa cos laboratorios virtuais de construción de átomos e moléculas da web de Anaya.