Aineiden ominaisuudet
KE1: Kemiaa kaikkialla 4/4
Sidoksen merkitys
- Ionisidos
-
Voimakas sidos
- kovia aineita, kiteinen ja särmikäs rakenne (hila)
- Korkeat sulamis- ja kiehumispisteet
- Liukeneminen veteen (poolisen liuottimeen)
- Sähkönjohtokyky sulatteena ja vesiliuoksena
-
Voimakas sidos
- Kovalenttinen sidos
-
Kovalenttinen sidos on vahva, mutta molekyylien välinen sidos voi olla todella heikko (molekyyli pooliton)
- Pooliset ja poolittomat molekyylit ja aineet
- Sidosenergioiden erot
- Molekyylien kolmiulotteinen rakenne (vrt. VSEPR-teoria)
- Allotropia
-
Kovalenttinen sidos on vahva, mutta molekyylien välinen sidos voi olla todella heikko (molekyyli pooliton)
- Vetysidos
- Metallisidos
- Sähkönjohtokyky,
- Lämmönjohtokyky
- Metallikiilto, läpinäkymättömyys
- Muokattavuus
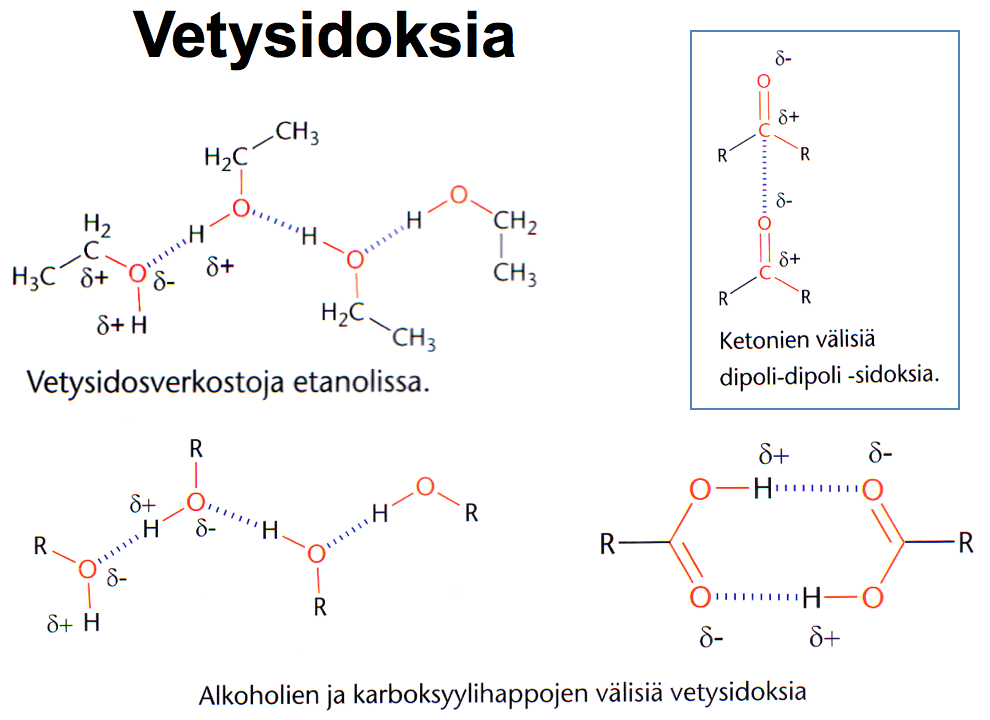
Heikot sidokset ja kiehumispiste


Alkoholit
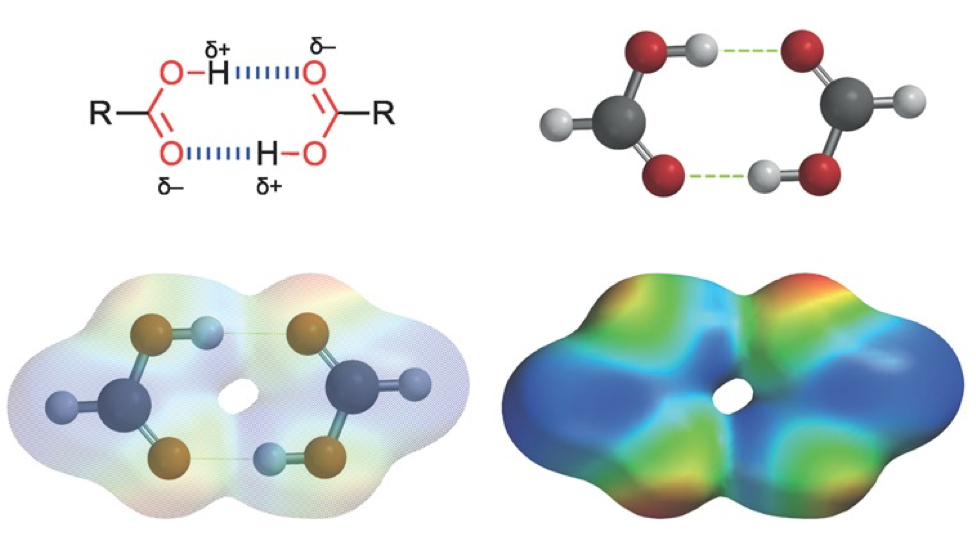
Karboksyylihapot
Vesi
Elektronegatiivisuuserosta johtuvat yhteisen elektroniparin varauksen jakautuminen ja siirtyminen elektronegatiivisemman hapen suuntaan aiheuttavat kuvan osoittamat osittaisvaraukset.
poolinen neste
Happiryhmän alkuaineiden kiehumispisteet kuvassa. Veden kiehumispiste poikkeaa merkittävästi saman ryhmän muiden alkuaineiden vastaavasta linjasta.


Tehtävä 18
Kummalla aineista on korkeampi kiehumispiste?
a) Happikaasu O2 ja typpimonoksidi NO.
b) Vetyfluoridi HF ja vetybromidi HBr.
c) Etanoli CH3CH2OH ja etikkahappo CH3COOH.
Perustele heikkojen vuorovaikutusten avulla.
Liukoisuus

- liuos = nestemäinen, tasakoosteinen seos
- liuotin = aine, jota liuoksessa on eniten
- liuotettava aine

Suolan liukeneminen
- ioni-dipolisidokset
-
vesimolekyylit siirtyvät ioniyhdisteen ionien väliin, jolloin ionisidoksen sähköinen vetovoima heikkenee niin paljon, että ionisidos katkeaa
- ionit irtoavat ionihilasta
- hydratoituminen
Kylläinen liuos
= suolaa liuoksessa niin paljon, että osa suolasta ei liukene liuottimeen, vaan se saostuu liuokseen kiinteänä suolana
Suola voi olla runsas- tai niukkaliukoinen sen mukaan, kuinka paljon sitä liukenee liuokseen. Niukkaliukoista suolaa liukenee vähemmän kuin 1 g/l.
Liukoisuuteen vaikuttaa
-
Poolisuus
-
samanlainen liuottaa samanlaista
-
poolinen aine liukenee pooliseen liuottimeen
- esim. vesiliukoisuus
-
pooliton aine liukenee poolittomaan liuottimeen
- esim. rasvaliukoisuus
-
poolinen aine liukenee pooliseen liuottimeen
-
samanlainen liuottaa samanlaista
-
Molekyylin koko
- mitä suurempi molekyyli, sitä hitaammin se liikkuu ja liukenee





Tehtävä 19
| poolinen | vesiliukoinen | rasvaliukoinen | |
|---|---|---|---|
|
|
|||
|
|
|||
|
|
|||
|
|
|||
|
|
Laita rasti ruutuun, jos yhdisteellä on kuvattu ominaisuus.
Happamuus ja emäksisyys
Vesiliuoksen happamuus ilmoitetaan pH-asteikolla. Tarkkaan ottaen liuoksissa ei kuitenkaan esiinny vapaita vetyioneja, vaan ne sitoutuvat vesimolekyyleihin muodostaen oksoniumioneja
Vesimolekyylit reagoivat keskenään siten, että puhtaassakin vedessä on jonkin verran oksonium- ja hydroksidi-ioneja

Indikaattori on aine, jonka väri muuttuu kemiallisen reaktion osoituksena.
pH-indikaattorin väri muuttuu toisen aineen happamuuden tai emäksisyyden mukaan.
R4. Aineiden ominaisuudet
- tutkitaan aineiden ominaisuuksia kokeellisesti oppikirjasta löytyvien ohjeiden mukaisesti (Kokeellisuus ja mallintaminen)
-
työpistetyöskentelyä:
- Nesteiden tutkiminen: herkkä- ja jäykkäliikkeisyys
- Metallit
- Happamuus ja emäksisyys
- Liukeneminen (uutto)
- Sulamis- ja kiehumispisteet
- Tutkimuksessa on tarkoitus selvittää annettujen puhtaiden aineiden ja kemian työtapojen avulla vahvojen ja heikkojen sidoksien esiintyminen ja merkitys.