REAKTIOYHTÄLÖ JA
SEN KÄYTTÖ
KE3: Reaktiot ja energia 3/5
Reaktioyhtälö
lähtöaineet
reaktiotuotteet
reaktionuoli
osoittaa
- reaktiotyypin
- reaktion suunnan
kemialliset kaavat
- ioniyhdisteen kaava
-
orgaaniset yhdisteet
- suhdekaava
- molekyylikaava
- rakennekaava
olomuodot
olomuotosymboleilla kerrotaan, missä olomuodossa aine on
s kiinteä
l neste
g kaasu
aq vesiliuos
(s)
(aq)
(l)
(g)
(aq)
2
2
+
+
2
+
reaktioyhtälön kertoimet
- molemmilla puolilla reaktioyhtälöä pitää olla yhtä paljon kutakin alkuainetta
- ei murtolukuja
- lukua 1 ei merkitä
Mitä kaikkea tarvitaan reaktioyhtälöön?
Yhdisteen kaava ja nimeäminen
Kemiallinen kaava kertoo
- mistä alkuaineista yhdiste koostuu
- mitkä ovat alkuaineiden suhteelliset lukumäärät toisiinsa verrattuna
empiirinen kaava
= suhdekaava
- yhdisteen alkuaineet
- suhteelliset lukumäärät
molekyylikaava
- alkuaineiden todelliset lukumäärät yhdisteessä
- voidaan laskea suhdekaavasta, jos yhdisteen M tunnetaan
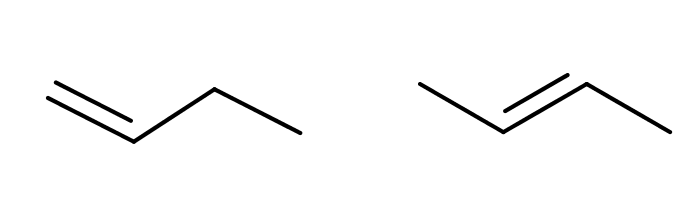
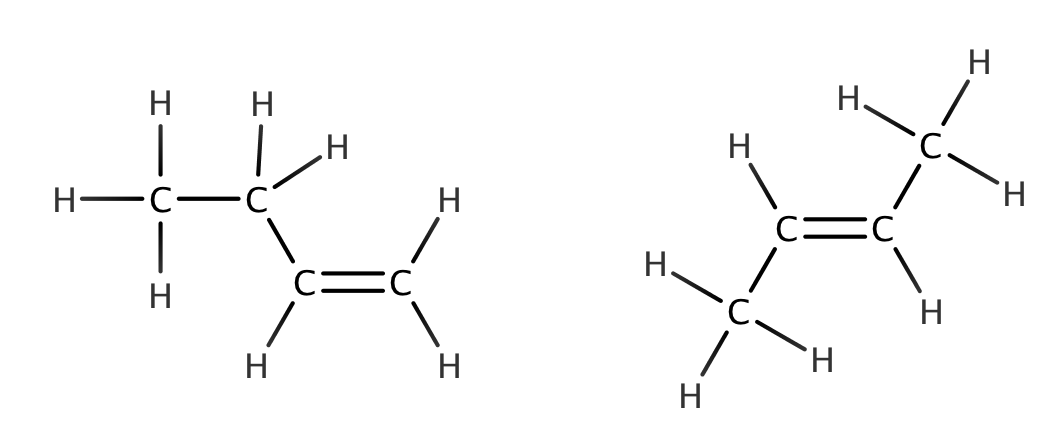
rakennekaava
- kertoo atomien avaruudellisen sijainnin toisiinsa nähden
A1
Ioniyhdisteet
Kaava
1) positiivinen ioni = kationi
2) negatiivinen ioni = anioni
Esim. natriumkloridi NaCl
magnesiumbromidi
bromi-ioneja pitää olla 2 kappaletta, jotta yhdisteen varaukseksi tulee 0
- ionien lukumäärä ei näy yhdisteen nimestä!
- jos alkuaine voi esiintyä useammalla eri hapetusluvulla, kirjoitetaan hapetusluku alkuaineen perään sulkeisiin
rauta(II)oksidi
rauta(III)oksidi
A2
Tehtävä 2: Ioniyhdisteiden rakentaminen
Käy hakemassa lego-setti ja rakenna ioniyhdisteitä setin ohjeiden mukaan. Kaikki settejä ei ole pakko rakentaa!
1) Ioniyhdisteen kaava 1
2) Moniatomiset ionit
3) Luo itse
- Keksi itse, miten voisit mallintaa legojen avulla sulfaattia, sulfiittiä ja sulfidia niin, että rikin erilaiset hapetusluvut kävisivät ilmi mallista.
- Hae erilaisia palikoita tarpeesi mukaan ja selitä ratkaisussasi, mitä milläkin palikalla mallinnetaan. (ei valmista settiä)
- Millaisia yhdisteitä saat aikaiseksi, kun yhdistät edellä mainitut ionit hopea-, kupari- tai kromi-ionin kanssa?
Molekyyliyhdisteet
Kaava ja nimeäminen
Kahdesta alkuaineesta koostuva moniatominen molekyyliyhdiste:
-
Ensimmäiseksi se alkuaine, jolla on pienempi järjestysnumero
- Poikkeuksena yhdisteet, joissa on happi ja jokin halogeeni.
- Saman pääryhmän alkuaineista ensimmäiseksi merkitään alkuaine, jolla on suurempi järjestysluku.
- Toinen alkuaine nimetään vastaavalla tavalla kuin, jos se esiintyisi yhdisteessä anionina ja saa päätteen -idi.
- Etuliitteillä ilmoitetaan alkuaineiden lukumäärät
-
Jos ensimmäiseksi merkittyä alkuainetta on yhdisteessä vain yksi kappale, etuliitettä mono ei käytetä.
- Esim. CO hiilimonoksidi, ei monohiilimonoksidi
Orgaaniset yhdisteet
Kaava ja nimeäminen
-
Pisin hiilirunko
- voi olla suora, haarautunut tai rengasrakenteinen
- funktionaalinen ryhmä
- sivuryhmät aakkosjärjestykseen
etuliite
yhdisteen "pääte"
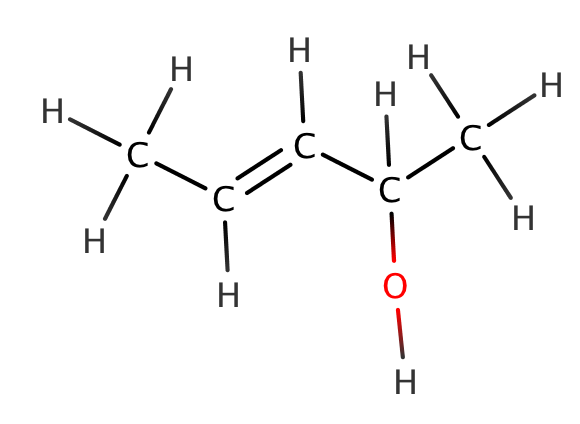
1
2
3
4
5
pent-3-en-2-oli
hiiliketjussa 5 hiiltä
toiminnallisen ryhmän sijainti
toiminnallinen ryhmä
prioriteetiltaan korkein toiminnallinen ryhmä
Kertaa tarvittaessa KE2-kirjasta!
Reaktioyhtälö
- Ilmassa esiintyvät alkuaineet ja yhdisteet kaasuja (g)
- Metallit elohopeaa lukuunottamatta kiinteitä (s)
- Ioniyhdisteet kiinteitä (s)
- Happojen ja emästen vesiliuokset ja muut veteen liuotetut aineet (aq)
- Reaktioon osallistuva vesi nesteenä
- paitsi palamisreaktion tuotteena vesihöyrynä
Olomuodot
Reaktioyhtälö
- merkitään reaktionuolen yläpuolelle (ja alapuolelle, jos olosuhteita paljon)
-
esimerkkejä
-
lämpötila (T tai Δ)
- Δ lämpötilan muutos, kuumennus tai korkea lämpötila (voi olla myös teksti "lämpö" tai "kuumennus")
- T jokin tietty lämpötila
- katalyytit (kat.)
- paine (p)
- liuotin
- säteily (hv)
- [O] hapetusreaktio
-
lämpötila (T tai Δ)
Olosuhteet
Reaktionuolet
reaktio tapahtuu vasemmalta oikealle
reaktio voi tapahtua kumpaan suuntaa tahansa olosuhteista riippuen
tasapainoreaktioissa: sekä etenevä että palautuva reaktio tapahtuvat samanaikaisesti (lisää KE5-kurssilla)
Reaktioyhtälö
Kemiallinen reaktio
Kokonaisreaktio
Nettoreaktio
Kun hopeanitraattiliuosta sekoitetaan kaliumkloridiliuokseen, saostuu reaktioastiaan hopekloridia.
lähtöaineet ja reaktiotuotteet näkyvät reaktioyhtälöstä
reaktion kannalta olennainen osa näkyvissä
Reaktioyhtälön tasapainottaminen
Aineiden häviämättömyyden laki
Jos lähtöaineessa on tietty määrä jotain atomia, on reaktiotuotteissa esiinnyttävä sama määrä kyseistä atomia.
- lähtöaineiden ja tuotteiden eteen etsitään pienimmät mahdolliset kokonaislukukertoimet
- reaktioyhtälön kertoimet ilmaisevat reaktioon osallistuvien aineiden ainemäärien suhteet
Reaktioyhtälön tasapainottaminen
-
Kirjoita lähtöaineiden ja tuotteiden kaavat.
- Alkuaineena vety, happi, typpi, fluori, kloori, bromi ja jodi kirjoitetaan pääsääntöisesti kaksiatomisina molekyyleinä, jalokaasut yksiatomisina.
- Merkitse olomuodot (s, l, g, aq).
-
Valitse jokin alkuaine ja tasapainota sen määrä reaktioyhtälön molemmin puolin kertomalla sopivalla kertoimella.
-
Tasapainota muut alkuaineet samoin.
-
Tarkista sähkövaraukset.
-
Ionivarausten summan pitää olla sama yhtälön molemmilla puolilla.
-
Hapetus-pelkistysreaktioissa luovutettujen ja vastaanotettujen elektronien lukumäärät pitää olla samat yhtälön molemmilla puolilla. Hapetuslukujen kokonaismuutos on nolla.
-
-
Jaa tai kerro yhtälön molemmat puolet sellaisella luvulla, että saat reaktioyhtälöön mahdollisimman pienet kokonaislukukertoimet.
-
Kertoimina hyväksytään vain kokonaisluvut, murtoluvut pitää muuttaa kokonaisluvuiksi.
-
- Tarkista kaikki luvut ja lukumäärät.
Esimerkki
Muodosta tasapainotettu reaktioyhtälö propanolin palamiselle.
6
8
3 C
8 H
1 O + 2 O
Vetyä parillinen määrä, happea pariton määrä
propanolille pitää laittaa parillinen kerroin
1 C
2 H
2 O + 1 O
2
6 C
16 H
2 O + 2 O
6 C
16 H
12 O + 8 O
9
18 O
Reaktiosarjat
-
reaktiosarja, jossa haluttu tuote syntyy monien peräkkäisten reaktioiden kautta
- edellisen vaiheen tuote toimii seuraavan vaiheen lähtöaineena
-
peräkkäisiä vaiheita kutsutaan osareaktioiksi
- jokaiselle vaiheelle voidaan kirjoittaa oma reaktioyhtälö
- kokonaisreaktioyhtälö kuvaa kaikki vaiheet lähtöaineista tuotteeksi
Peräkkäiset reaktiot
- Kirjoita osareaktiot allekkain siinä järjestyksessä kuin ne tapahtuvat ja tasapainota reaktioyhtälöt.
-
Muokkaa edeltävä ja seuraava osareaktio niin, että jokin tai jotkin edeltävän reaktion tuotteiden ja seuraavan reaktion lähtöaineiden kertoimet ovat samoja. Tee näin kaikille osareaktioille
-
Laske reaktioyhtälöt yhteen kirjoittamalla kaikki lähtöaineet reaktioyhtälön vasemmalle puolelle ja kaikki tuotteet oikealle puolelle.
-
Supista ylimääräise aineet, joita esiintyy reaktioyhtälön molemmilla puolilla.
Kokonaisreaktion kirjoittaminen
Esimerkki
Erästä freonia, difluoridikloorimetaania, voidaan valmistaa seuraavasti:
Laske tarvittavan kloorikaasun massa, kun valmistetaan 0,156 g difluoridikloorimetaania.
Ratkaisu
2
4
4
2
Tasapainotetaan ensin osareaktiot ja muodostetaan kokonaisreaktiolle yhtälö:
Lasketaan difluoridikloorimetaanin ainemäärä:
Reaktioyhtälöstä nähdään, että
Vastaus: Klooria tarvitaan 0,366 g
Rinnakkaiset reaktiot
Reaktiosarjat
- useita toisistaan riippumattomia reaktioita reaktioseoksessa
- samoista lähtöaineista samoissa olosuhteissa rinnakkaisissa reaktioissa eri tuotteita
Seoslaskut
- jokaiselle reaktiolle oma reaktioyhtälö
- kaikkia aineita käsitellään laskennallisesti erikseen
- reaktioyhtälöitä EI saa laskea yhteen!
Tasapainotetun reaktioyhtälön käyttö
- Selvitä, mitä kysytään. Merkitse näkyviin tunnettujen suureiden kirjaintunnukset, lukuarvot ja yksiköt.
- Kirjoita tasapainotettu reaktioyhtälö. Muista olomuodot!
- Selvitä tarvitsemasi suureyhtälöt.
- Huomioi yksiköt ja merkitsevät numerot.
Saanto
-
kemiallisessa reaktiossa muodostuu vain harvoin tuotteita yhtä paljon kuin reaktioyhtälön perusteella voisi olettaa
- osa aineista jää reagoimatta
- tuotetta kuluu jatkoreaktioon
- reaktion aikana käsittelyssä "katoaa" aineita
- saanto = muodostuvan aineen määrä
- teoreettinen saanto = määrä, joka tuotetta pitäisi reaktioyhtälön mukaan muodostua
- todellinen saanto = laboratoriokokeessa valmistetun tuotteen määrä
- saantoprosentti kuvaa laboratoriotyöskentelyn laatua ja tehokkuutta
Reaktion rajoittava tekijä
Jos tehtävässä ilmoitetaan useamman kuin yhden lähtöaineen ainemäärä, on laskettava, mikä aine loppuu ensin.
Ensin loppuva aine = reaktion rajoittava tekijä
Esimerkki: Rajoittava tekijä
Riston herkkupizza
pohja:
3 dl durumjauhoja
1,5 dl vettä
ripaus suolaa
ripaus leivinjauhetta
1,5 rkl öljyä

täyte:
200 g salamia
3 tomaattia
4 isoa herkkusientä
12 mustaa oliivia
150 g paprikaa
Linda päätti valmistaa niin monta Riston herkkupizzaa vierailleen kuin mahdollista. Hänellä oli jo kotona pohja-ainekset valmiiksi ja kaupasta hän osti 17 tomaattia, 1 kg salamia, 18 herkkusientä, 54 oliivia ja 600 g paprikaa.
Mikä oli rajoittava tekijä ja kuinka monta pizzaa Linda pystyi tekemään?
Salami:
Tomaatit:
Herkkusienet:
Paprika:
Paprikaa riittää vain 4 pizzaan, joten paprika on rajoittava tekijä.