KE2: Ihmisen ja elinympäristön kemiaa 5/6
MOLEKYYLIN AVARUUDELLINEN RAKENNE
Molekyylin muoto
Ulkokuoren elektroniparien repulsioteorian avulla voidaan ennustaa molekyylin muotoa. Perusajatuksena on, että
- kovalenttisen sidoksen muodostuessa atomiorbitaalit osuvat toisiinsa ja menevät osittain päällekkäin, koska ulkoelektronit pariutuvat
- muodostuneet sidokset suuntautuvat avaruudessa mahdollisimman kauas toisistaan, koska sidoselektronit hylkivät toisaan (repulsio)
- jos keskusatomille jää vapaita elektronipareja, ne vaikuttavat molekyylin muotoon.
- erilaiset molekyylit ovat erimuotoisia
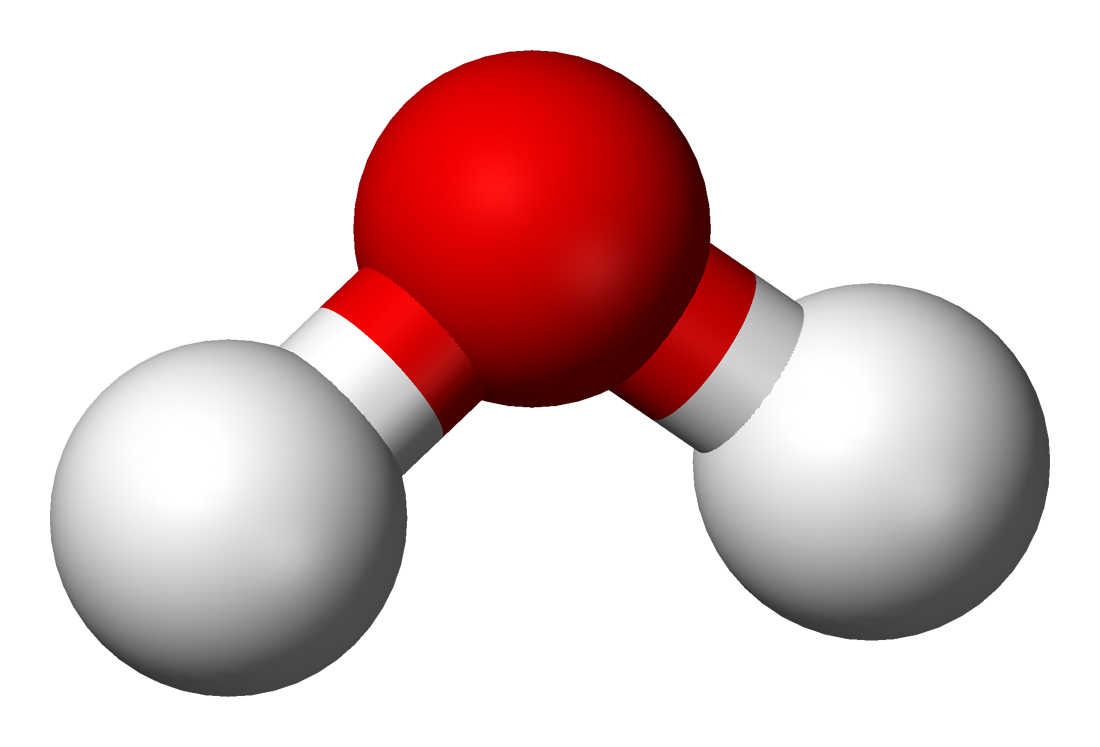

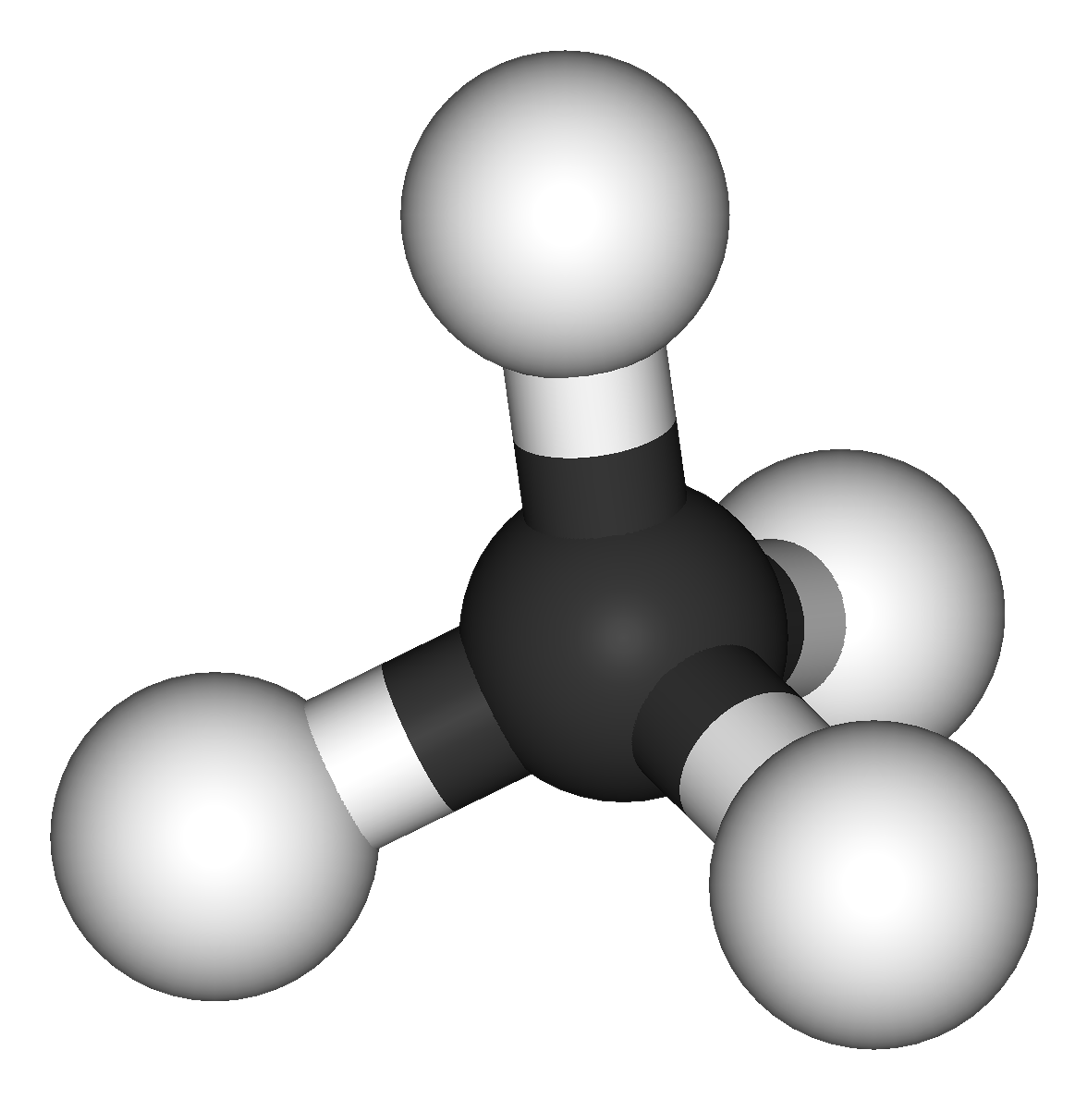

VSEPR-teoria
(Valence shell electron pair repulsion theory)
Tutustukaa simulaation avulla molekyylin muodon määrittämiseen VSEPR-teoriassa. Pyrkikää selvittämään vastaukset seuraaviin kysymyksiin:
Ryhmätehtävä 5
- Mikä näyttäisi olevan perusohje siihen, miten ryhmät (= yksinkertaisella, kaksois- tai kolmoissidoksella sitoutuneet atomit tai vapaat elektroniparit) järjestäytyvät?
- Mikä on suurin ero vapaiden elektroniparien ja muiden ryhmien sitoutumisessa?
- Miten vapaat elektroniparit vaikuttavat molekyylin muotoon?
- Miten ryhmien määrä vaikuttaa molekyylin muotoon?
- Minkämuotoisia molekyylejä pystytään muodostamaan? Miten nämä muodot voidaan nimetä?
- Mikä vaikuttaa sidoskulmiin?
Tutustukaa simulaatioon ja varmistakaa, että koko ryhmä ymmärtää, miten VSEPR-teoria toimii. Valmistautukaa selittämään teoria suullisesti opettajalle (EI kirjallista palautusta).
Molekyyliorbitaalit
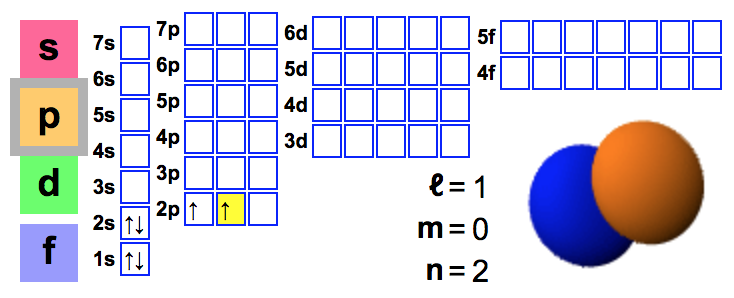
Hiilen elektronirakenne
Kovalenttinen sidos muodostuu, kun
- sitoutuvat atomit jakavat elektroniparin
- sitoutuvien atomien atomiorbitaalit sulautuvat yhteen
molekyyliorbitaali
+
atomiorbitaalit
molekyyli-orbitaali
Vetysidoksen muodostuminen
- kun kovalenttinen sidos muodostuu, muuttuvat vain uloimpien energiatasojen orbitaalit
- sisempiä orbitaaleja voidaan edelleen kuvata atomiorbitaalien avulla
Hiilen sitoutuminen
-
hiili voi muodostaa 4 sidosta
- 2s- ja 2p-orbitaalit muodostavat sidoksia
- pitäisi muodostua kahdenlaisia sidoksia
- tutkimusten mukaan esim. metaanissa 4 samanlaista sidosta
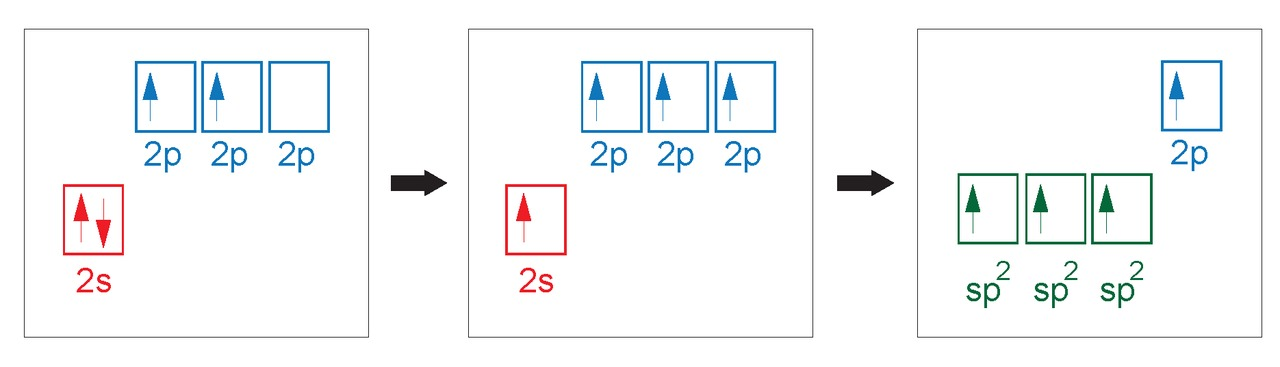
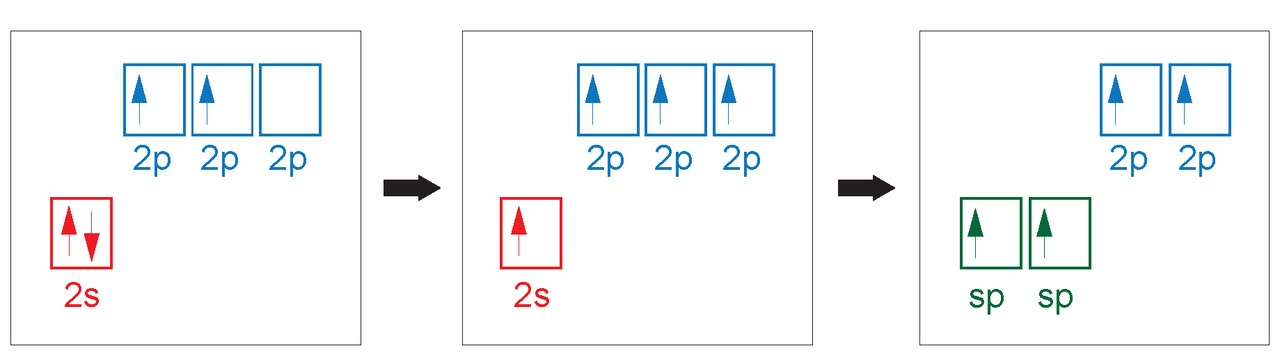
Hybridisaatio
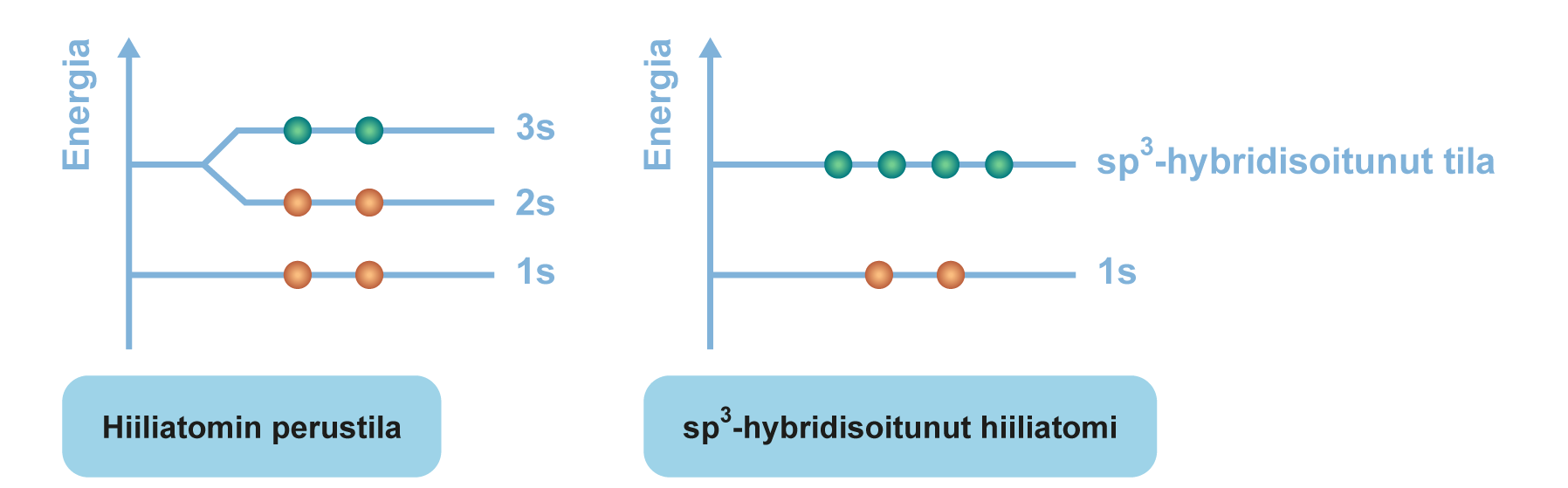

- sidoksiin osallistuvat s- ja p-orbitaalit hybridisoituvat ja muodostavat uusia hybridiorbitaaleja
- hybridiorbitaalien energia on suurempi kuin s-orbitaalin, mutta pienempi kuin p-orbitaalin
Hybridisaatio
Totta vai tarua?
A) Propaanimolekyylissä kaikki kolme hiiliatomia ovat -hybridisoituneita.
B) Eteenimolekyylissä toinen hiiliatomi on -hybridisoitunut ja toinen sp-hybridisoitunut.
C) Bentseenin kaikki hiiliatomit ovat sp-hybridisoituneet.
D) Hiiliatomien hybridisoitumattomat 2p-orbitaalit voivat muodostaa toisiinsa liittyessään π-orbitaalin.
Totta.
Tarua.
Totta.
Tarua.
ORGAANISTEN YHDISTEIDEN ISOMERIA
Isomeria
Isomeerit = yhdisteitä, joilla on sama molekyylikaava, mutta eri rakennekaava
Rakenne- eli konstituutioisomeria
- atomien sitoutumisjärjestys on erilainen
Avaruus- eli stereoisomeria
- sama rakenne, mutta atomit tai atomiryhmät suuntautuvat avaruudessa eri tavoin
- Konformaatioisomeria
- Cis-trans-isomeria
- Optinen isomeria
- Ketju- eli runkoisomeria
- Paikkaisomeria
- Funktioisomeria
Rakenne- eli konstituutioisomeria
1) Ketju- eli runkoisomeria
- hiiliketju on haarautunut eri tavoin
-
vaikuttaa hiiliyhdisteiden sulamis- ja kiehumispisteisiin
- suoraketjuisten hiilivetyjen sulamis- ja kiehumispisteet ovat korkeammat kuin yhtä monta hiiltä sisältävillä haarautuneilla hiilivedyillä
- dispersiovoimat vaikuttavat suoraketjuisilla molekyyleillä isommalle alalle kuin haaratuneilla molekyyleillä
- suoraketjuisten hiilivetyjen sulamis- ja kiehumispisteet ovat korkeammat kuin yhtä monta hiiltä sisältävillä haarautuneilla hiilivedyillä
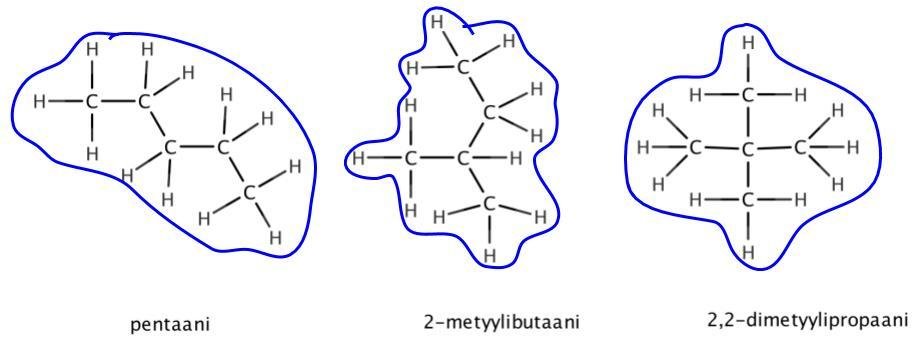
kiehumispiste 36 °C
kiehumispiste 28 °C
kiehumispiste 10 °C
Rakenne- eli konstituutioisomeria
2) Paikkaisomeria
- funktionaalisen ryhmän paikka vaihtelee


Rakenne- eli konstituutioisomeria
3) Funktioisomeria
- molekyyleissä eri funktionaaliset ryhmät
- ominaisuudet poikkeavat merkittävästi!

Avaruus- eli stereoisomeria
1) Konformaatioisomeria
-
hiiliketjuun liittyneet ryhmät pääsevät kiertymään yksinkertaisen sidoksen ympäri
- molekyylien asento on erilainen

Avaruus- eli stereoisomeria
2) Cis-trans-isomeria
- esiintyy yhdisteillä, joissa on kaksoissidos tai rengasrakenne
- kaksoissidos on "jäykkä", joten atomit / atomiryhmät eivät pääse kiertymään sen ympäri
- cis-muoto
- atomiryhmät samalla puolella kaksoissidosta tai rengasta
- trans-muoto
- atomiryhmät eri puolilla kaksoissidosta tai rengasta



Avaruus- eli stereoisomeria
3) Optinen isomeria
-
esiintyy yhdisteillä, joilla on asymmetrinen hiiliatomi eli kiraliakeskus
- kiraliakeskus = hiiliatomi, johon on liittynyt 4 erilaista ryhmää
- merkitään tähdellä *
- optiset isomeerit ovat toistensa peilikuvia

- raseeminen seos = seos, joka sisältää jonkin yhdisteen molempia optisia isomeerejä yhtä paljon