Hapot ja emäkset
KE6: Kemiallinen tasapaino 3/4
Protonin-siirto-reaktiot
Keskeiset asiat:
-
happo, emäs
-
vastinhappo, vastinemäs
-
protoninsiirtoreaktio
-
amfolyytti
-
hapan oksidi
-
emäksinen oksidi
Sidos 6: Luku 6
Hapot ja emäkset
Brønstedin happo-emästeoria
Happo HA luovuttaa vetyionin eli protonin.
Emäs B vastaanottaa vetyionin eli protonin.
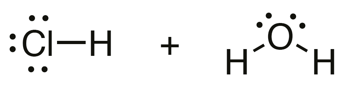
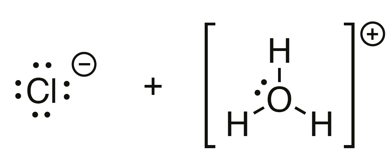
Kaikki happo-emäsreaktiot ovat protoninsiirtoreaktioita.
vety-atomi
vetyioni eli protoni
oksoniumioni \(\mathrm{H_3O^+}\)
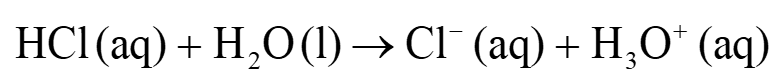
Protoninsiirtoreaktio
- Protoninsiirtoreaktiossa happo luovuttaa protonin ja emäs vastaanottaa sen.
happo
vastinemäs
emäs
vastinhappo
aiheuttaa liuoksen happamuuden
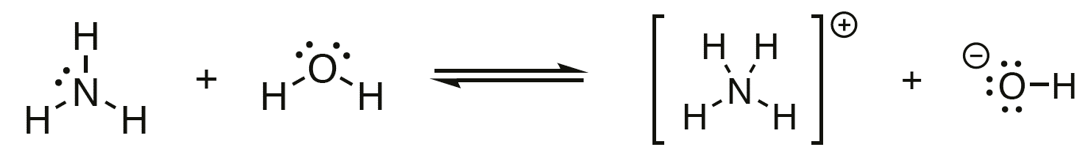
emäs
happo
vastinemäs
vastinhappo
aiheuttaa liuoksen emäksisyyden
Veden kanssa tapahtuvissa protoninsiirtoreaktiossa muodostuu kaksi happo-emäsparia.
Happojen rakenne
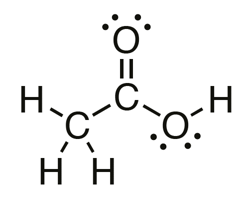
Mikä vety irtoaa etikkahaposta?
- Irtoava vetyatomi on sitoutunut erittäin elektronegatiiviseen atomiin (esim. happi)
- Kun elektronegatiivisen atomin ja vetyatomin välinen sidos katkeaa, molemmat sidoselektronit jäävät elektronegatiivisemmalle atomille
\(\rightarrow\) vety irtoaa protonina

\(\mathrm{H^+}\)
Moniarvoinen happo tai emäs
- voi protolysoitua useamman kuin yhden kerran
- esim. rikkihappo \(\mathrm{H_2SO_4}\)
- esim. kalsiumhydroksidi \(\mathrm{Ca(OH)_2}\)
Amfolyytti
- aine, joka voi sekä luovuttaa että vastaanottaa protonin eli toimia sekä happona että emäksenä
- amfolyytti on amfoteerinen aine
- esim. vesi \(\mathrm{H_2O}\)
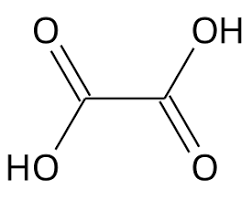
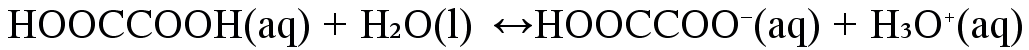
Esimerkki
a)
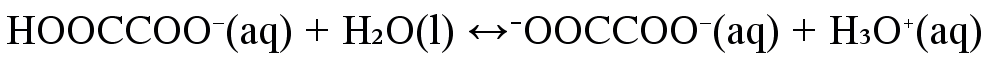
voi vielä protolysoitua
happo
vastinemäs
emäs
vastinhappo
happo
vastinemäs
emäs
vastinhappo
Vetyoksalaatti-ioni \(\mathrm{HOOCCOO^-(aq)}\) voi toimia sekä happona että emäksenä eli se on amfolyytti.
Kirjoita yhdisteen kaikki protoninsiirtoreaktiot, kun se reagoi veden kanssa.
Esimerkki
Kirjoita yhdisteen kaikki protoninsiirtoreaktiot, kun se reagoi veden kanssa. Tarkastele fosforihaposta \(\mathrm{b)\ H_3PO_4}\) muodostuvia muotoja. Mitkä voivat toimia ainoastaan happona tai emäksenä, mitkä ovat amfolyyttejä?
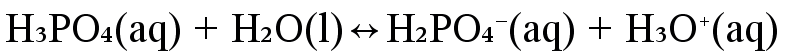
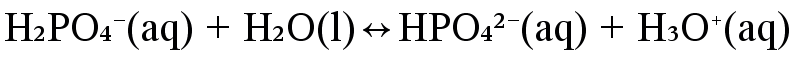
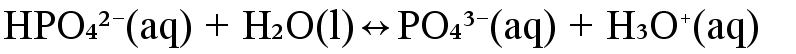
happo
emäs
amfolyytti
amfolyytti
Oksidien happamuus ja emäksisyys
Alkali- ja maa-alkalimetallien oksidit
- ioniyhdisteitä
- vesiliuoksena emäksinen liuos
Epämetallien oksidit
- eivät ole ioniyhdisteitä
- vesiliuoksena hapan liuos
Muut oksidit
- amfoteerisia tai neutraaleja liuoksia
epämetallit
alkalimetallit
maa-alkalimetallit
Vahvat ja heikot hapot ja emäkset
Keskeiset asiat:
-
heikko ja vahva happo
-
heikko ja vahva emäs
-
happovakio
-
emäsvakio
Sidos 6: Luku 7
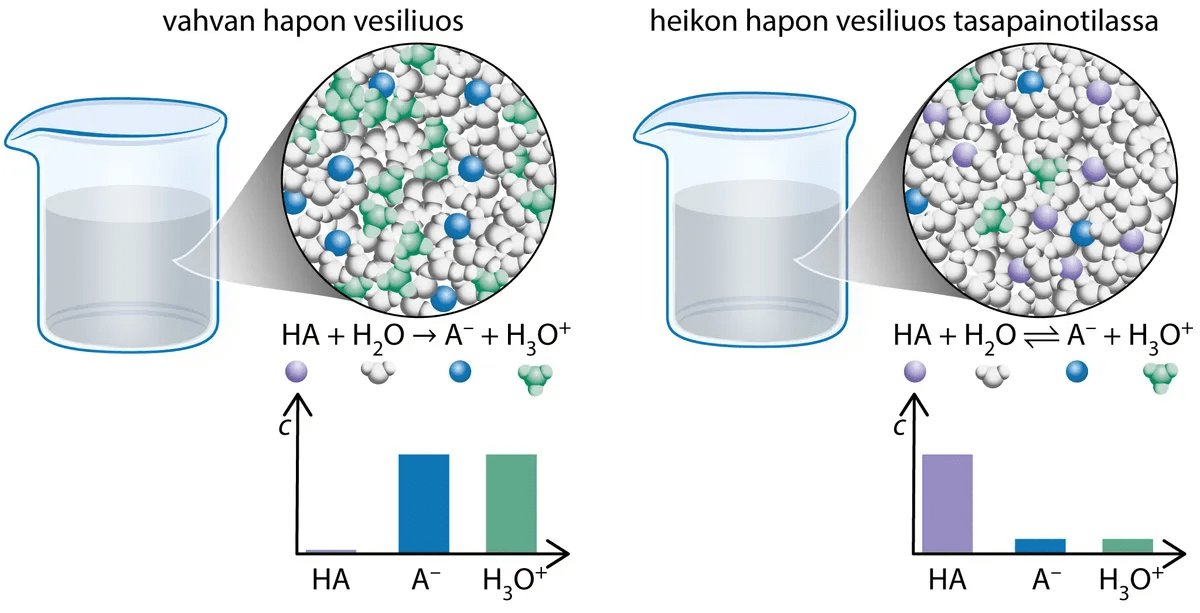
Vahva ja heikko happo
- vahva happo protolysoituu (lähes) täysin
- heikko happo protolysoituu vain osittain
happamampi kuin heikko happo
0,10 M
0,10 M
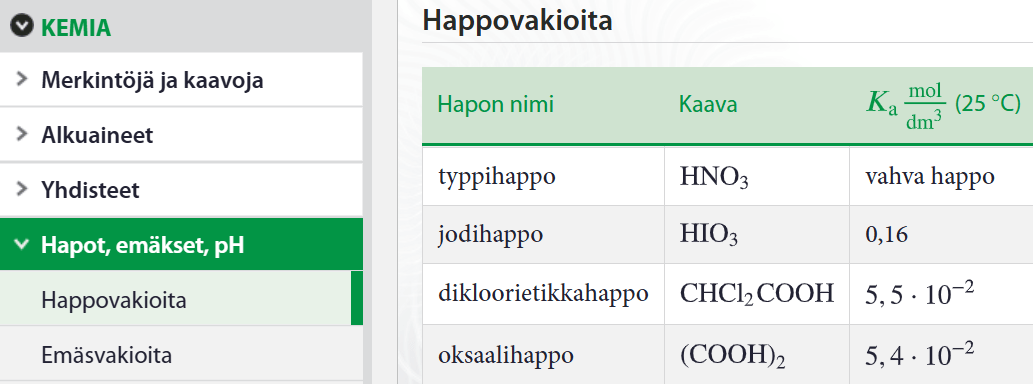
Heikon hapon protolysoituminen
- protolysoitumisreaktio on tasapainoreaktio
\(\rightarrow\) reaktiolle voidaan määrittää tasapainovakio
Veden konsentraatio on niin suuri, ettei sitä oteta huomioon happovakion lausekkeessa!
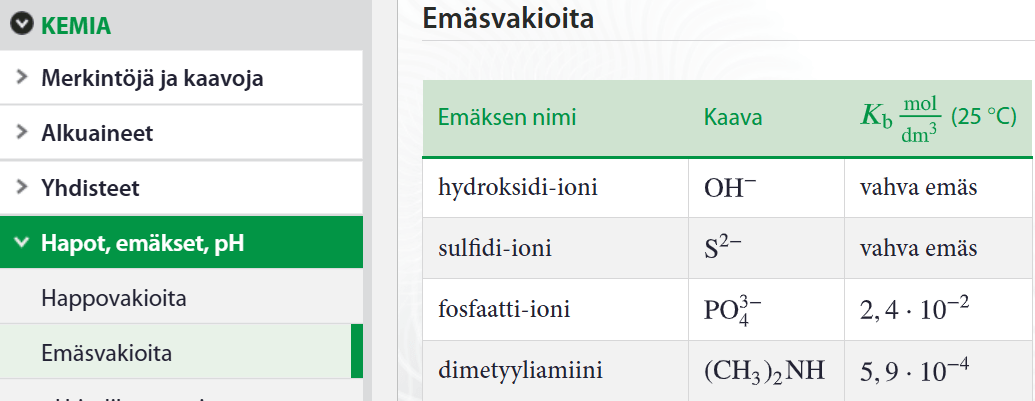
Heikon emäksen protolysoituminen
- protolysoitumisreaktio on tasapainoreaktio
\(\rightarrow\) reaktiolle voidaan määrittää tasapainovakio
Veden konsentraatio on niin suuri, ettei sitä oteta huomioon emäsvakion lausekkeessa!
Esimerkki
Kumpi on vahvempi happo bentsoehappo vai fenoli?

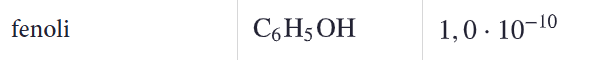
Mitä vahvempi happo on kyseessä, sitä enemmän oksoniumioneja liuokseen muodostuu. Mitä suurempi happovakion arvo on, sitä enemmän tuotteita tasapainotilassa esiintyy.
Bentsohappo on vahvempi happo.
Aminohapot

- sisältävät happona toimivan karboksyyliryhmän ja emäksenä toimivan aminoryhmän
- molekyylissä tapahtuu sisäinen protoninsiirtoreaktio
pH ja pOH
Keskeiset asiat:
-
pH
-
veden protoninsiirtoreaktio
-
veden ionitulo
-
neutraali, hapan ja emäksinen liuos
-
pOH
-
indikaattori
Sidos 6: Luku 8
Liuoksen pH ja oksoniumionikonsentraatio
- liuoksen happamuutta mitataan pH-arvolla
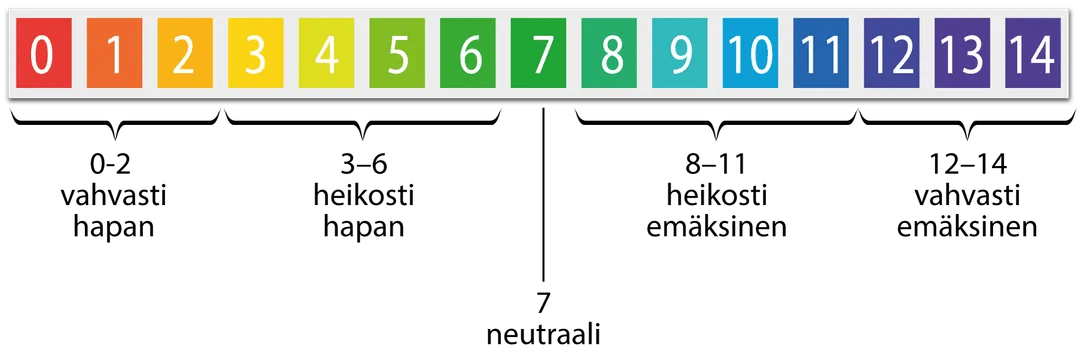
Esimerkki
a) Liuoksen oksonium-ionikonsentraatio on 0,00035 mol/l. Mikä on liuoksen pH?
b) Liuoksen pH on 8,40. Mikä on liuoksen oksonium-ionikonsentraatio?
pH:ssa merkitseviä numeroita ovat pilkun jälkeen tulevat numerot
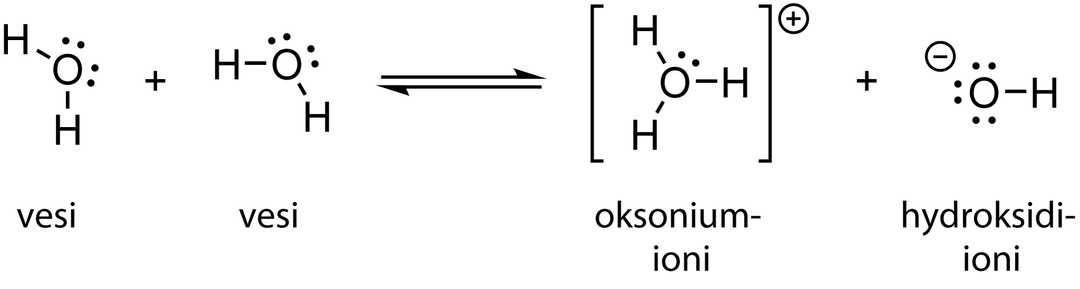
Veden autoprotolyysireaktio
- vesi on amfolyytti
- vesimolekyylit voivat reagoida myös keskenään, jolloin osa toimii happoina ja osa emäksinä
- vesi on sekä happona että emäksenä hyvin heikko, koska vain pieni osa vesimolekyyleistä reagoi protoninsiirtoreaktiossa
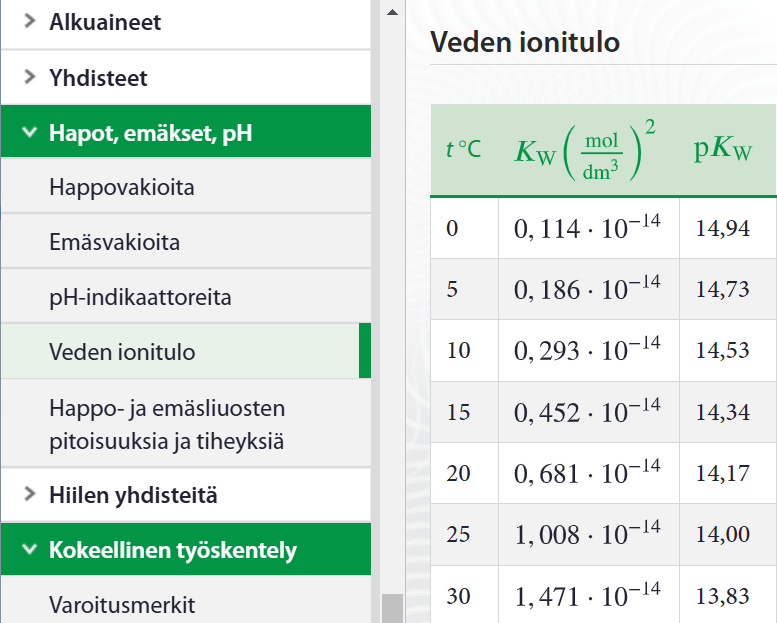
Veden ionitulo
- veden protoninsiirtoreaktion tasapainovakion lauseke
veden konsentraatio niin suuri, ettei se vaikuta tasapainoasemaan
veden ionitulo
- riippuu lämpötilasta, 25 \(^\circ\)C lämpötilassa arvo \(1{,}008\cdot10^{-14}\)
- veden ionitulon avulla voidaan ratkaista oksonium- ja hydroksidi-ionikonsentraatiot
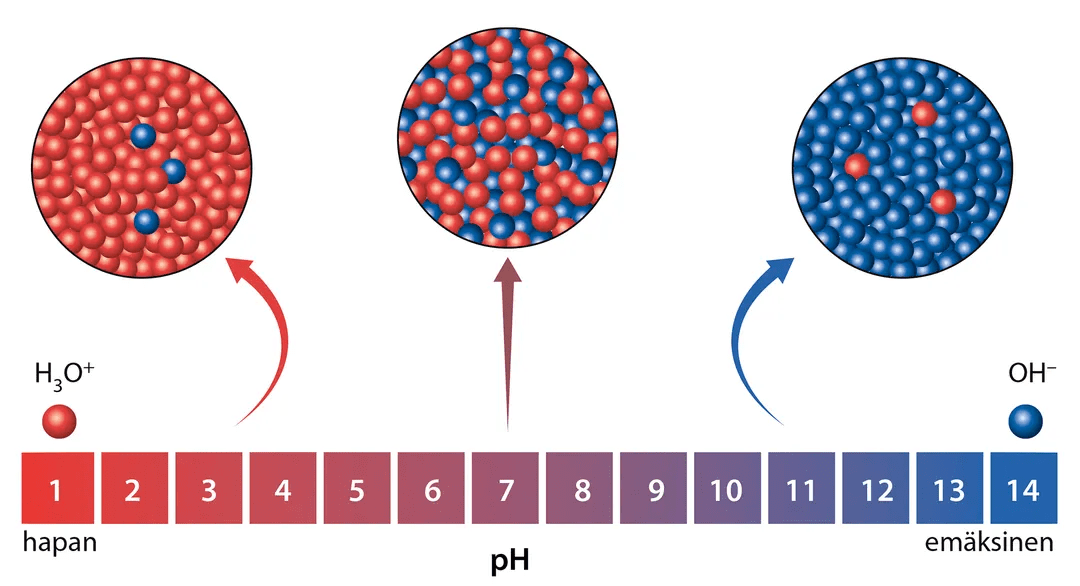
Liuoksen pH
- Liuoksen pH määräytyy sen sisältämien oksoniumionien ja hydroksidi-ionikonsentraatioiden suhteen mukaan
neutraali liuos
\(\mathrm{[H_3O^+]=[OH^-]}\)
hapan liuos
\(\mathrm{[H_3O^+]>[OH^-]}\)
emäksinen liuos
\(\mathrm{[H_3O^+]<[OH^-]}\)
pOH
pH:n ja pOH:n yhteys
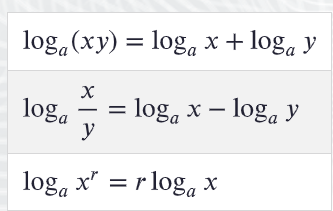
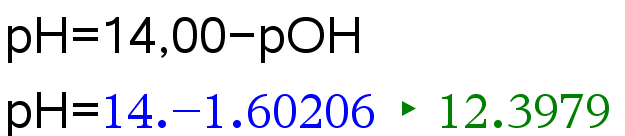
25 \(^\circ\)C lämpötilassa pH+pOH=14,00
Esimerkki
Typpihappoliuoksen oksoniumionikonsentraatio on 0,01 mol/l.
a) Mikä on liuoksen pH?
b) Mikä on liuoksen pOH?
Ratkaisu:
a)
b)
Jos lämpötilaa ei erikseen sanota, oletetaan sen olevan 25 \(^\circ\)C.
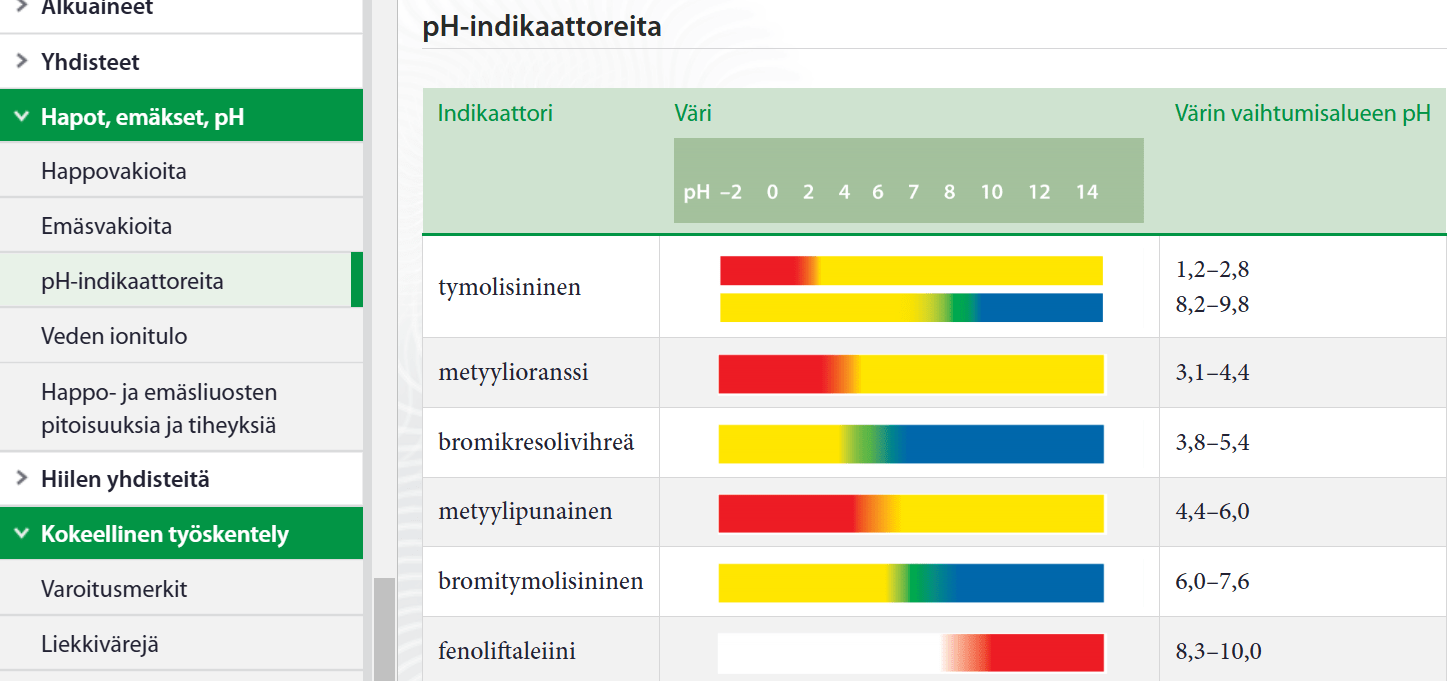
Indikaattorit
- orgaanisia heikkoja happoja tai heikkoja emäksiä
- eri värisiä happamassa ja emäksisessä ympäristössä
- osa luonnon kasveista toimii indikaattoreina


\(\mathrm{p}K_a\ \mathrm{ja\ p}K_b\)
Happo- ja emäsvakioiden vertaileminen on helpompaa, jos luvut eivät ole kymmenpotenssimuodossa
Liuoksen pH
Keskeiset asiat:
-
vahvan hapon ja emäksen pH-arvon laskeminen
-
heikon hapon ja emäksen pH-arvon laskeminen
-
ionisoitumisaste
Sidos 6: Luku 9
Vahvan hapon ja emäksen pH
- vahva happo protolysoituu täysin
- vahva emäs protolysoituu täysin
Esimerkki
Natriumhydroksidiliuoksen konsentraatio on 0,025 M. Mikä on liuoksen pH?
Ratkaisu:
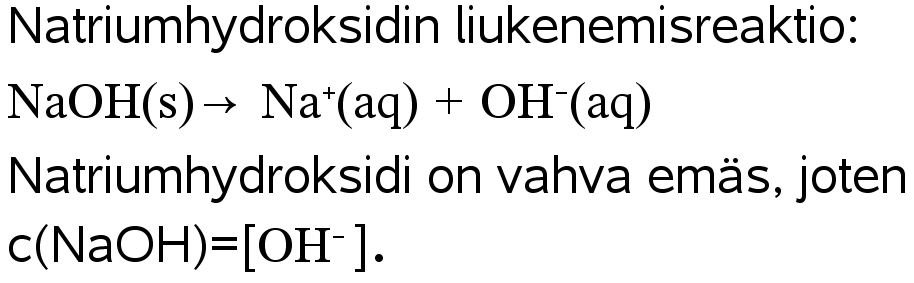
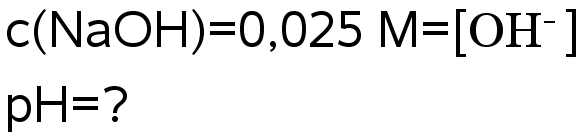
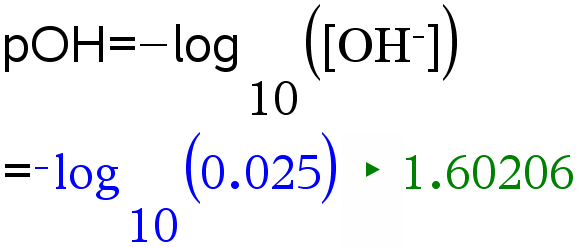
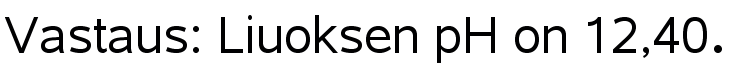
Heikon hapon ja emäksen pH
- heikon hapon pH:ta varten tarvitaan oksoniumionikonsentraatio
- heikon emäksen pOH:ta varten tarvitaan hydroksidi-ionikonsentraatio
Esimerkki
Metaanihapon HCOOH konsentraatio oli 0,050 mol/l. Mikä on liuoksen pH? Mikä on liuoksen ionisoitumisaste?
Ratkaisu:

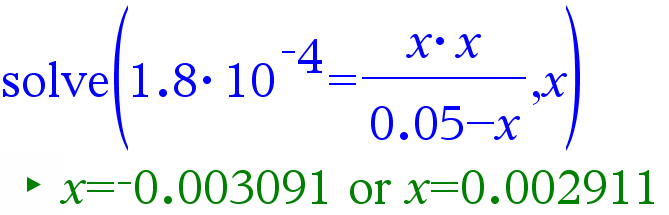
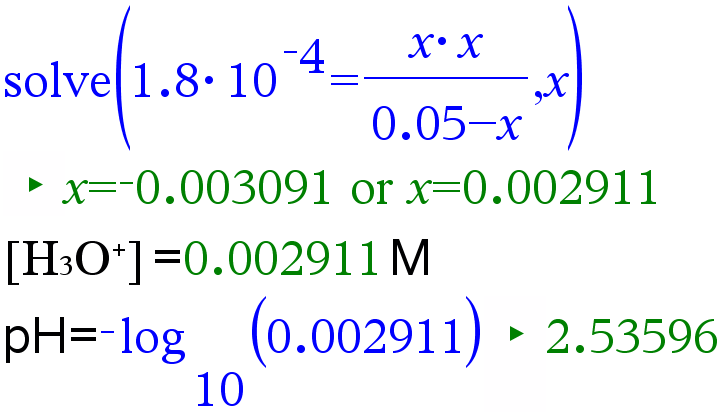
Vastaus: Liuoksen pH on 2,54 ja ionisoitumisaste 5,8 %.
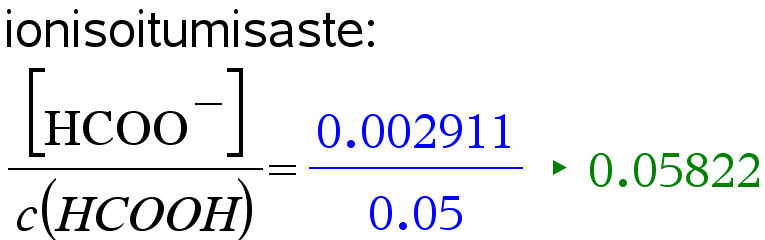
ionisoitumisaste
= hapon ja sen vastinemäksen konsentraatioiden suhde \(\mathrm{\frac{A^-}{HA}}\) TAI emäksen ja sen vastinhapon konsentraatioiden suhde \(\mathrm{\frac{BH^+}{B}}\)
Neutraloituminen
Keskeiset asiat:
-
neutraloituminen
-
suolaliuoksen pH
Sidos 6: Luku 9