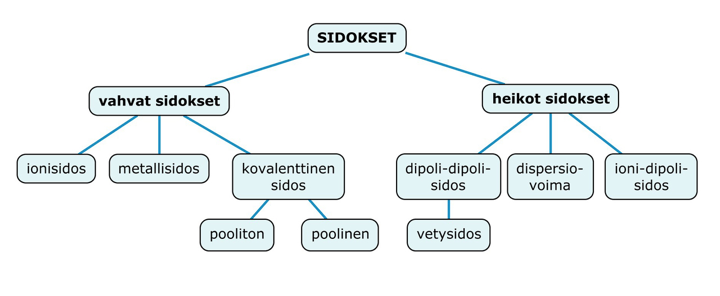
KEMIALLISET SIDOKSET
KE1: Kemiaa kaikkialla
Vahvat sidokset
Atomien välille voi muodostua
- kovalenttisia sidoksia
- ionisidoksia
epämetalli + epämetalli
yleensä epämetalli + metalli
- metallisidos
metalli + metalli
elektronit yhteiskäytössä
positiivinen ioni luovuttaa elektronin negatiiviselle ionille
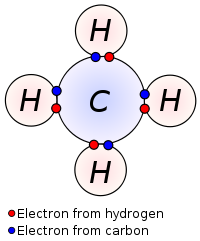
= atomien väliset sidokset
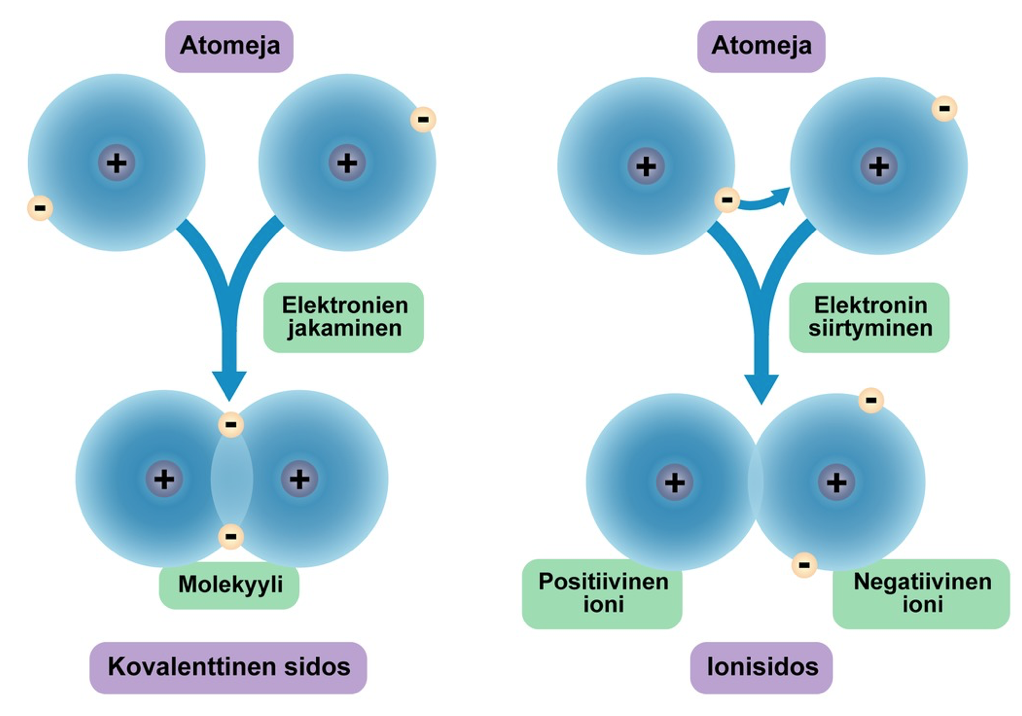
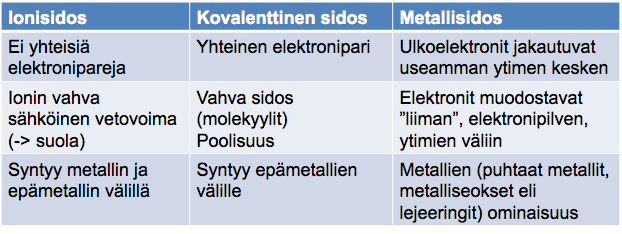
Kovalenttinen sidos
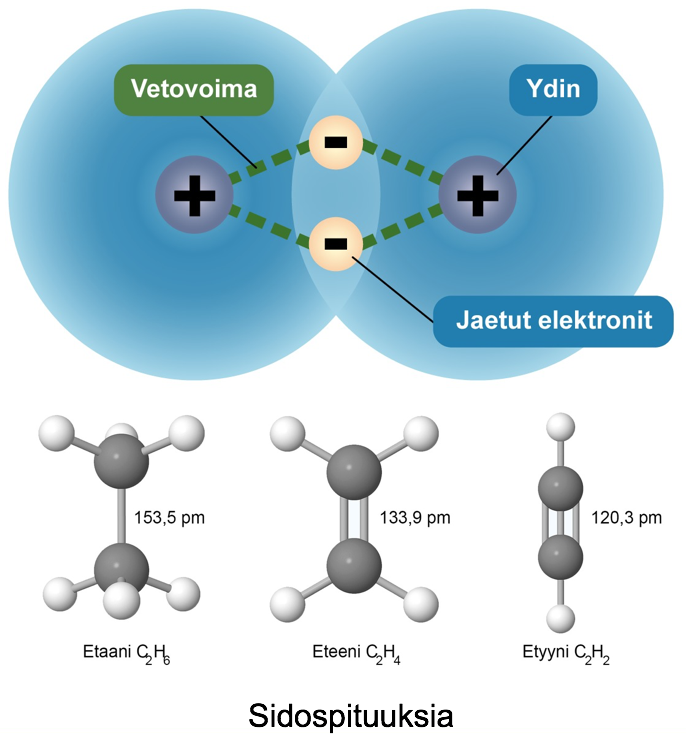
- Yhteisen elektroniparin aiheuttamaa sähköistä vuorovaikutusta atomiydinten välillä sanotaan kovalenttiseksi sidokseksi.
- Positiivisesti varautuneet ytimet kokevat molempien negatiivisesti varautuneiden elektronien aiheuttaman sähköisen vetovoiman.
- Samanmerkkisesti varautuneet elektronit ja ytimet kohdistavat toisiinsa poistovoiman.
- Ydinten välistä etäisyyttä nimitetään sidospituudeksi.
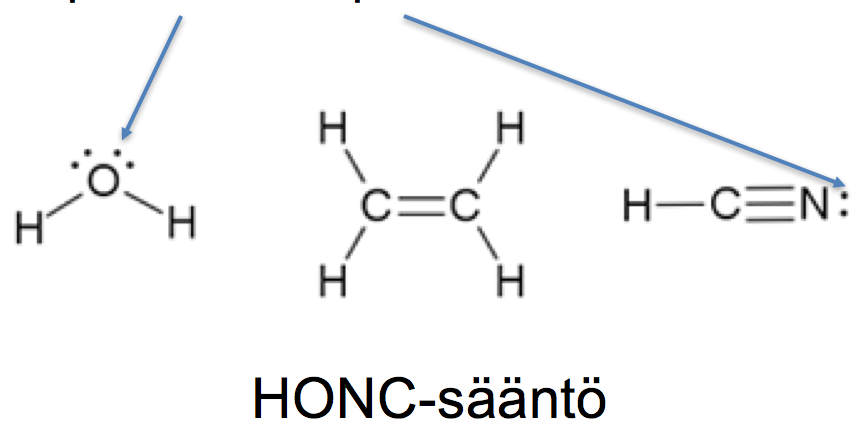
Sidosten ja elektronien merkitseminen
- yksinkertainen sidos
- kaksoissidos
- kolmoissidos
- vapaa elektronipari
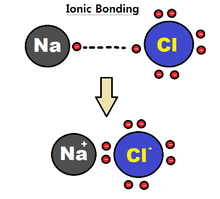
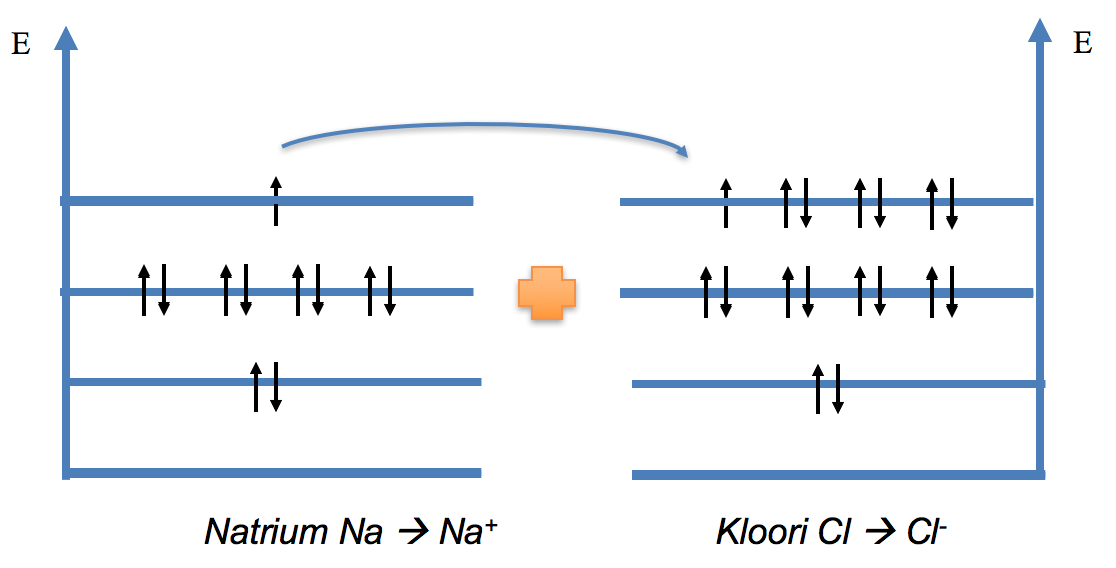
Ionisidos
Ionisidoksen muodostumien
Natrium-atomi luovuttaa elektronin kloori-atomille; molemmat saavuttavat jalokaasurakenteen ja syntyy kaksi vastakkaismerkkistä ionia, jotka sitten vetävät toisiaan puoleensa
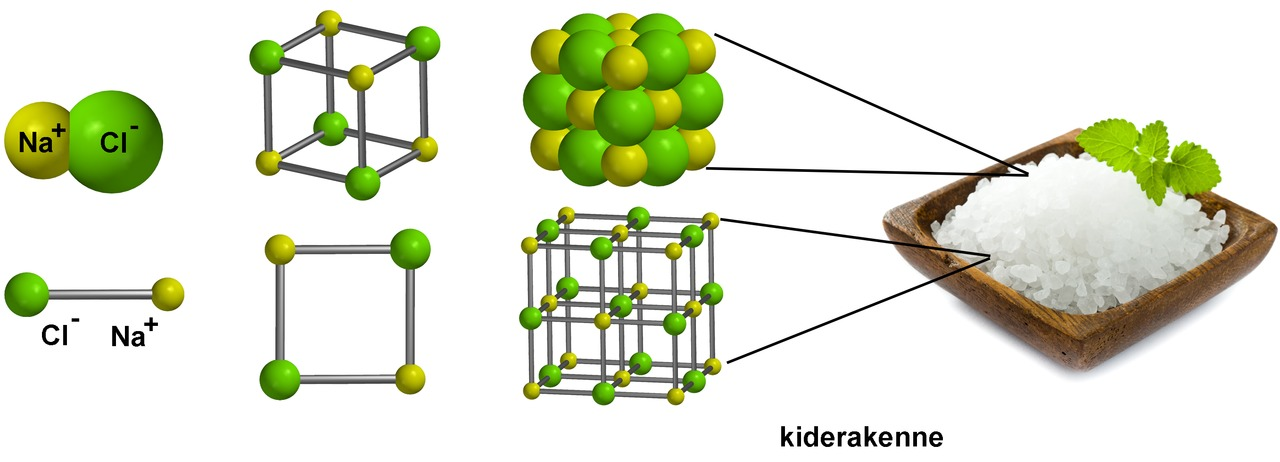
Natriumkloridin rakenne
ionihila
Sidostyyppien erot
Metallisidos
- Mallin pitää selittää mm.
- Sähkönjohtokyky
- Lämmönjohtokyky
- Taottavuus
- Kovuus
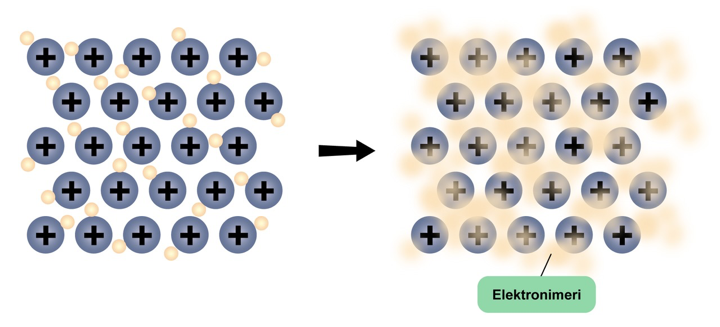
- Malli perustuu metalliatomeista muodostuneisiin metalli-ioneihin, ulkoelektronien luovuttamisesta yhteiseen käyttöön ja näiden muodostaman elektronimeren toimimiseen ”liimana” positiivisten ionien välissä
Metallisidos
Yhteenveto:
Vahvat kemialliset sidokset:
A2, A3, A4
Sidoksen
ja molekyylin poolisuus
Osittaisvaraus
atomin positiivinen varaus (protonit) −
atomia ympäröivä negatiivinen varaus (elektronit)
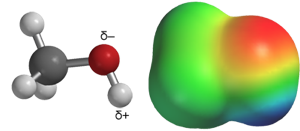
pallotikkumalli
elektronitiheysmalli
elektronirikas alue
elektroniköyhä alue
- kahden erilaisen atomin sitoutuessa elektronit jakautuvat epätasaisesti
epäsymmetrinen kokonaisuus
molekyyliin muodostuu varauksellisia alueita
varaukset mahdollistavat molekyylien liittymisen muihin sähköisesti varautuneisiin molekyyleihin ja ioneihin
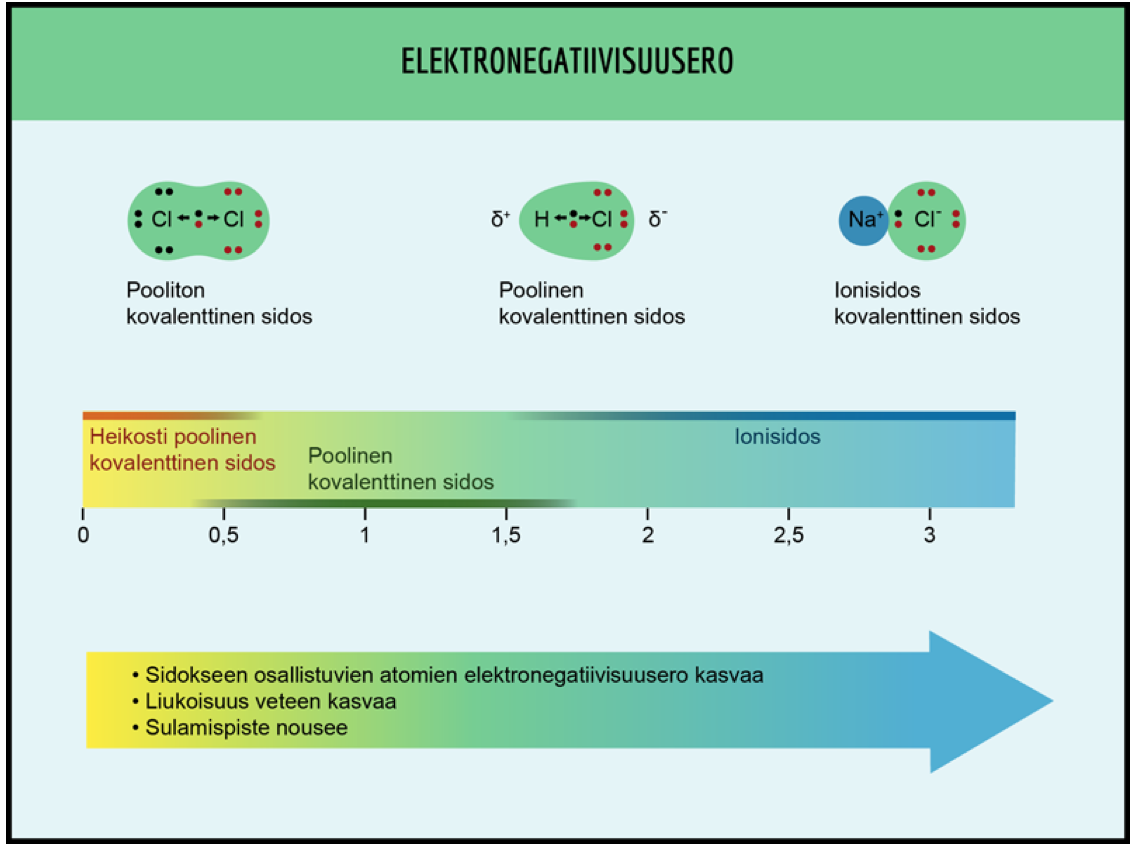
Elektronegatiivisuus
- Kuvaa sidoksen muodostumiseen osallistuvan alkuaineen kykyä vetää puoleensa elektroneja.
- Mitä suurempi on alkuaineen elektronegatiivisuusarvo, sitä voimakkaammin se vetää elektroneja puoleensa.
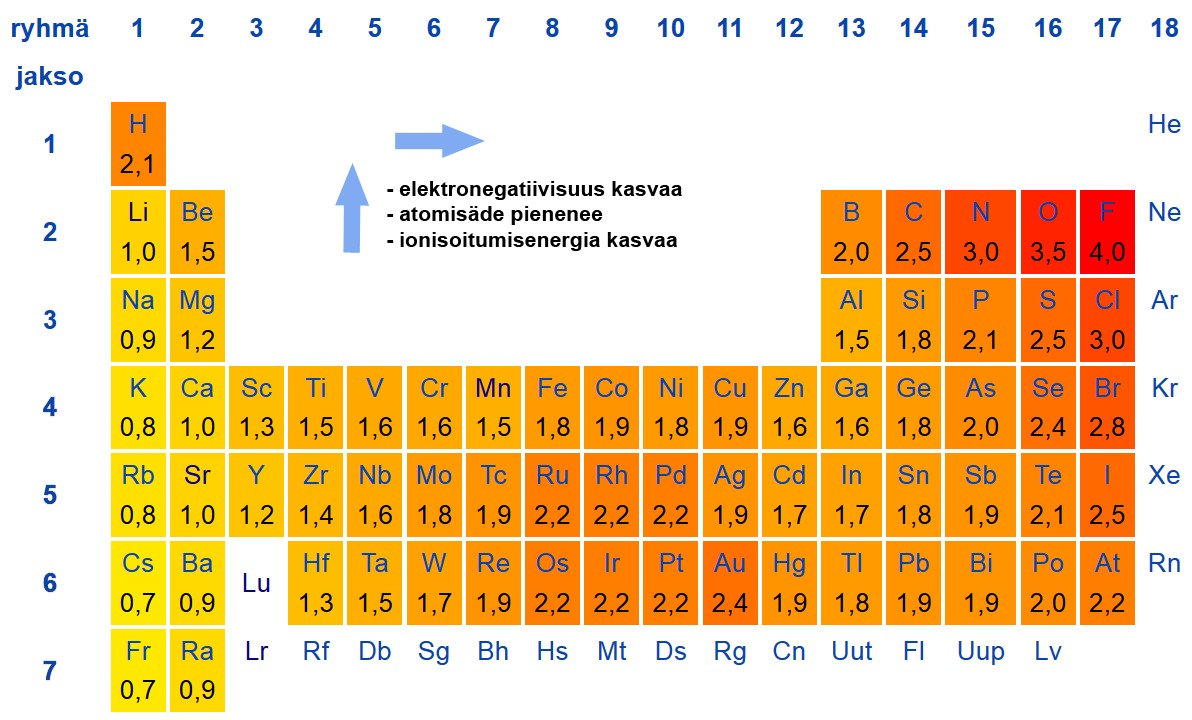
- Fluorille – elektronegatiivisin alkuaine – annettu arvo 4. Muut arvot on määritelty vertaamalla fluoriin.
Sidoksen poolisuus
Sidoksen poolisuus määräytyy sen perusteella, kuinka suuri sidokseen osallistuvien atomien elektronegatiivisuusero on.
Sidosluonnetta arvioitaessa ei voida määrittää mitään tarkkaa rajaa, milloin sidos on poolinen tai pooliton, mutta karkeasti sidostyyppi muuttuu seuraavasti:
0... 0,4
Elektronegatiivisuusero
Sidos
pooliton ... heikosti poolinen
0,4 ... 1,5
heikosti poolinen ... poolinen
1,5 ...
vahvasti poolinen ... ionisidos
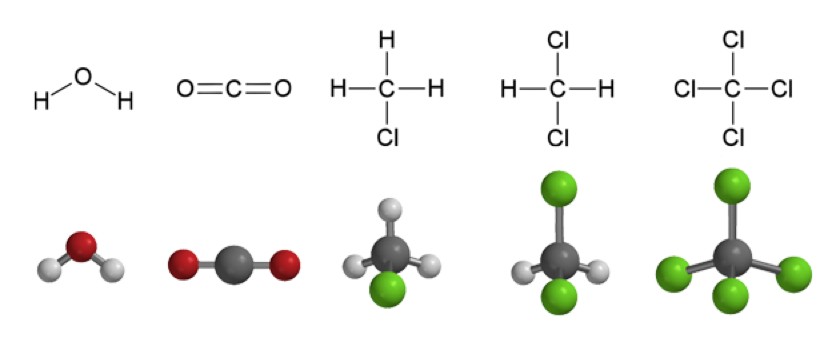
Esimerkkejä sidoksen poolisuudesta
- pooliton sidos: C–C
- sama alkuaine
- lähes pooliton sidos: C–H
- alkuaineiden elektronegatiivisuudet lähes samanlaiset
- poolisia sidoksia: N–H, C–O
- alkuaineiden elektronegatiivisuuksissa selvä ero
Molekyylin poolisuus
- molekyylin poolisuuteen tarvitaan
- poolinen sidos
- epäsymmetria
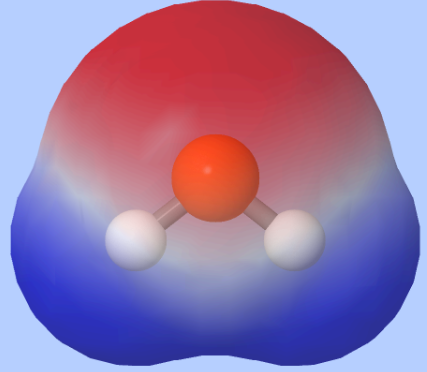
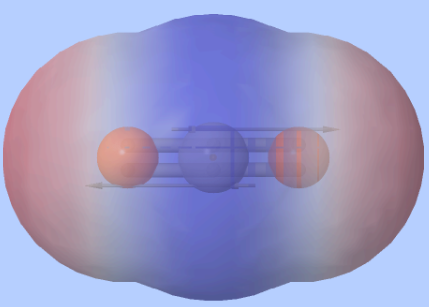
Molekyylin poolisuus
Molekyyli on poolinen, jos
molekyylin sidokset ovat poolisia ja molekyylin muoto ei kumoa poolisuutta
Molekyyli on pooliton, jos
1) sidokset ovat poolittomia
tai
2) sidokset ovat poolisia, mutta
molekyylin muoto kumoaa poolisuuden

pysyvä dipoli eli elektronitihentymä
negatiivinen osittaisvaraus
positiivinen osittaisvaraus
R3. Poolisuus -tehtävä
Vahvat sidokset
elektronegatiivisuus
pieni
suuri
pyrkii luovuttamaan elektroneja
pyrkii vetämään elektroneja puoleensa
metalli
metalli
epämetalli
epämetalli
ionisidos
metallisidos
kovalenttinen sidos
Positiiviset ionit elektronimeressä (elektronipilvessä)
Kiderakenne
Esim. NaCl, Al2S3
Molekyyli
Esim. HCl, C6H12O6
pooliton
poolinen
Kemialliset sidokset
Vahvat ja heikot sidokset
Heikot sidokset
- selittävät eri aineiden ominaisuuksia, kuten sulamis- ja kiehumispisteitä ja liukoisuuksia
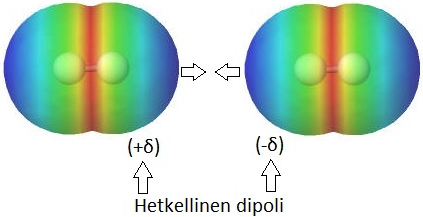
Dispersiovoimat
- poolittomien molekyylien välille
- molekyyliin muodostuu hetkellisiä dipoleja
Dipoli-dipolisidokset
- poolisten molekyylien välille
Vetysidokset
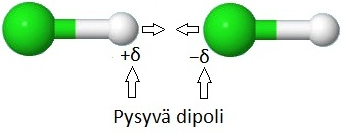
- dipoli-dipolisidoksen erikoistapaus
- molekyylien välille, jotka sisältävät O-H-, N-H- tai F-H- sidoksen
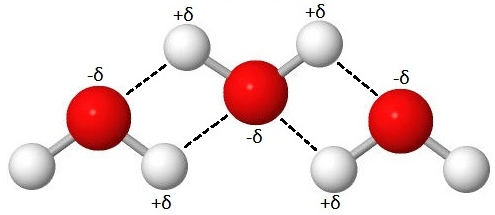
Ioni-dipolisidos
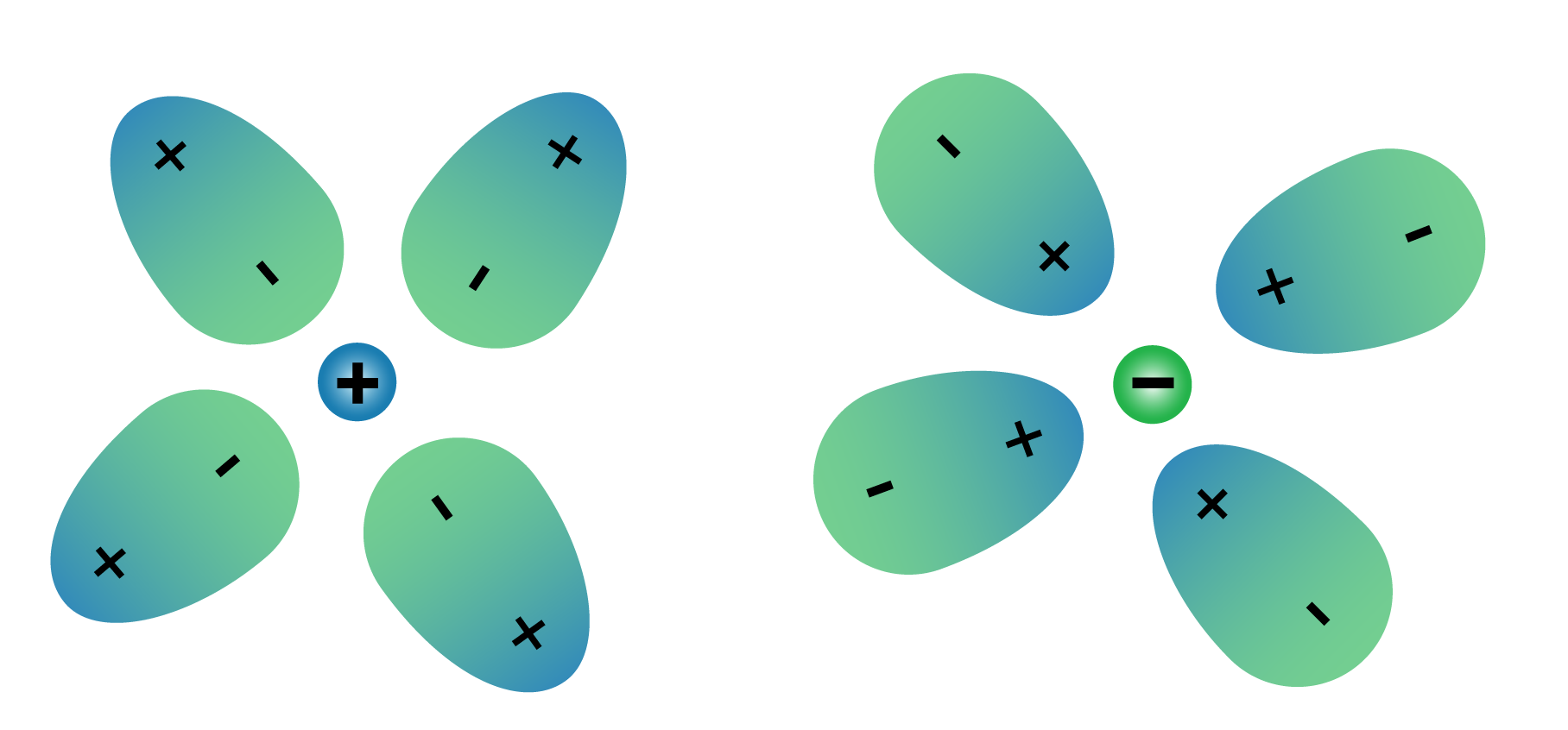
- Ionin ja poolisen molekyylin välillä vaikuttavaa sähköstaattista vuorovaikutusta nimitetään ioni-dipolisidokseksi.
- Ioni-dipolisidoksen voimakkuuteen vaikuttaa ionin varaus ja molekyylin poolisuus.
- Voimakkuudeltaan se voi olla vetysidostakin vahvempi.
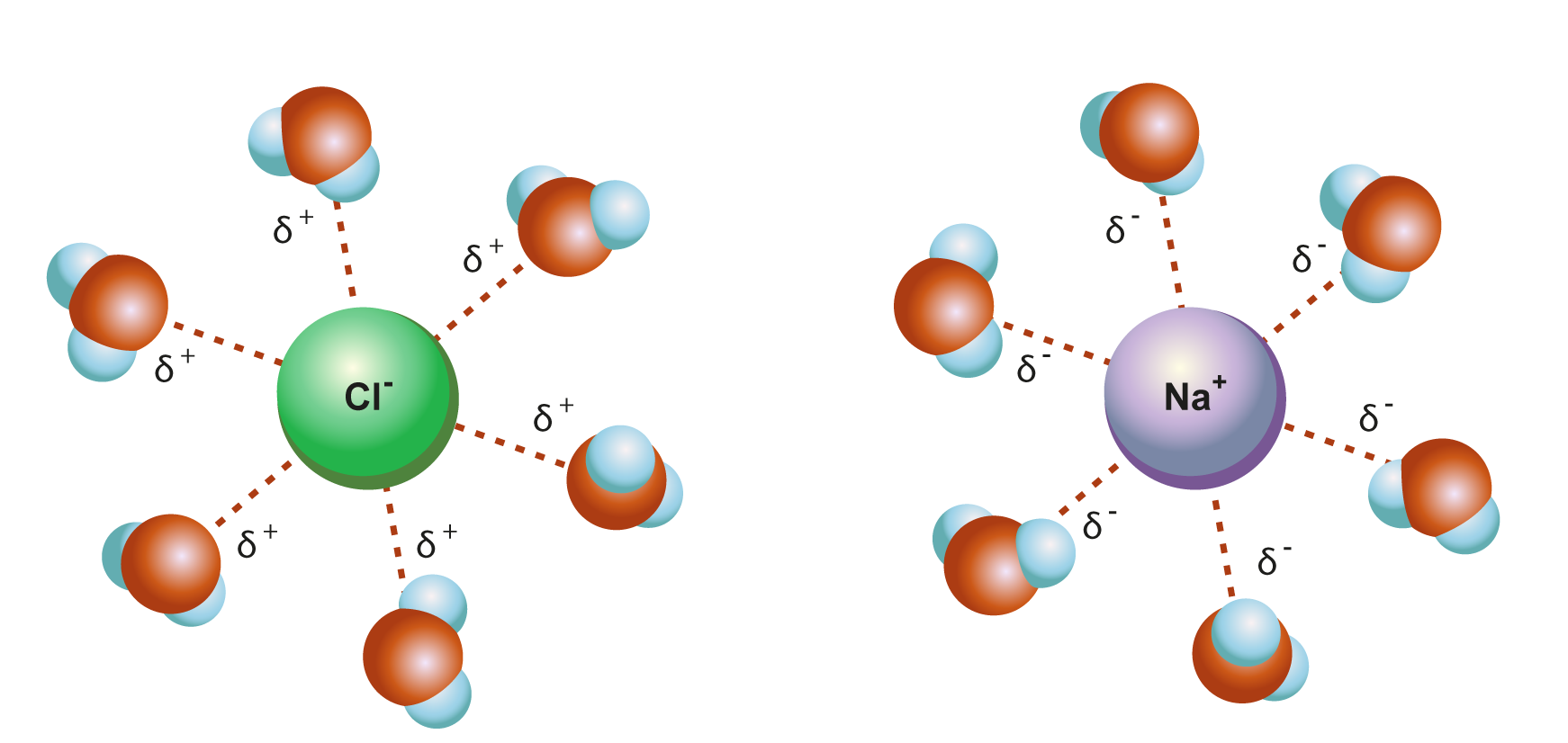
Tyypillinen esimerkki ioni-dipolisidoksesta on ioniyhdisteen liukeneminen pooliseen liuottimeen.
Ioniyhdisteen liukenemista veteen kutsutaan hydratoitumiseksi.
Tehtävä 17: Atomien ja molekyylien väliset sidokset
Mitä atomien ja molekyylien välisiä sidoksia esiintyy suljetussa astiassa, jossa on
a) happimolekyylejä,
b) vetykloridimolekyylejä,
c) vesimolekyylejä?