KE3: Molekyylit ja mallit 1/5
Liuokset
Liuosten valmistaminen
Sidos 3: Luku 1
Keskeiset asiat:
-
konsentraatio
-
liuoksen valmistaminen
-
liuoksen laimentaminen
Ainemäärä
m = massa (g)
Konsentraatio
Kemian peruslaskut
Opettele käyttämään näitä kaavoja sujuvasti!
Kertausta...
Taulukkokirja auttaa!
Kertausta...
Laskut kemiassa
VAIHE 1:
Listaa suureet, jotka tunnetaan ja suure, jota kysytään.
VAIHE 2:
Etsi sopiva suureyhtälö.
VAIHE 3:
Sijoita suureiden lukuarvot yksiköineen yhtälöön.
VAIHE 4:
Pyöristä tulos samaan tarkkuuteen kuin epätarkin lähtöarvo.
Kysytään ainemäärää ja annettu massa
Kysytään konsentraatiota ja annettu tilavuus ja massa
tarvitaan moolimassa
tarvitaan ainemäärä
Kertausta...
Esimerkki
Natriumkarbonaattiliuos \(\mathrm{Na_2CO_3(aq)}\) valmistetaan 500 millilitran mittapulloon liuottamalla 24 g natriumkarbonaattia veteen ja lisäämällä vettä merkkiin asti. Laske liuoksen konsentraatio.
Ratkaisu:
tilavuus V, l
massa m, g
konsentraatio c, mol/l
VAIHE 1:
Listaa suureet, jotka tunnetaan ja suure, jota kysytään.
VAIHE 2:
Etsi sopiva suureyhtälö.
Mitä kysytään?
Mitä tunnetaan?
Ovatko arvot perusyksiköissä?

Na
11
22,99
Natriumkarbonaatin \(\mathrm{Na_2CO_3}\) moolimassa:
C
6
12,01
O
8
16,00
Esimerkki
Ratkaisu:
Vastaus: Liuoksen natriumkarbonaattikonsentraatio on 0,45 mol/l.
VAIHE 3:
Sijoita suureiden lukuarvot yksiköineen yhtälöön.
Natriumkarbonaattiliuos \(\mathrm{Na_2CO_3(aq)}\) valmistetaan 500 millilitran mittapulloon liuottamalla 24 g natriumkarbonaattia veteen ja lisäämällä vettä merkkiin asti. Laske liuoksen konsentraatio.
VAIHE 4:
Pyöristä tulos samaan tarkkuuteen kuin epätarkin lähtöarvo.


Liuoksen valmistaminen
1. Aine punnitaan tarkasti ja liuotetaan pieneen määrään tislattua vettä. Liuosta sekoitetaan, kunnes kaikki kiinteä aine on liuennut veteen.
2. Liuos valmistetaan mittapulloon. Mittapullo täytetään tislatulla vedellä merkkiviivaan asti.
3. Liuos sekoitetaan huolellisesti.
4. Liuoksen säilytysastiaan merkitään:
- aineen nimi ja/tai kemiallinen kaava
- liuoksen pitoisuus
- varoitusmerkit
- valmistuspäivämäärä ja tekijä


Liuoksen laimentaminen
1. Mitataan täyspipetillä tarvittava tilavuus väkevämpää liuosta.

2. Liuos valmistetaan mittapulloon. Mittapullo täytetään tislatulla vedellä merkkiviivaan asti.
3. Liuos sekoitetaan huolellisesti.
Esimerkki
Valmistetaan 100 ml kuparisulfaattiliuosta, jonka konsentraatio on 0,500 M. Kuinka monta grammaa kuparisulfaattia \((\mathrm{CuSO_4\cdot5\ H_2O})\) on punnittava liuosta varten?
Ratkaisu:
VAIHE 1:
Listaa suureet, jotka tunnetaan ja suure, jota kysytään.
VAIHE 2:
Etsi sopiva suureyhtälö.
Lasketaan kuparisulfaatin ainemäärä.
Lasketaan kuparisulfaatin moolimassa.
Lasketaan kuparisulfaatin massa.
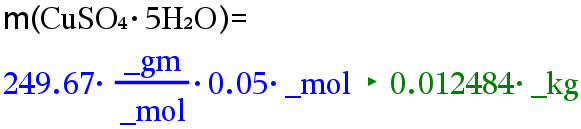
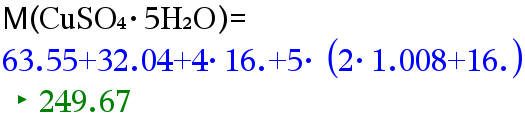
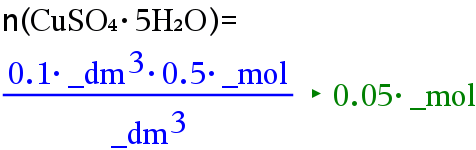
VAIHE 3:
Sijoita suureiden lukuarvot yksiköineen yhtälöön.
VAIHE 4:
Pyöristä tulos samaan tarkkuuteen kuin epätarkin lähtöarvo.
Vastaus: Kuparisulfaattia on punnittava 12,5 g.
Lähtöarvoissa 3 merkitsevää numeroa

Mitä voidaan sanoa astioissa olevien liuosten konsentraatioista?
1
2
3
tuplaantuu
tuplaantuu
pysyy samana
pysyy samana
tuplaantuu
puolittuu
ainemäärä
tilavuus
konsentraatio
Jos liuosta laimennetaan lisäämällä vettä, liuenneen aineen ainemäärä pysyy samana, mutta tilavuus ja konsentraatio muuttuvat.
liuos 1
liuos 2
lisätään vettä
Esimerkki
Kokeelliseen työhön tarvitaan 75 ml natriumhydroksidiliuosta, jonka konsentraatio on 0,2 M. Varastossa on NaOH-liuosta, jonka konsentraatio on 1,0 M. Miten liuos valmistetaan?

Esimerkki
Kokeelliseen työhön tarvitaan 75 ml natriumhydroksidiliuosta, jonka konsentraatio on 0,2 M. Varastossa on NaOH-liuosta, jonka konsentraatio on 1,0 M. Miten liuos valmistetaan?
Ratkaisu:
Lasketaan ensin, kuinka paljon väkevämpää liuosta tarvitaan laimennokseen.
Laimennosta halutaan valmistaa 75 ml. Käytössä on vain 100 ml ja 50 ml mittapullot, joten liuos valmistetaan 100 ml mittapulloon.
Liuoksen valmistaminen
Väkevämpää liuosta tarvitaan laimennokseen 15 ml. Mitataan pumpetin ja 5 ml täyspipetin avulla kolmessa 5 ml erässä 15 ml väkevämpää liuosta mittapulloon.
Vettä tarvitaan \(75\ \mathrm{ml}-15\ \mathrm{ml}=60\ \mathrm{ml}\).
Mitataan 60 ml tislattua vettä 20 ml täyspipetillä kolmessa erässä ja sekoitetaan liuosta kääntelemällä jokaisen lisäyksen jälkeen.
Happoliuosten valmistaminen
HUOM!
Happoliuosta valmistettaessa on laitettava ensin vesi ja vasta sitten happo, Hapon liukenemisreaktiossa vapautuu voimakkaasti lämpöä. Jos vesi lisätään happoon, se saattaa höyrystyä veden pinnalla räiskyen samalla ympäriinsä.
"Ensin vesi, sitten happo, muuten tulee sormeen rakko!"
Värillisten liuosten pitoisuus
Sidos 3: Luku 2
Keskeiset asiat:
-
absorptio
-
spektrofotometria
-
absorbanssi
-
kvantitatiivinen analyysi
-
standardiliuos
-
standardisuora
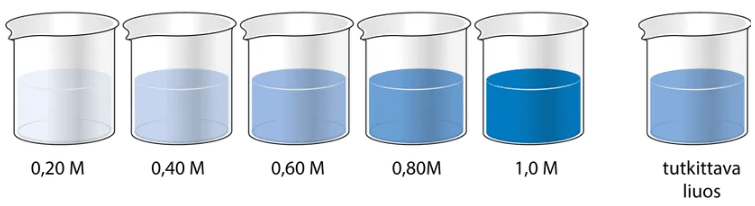
Tutkittavan liuoksen väkevyyden arviointi
Verrataan tutkittavan näytteen väriä tunnettujen liuosten väreihin
Kolorimetria on määritysmenetelmä, jossa eri väkevyisten värillisten liuosten pitoisuudet tunnetaan ja pitoisuudeltaan tuntemattoman liuoksen pitoisuus määritetään vertaamalla liuoksen värin vahvuutta tunnettuihin liuoksiin.
Kvalitatiivinen vai kvantitatiivinen analyysi
Kvalitatiivinen analyysi
- Mitä alkuaineita ja yhdisteitä näyte sisältää?
Kvantitatiivinen analyysi
- Kuinka paljon tiettyä alkuainetta tai yhdistettä näyte sisältää?
laadullinen analyysi
määrällinen analyysi


Spektrofotometria
- Värillisten liuosten pitoisuus voidaan määrittää tarkasti johtamalla liuoksen läpi yksiväristä valoa
- Osa säteilystä imeytyy eli absorboituu aineeseen
- Absorbanssi kuvaa aineeseen imeytyneen eli absorboituneen säteilyn määrää.
- Spektrofotometriassa mitataan absorboituneen valon määrää eli absorbanssia

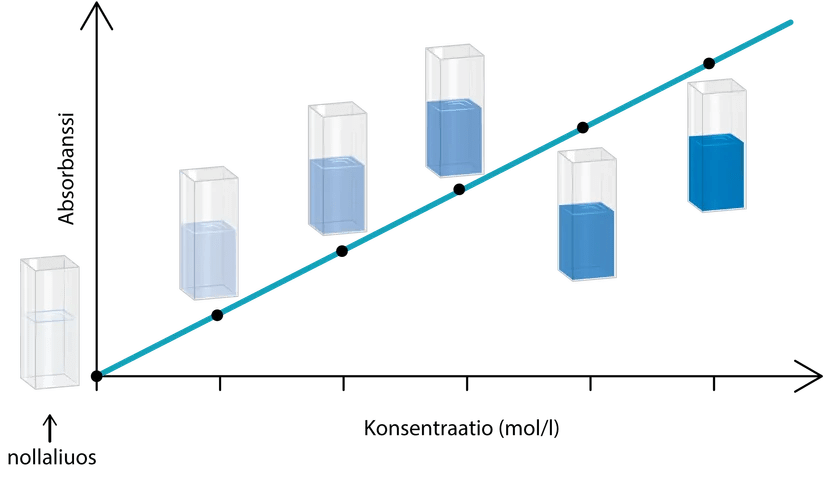
standardisuora
standardiliuokset
eli standardiliuosten absorbanssit konsentraation funktiona
pitoisuus tunnetaan tarkasti
Standardiliuos ja standardisuora
pelkkää liuotinta
Huomioita standardiliuoksista:
- laimeimman liuoksen tulisi olla laimeampaa kuin tutkittava näyte
- väkevimmän liuoksen tulisi olla väkevämpää kuin tutkittava näyte
- standardiliuoksia olisi hyvä olla 4-5

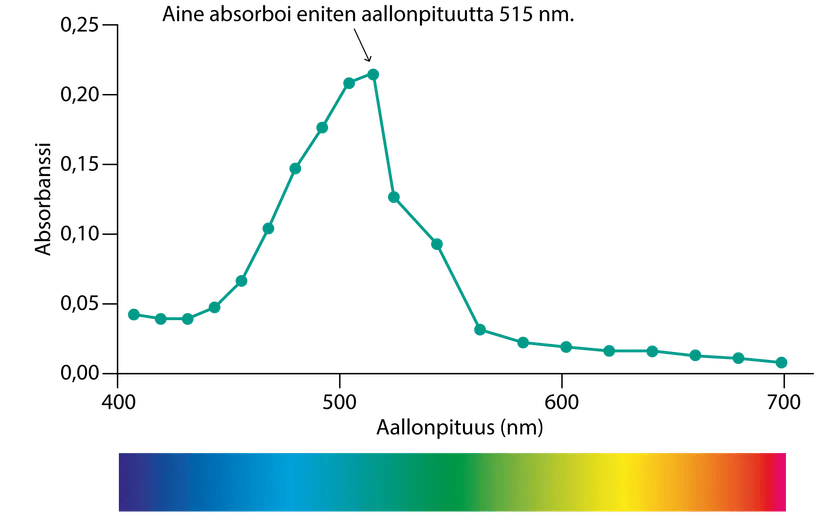
Spektrofotometrin käyttö
- Käytetty aallonpituus valitaan tutkittavan näytteen mukaan
kaliumpermanganaatti-liuoksen absorbanssit eri aallonpituuksilla
Esimerkki
Kaliumpermanganaattiliuos absorboi voimakkaasti aallonpituudella 515 nm. Nollaliuoksen ja neljän standardiliuoksen absorbanssit mitattiin ja tulokset merkittiin taulukkoon.
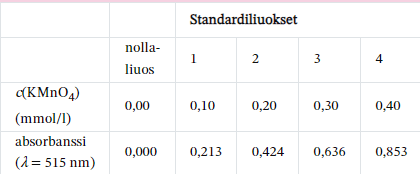
a) Piirrä standardisuora, jossa esitetään absorbanssi konsentraation funktiona.
b) Lue suoralta tutkittavan näytteen konsentraatio, kun näytteen absorbanssi on 0,546.
c) Laske standardisuoran yhtälön avulla, mikä on näytteen konsentraatio, jos absorbanssi on 0,25.
🧪Aineen pitoisuuden määrittäminen spektrofotometrillä
-
Valmistetaan standardiliuokset, joiden pitoisuudet tunnetaan.
-
Tehdään nollaliuos, jossa ei ole tutkittavaa ainetta. Nollaliuos sisältää liuottimen ja mahdolliset muut näyteliuoksen sisältämät aineet paitsi tutkittavan aineen.
-
Spektrofotometristä valitaan se aallonpituus, jota tutkittava liuos absorboi eniten.
-
Kyvetti kaadetaan lähes täyteen liuosta. Tarkistetaan, ettei kyvettiin jää mittaustulokseen vaikuttavia ilmakuplia. Kyvettiä pidetään kiinni niistä sivuista, joiden läpi valo ei kulje
-
Spektrofotometrin näytetilaan laitetaan ensin nollaliuos. Asetetaan nollaliuoksen absorbanssiarvoksi nolla
-
Standardiliuosten absorbanssit mitataan aloittaen laimeimmasta liuoksesta. Mikäli käytetään samaa kyvettiä, se huuhdellaan mittausten välissä tutkittavalla liuoksella.
🧪Aineen pitoisuuden määrittäminen spektrofotometrillä
7. Mitataan pitoisuudeltaan tuntemattoman näytteen absorbanssi.
8. Piirretään standardisuora, jossa on esitetty absorbanssi konsentraation funktiona.
9.Tutkittavan näytteen pitoisuus luetaan standardisuoralta tai lasketaan standardisuoran yhtälön avulla.