Kemiallinen reaktio
ja reaktioyhtälö
KE4: Kemiallinen reaktio
Kemiallinen reaktio
Sidos 4: Luku 1
Keskeiset asiat:
-
kemiallinen reaktio
-
lähtöaineet ja reaktiotuotteet
-
havainnot
-
törmäysteoria
-
ekso- ja endoterminen reaktio
Kemiallinen reaktio
- Kemiallisessa reaktiossa
- sidoksia katkeaa ja uusia muodostuu
- uusia aineita syntyy
- tapahtuu energiamuutoksia
- Eksoterminen reaktio: energiaa vapauttava reaktio
- Endoterminen reaktio: energiaa sitova reaktio
- voidaan havaita
- värin tai olomuodon muutoksesta
- happamuuden muutoksesta
- lämpötilan muutoksesta
- hajusta
- äänestä
- valosta.
Jotta kemiallinen reaktio voi tapahtua, reagoivien aineiden on törmättävä
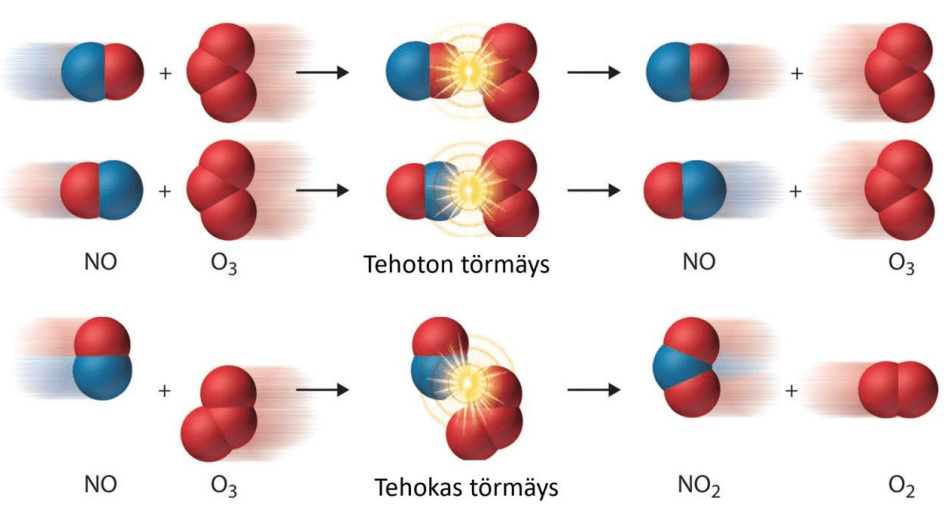
- oikeasta suunnasta
- riittävällä suurella nopeudella
Törmäysteoria
Tehtävät:
Kotona:
- Lue luku 1. Tee tehtävä 1-2.
- Liikennevalot: Kirjaa uudet käsitteet exceliin ja niiden selitykset omin sanoin.
- Tee kesken jääneet tehtävät loppuun. Muista merkitä tehtävä ylös, jos se tuotti haasteita.
| TT1 1-1 | 1-2 | 1-6 | 1-7 | 1-8 |
Vinkki! Voit jättää tämän tehtävän kotiin niin, että testaat lukemisen jälkeen, kuinka hyvin ymmärsit luvun asiat.
Reaktioyhtälö
Sidos 4: Luku 2
Keskeiset asiat:
-
reaktioyhtälön kirjoittaminen
-
reaktioyhtälön tasapainottaminen
-
aineen häviämättömyyden laki
Reaktioyhtälö

- lähtöaineet → reaktiotuotteet
-
lähtöaineiden ja reaktiotuotteiden olomuoto merkitään sulkuihin aineen perään
- metallit kiinteitä (s), paitsi elohopea Hg on neste (l)
- kaksiatomiset molekyylit H2, O2, N2, F2 ja Cl2 kaasuja (g), mutta bromi Br2 on neste (l) ja jodi I2 on kiinteä (s)
- ioniyhdisteet yleensä kiinteitä (s) tai vesiliuoksissa (aq)
- hapot yleensä vesiliuoksissa (aq)
- vesi yleensä nesteenä (l), palamisreaktion tuotteena kaasuna (g), eikä sitä koskaan merkitä vesiliuoksena.
- reaktionuolen ylä- ja alapuolelle voidaan lisätä tietoja reaktio-olosuhteista
Aineen häviämättömyyden laki
- Lähtöaineissa ja reaktiotuotteissa on aina yhtä monta saman alkuaineen atomia
- Lähtöaineiden yhteenlaskettu massa on sama kuin tuotteiden massa
- Aineiden määrät tasapainotetaan reaktioyhtälön kertoimien avulla
Classroomissa linkki simulaatioon
Esimerkki
Kiinteää kaliumia sekoitetaan veteen. Reaktiossa muodostuu veteen liukenevaa kaliumhydroksidia ja vetykaasua.
K(s)
+
+
K
H
O
1
1
2
3
1
1
4
2
2
2
4
2
2
2
2
Kirjoita reaktioyhtälö ja tasapainota se.
Kertoimet ovat aina kokonaislukuja!
Tehtävät:
Kotona:
- Lue luku 2. Tee tehtävä 2-4.
- Liikennevalot: Kirjaa uudet käsitteet exceliin ja niiden selitykset omin sanoin.
| 2-1 | 2-3 | 2-4 | 2-6 | 2-7 | 2-8 | 2-9 |
Vinkki! Voit jättää tämän tehtävän kotiin niin, että testaat lukemisen jälkeen, kuinka hyvin ymmärsit luvun asiat.
Reaktio-yhtälön käyttö laskuissa
Sidos 4: Luvut 3-4
Keskeiset asiat:
-
stoikiometria
-
teoreettinen saanto
-
todellinen saanto
-
saantoprosentti
-
reaktion rajoittava tekijä
Stoikiometriassa käytetään hyödyksi tasapainotettua reaktioyhtälöä, kun lasketaan lähtöaineiden ja reaktiotuotteiden määriä.
Esimerkki
4,0 moolia alumiinia reagoi kloorin kanssa muodostaen alumiinikloridia.
a) Kuinka paljon tuotetta muodostuu täydellisessä reaktiossa?
b) Kuinka paljon klooria tarvitaan, jotta kaikki alumiini reagoisi?
a) Reaktioyhtälön mukaan n(Al)=\(\mathrm{n(AlCl_3})\).
\(\mathrm{n(Al)=n(AlCl_3)=4{,}0\ mol}\)
Vastaus: Klooria tarvitaan 6,0 moolia.
b)
Vastaus: Tuotetta syntyy 4,0 moolia.
Teoreettinen saanto
se määrä reaktiotuotetta, joka saataisiin, jos kaikki lähtöaine olisi reagoinut tuotteeksi.
Todellinen saanto
se määrä reaktiotuotetta, joka reaktiossa todellisuudessa saadaan
Saantoprosentti
= kuinka monta prosenttia todellinen saanto on teoreettisesta saannosta
Tehtävät:
Kotona:
- Lue luku 3. Tee tehtävä 3-3.
- Liikennevalot: Kirjaa uudet käsitteet exceliin ja niiden selitykset omin sanoin.
| 3-3 | 3-5 | 3-6 | 3-7 | 3-8 | 3-9 | 3-10 |
Vinkki! Voit jättää tämän tehtävän kotiin niin, että testaat lukemisen jälkeen, kuinka hyvin ymmärsit luvun asiat.
Rajoittava tekijä
- loppuu ensimmäisenä kemiallisessa reaktiossa. Tämän jälkeen reaktiota ei enää tapahdu.
- määrittää sen, kuinka paljon reaktiotuotteita pystytään valmistamaan.
Jos tehtävän tiedoissa on annettu useamman kuin yhden lähtöaineen massat, täytyy aina tutkia, mikä on reaktion rajoittava tekijä!
2 Na(s) + \(\mathrm{Cl_2(g)}\rightarrow\) 2 NaCl(s)
lähtöaineiden määrät alussa
n = 1,0 mol
n = 1,0 mol
n = ?
n(Na)=2n\(\mathrm{(Cl_2)}\)
reaktiossa kuluva n(Na)=1,0 mol
reaktiossa kuluva n\(\mathrm{(Cl_2)}\)=0,50 mol
klooria jää yli 0,50 mol
ylimäärin
rajoittava tekijä
natrium kuluu kokonaan
reaktiossa muodostuva n(NaCl)=1,0 mol
n(Na)=n(NaCl)
a) veden valmistus: 4 vetymolekyyliä + 4 happimolekyyliä
b) metaanin palaminen: 2 metaani-molekyyliä + 6 happimolekyyliä
Rajoittava tekijä?
Kuinka paljon happea?
c) 3 metaanimolekyyliä palaa
Esimerkki
Kalsiumkarbidia \(\mathrm{CaC_2(s)}\) valmistetaan antamalla kalsiumoksidin CaO(s) ja hiilen C(s) reagoida keskenään korkeassa lämpötilassa. Reaktiossa muodostuu kalsiumkarbidin lisäksi hiilidioksidia \(\mathrm{CO_2(g)}\).
a) Kirjoita reaktioyhtälö ja tasapainota se.
b) Mikä on kalsiumkarbidin teoreettinen saanto, kun käytössä on 4,5 grammaa kalsiumoksidia ja 2,3 grammaa hiiltä?
c) Mikä on reaktion saantoprosentti, kun todellisuudessa kalsiumkarbidia muodostuu 3,8 grammaa?
Ratkaisu:
a)
b) Mikä on kalsiumkarbidin teoreettinen saanto, kun käytössä on 4,5 grammaa kalsiumoksidia ja 2,3 grammaa hiiltä?
Ratkaisu:
Reaktioyhtälön kerrointen perusteella
Hiili on siis rajoittava tekijä.
Reaktioyhtälön kerrointen perusteella
\(n(\mathrm{CaO})=n(\mathrm{CaC_2)=0,0766...\ mol}\).
Vastaus: Kalsiumkarbidin teoreettinen saanto on 4,9 grammaa.
c) Mikä on reaktion saantoprosentti, kun todellisuudessa kalsiumkarbidia muodostuu 3,8 grammaa?
RATKAISU:
Vastaus: Reaktion saantoprosentti on 77 %.
Tehtävät:
Kotona:
- Lue luku 4. Tee tehtävä 4-3.
- Liikennevalot: Kirjaa uudet käsitteet exceliin ja niiden selitykset omin sanoin.
| 4-3 | 4-5 | 4-6 | 4-9 | 4-10 | 4-11 | 4-12 |
Vinkki! Voit jättää tämän tehtävän kotiin niin, että testaat lukemisen jälkeen, kuinka hyvin ymmärsit luvun asiat.
Kaasulaskut
Sidos 4: Luku 5
Keskeiset asiat:
-
kaasun tilavuus
-
ideaalikaasu
-
ideaalikaasun tilanyhtälö
-
moolinen kaasuvakio
-
normaali ilmanpaine
Ideaalikaasu
Ideaalikaasun ajatellaan koostuvan hiukkasista, jotka
- ovat pistemäisiä ja kaikki keskenään samanlaisia
- liikkuvat lämpöliikkeen johdosta täysin satunnaisiin suuntiin
- törmäilevät toisiinsa kimmoisasti
- eivät muodosta keskenään kemiallisia sidoksia
- liikkuvat törmäysten välillä tasaisella nopeudella ja suoraviivaisesti
- teoreettinen malli, jota käytetään selittämään todellisten kaasujen ominaisuuksia
- todelliset kaasut käyttäytyvät ideaalikaasun tavoin vain hyvin korkeassa lämpötilassa ja alhaisessa paineessa
Ideaalikaasun tilanyhtälö
p= paine
V = tilavuus
n = ainemäärä
R = moolinen kaasuvakio
T = lämpötila (K)
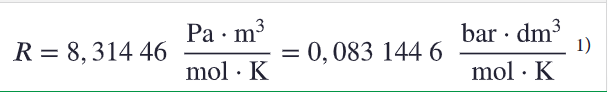
Kaasuvakio valitaan paineen yksikön mukaan! Tarkista myös, että tilavuuden yksikkö on sama kuin kaasuvakiossa.
Esimerkki
Kemian tunnilla tutkittiin magnesiumin ja suolahapon välistä reaktiota. Opiskelija sai 25 mg magnesiumjauhetta ja dekantterilasin, jossa oli suolahappoliuosta. Kun hän lisäsi magnesiumjauheen dekantterilasiin, reaktio käynnistyi. Reaktiossa vapautui hajutonta, väritöntä ja ilmaa kevyempää kaasua.
a) Kirjoita tasapainotettu reaktioyhtälö.
b) Ratkaise muodostuvan kaasun tilavuus, kun \(t=25\ ^\circ\)C ja \(p=1{,}01325\) bar.
Tehtävät:
Kotona:
- Lue luku 5. Tee tehtävä 5-3.
- Liikennevalot: Kirjaa uudet käsitteet exceliin ja niiden selitykset omin sanoin.
| 5-3 | 5-4 | 5-7 | 5-8 | 5-9 | 5-10 | 5-11 |
Vinkki! Voit jättää tämän tehtävän kotiin niin, että testaat lukemisen jälkeen, kuinka hyvin ymmärsit luvun asiat.
Yhdessä 5-5 (ei listassa)