Kemian kertaus
KE07: Kemian kertaus
Kemian ylioppilaskoe ja siihen valmistautuminen
Kemian ylioppilaskokeen rakenne
Osio I (MONIVALINTA)
- 10 kohtaa, jokaisesta 2 pistettä
- osan voi päätellä nopeasti kemian perustiedoilla, osassa on laskettava tai pohdittava pidempään
Osio II (15 pisteen tehtävät)
- tehdään neljä tehtävää seitsemästä
- tehtävät käsittelevät kemian perusasioita ja jonkin verran niiden soveltamista
Osio III (20 pisteen tehtävät)
- tehdään kaksi tehtävää kolmesta
- jokainen tehtävä on 20 pisteen arvoinen
- työläämpiä ja soveltavampia kuin osan II tehtävät
- voivat sisältää myös aineistoja, joiden pohjalta on omaksuttava uutta teoriaa

- Yksi kemian YO-tehtävä käsittelee tyypillisesti aiheita useista kemian osa-alueista eri moduuleista.
- Osatehtävät ovat usein erilaisia. Sama tehtävä voi esimerkiksi sisältää reaktioyhtälön kirjoittamista, laskun ja selitystä.
- Keskeisiä käsitteitä ja sisältöjä sovelletaan vastauksessa eikä niinkään kysytä suoraan.
- Kaikissa tehtävissä on sekä helppoja että vaikeita asioita eri osatehtävissä
-
Suositus:
- Harjoittele kokeeseen valmistautuessasi erilaisten tehtävien tekemistä.
- Vastaa joka tapauksessa kaikkiin seitsemään tehtävään, koska kaikissa tehtävissä on helpompia osuuksia, joista voi saada helpommin pisteitä.
Kemian YO-kokeesta
Kokeeseen valmistautuminen
- Opiskele ahkerasti, mutta muista myös nukkua riittävästi ja rentoutua välillä.
- Tee realistinen lukusuunnitelma, joka on mahdollista toteuttaa.
-
Tehtävien tekeminen on tärkeämpää kuin pelkkä teorian lukeminen.
-
Tee tehtäviä Mafynetistä:
-
Kun aloitat jotakin aihepiiriä, katso ensin aiheen Tavoitetehtävät. Jos osaat tehdä ne suoraan, riittää todennäköisesti, että vain silmäilet osion "harjoitustehtävät".
-
Voit tehdä tehtäviä myös keskustellen kaverin kanssa, jos se sopii tehtävän luonteeseen.
-
-
Tee palautettavat tehtävät huijaamatta. Muista, että opiskelet itseäsi varten!
-
Tee tehtäviä Mafynetistä:
Kokeeseen valmistautuminen
-
Kiinnitä huomiota ohjelmistojen käyttöön ja käyttämiisi merkintöihin. Tee jokainen tehtävä kuin se olisi YO-kokeen tehtävä!
-
Hyödynnä moduulien KE1–KE6 oppikirjoja.
-
Käy läpi käsitelistat oppikirjojen liitteistä.
-
Käy läpi kokeellisia töitä esim. videoiden avulla.
-
-
Tutustu aiempien vuosien YO-kokeisiin.
-
Käy läpi taulukkokirja, jotta tiedät, mitä tietoa sieltä löytyy.
-
Kertaa ohjelmistojen käyttöä.
-
Kysy tarvittaessa apua!
Hyvän vastauksen rakentaminen
Hyvän vastauksen piirteet
-
Vastauksissa hyödynnetään kemialle tyypillistä esitystapaa sekä kemian käsitteiden ja termien oikeaa ja täsmällistä käyttöä.
-
Reaktioyhtälöt esitetään ilman hapetuslukuja käyttäen pienimpiä mahdollisia kokonaislukukertoimia ja olomuotoja.
-
Orgaanisten yhdisteiden reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei vaadita. Jos ne on tehtävässä annettu, kopioidaan ne myös vastaukseen.
-
Rakennekaavojen eri esitystavat hyväksytään.
-
-
Essee- ja selitystehtävissä vastauksen tulee sisältää kirjoitettua tekstiä, jota täydennetään reaktioyhtälöillä, kaavoilla tai kuvioilla.
-
Ilmiöitä selitetään sanallisesti makroskooppisella, mikroskooppisella ja symbolisella tasolla.
-
Kun vastauksessa edellytetään tehtävään liittyvän aineiston hyödyntämistä, soveltamista tai analysointia, hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Hyvän vastauksen piirteitä
- Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa, että vastaaja on ymmärtänyt tehtävänannon oikein ja osaa soveltaa ratkaisussaan asianmukaista periaatetta tai lakia.
- Vastauksesta tulee ilmetä, kuinka lopputulokseen on päädytty, mutta laajoja välivaiheita ei tarvitse esittää.
- Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
- Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä.
- Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten ekvivalenttikohta titrauskäyrässä tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
- Mittauspisteisiin sovitetaan asianmukainen suora tai käyrä esimerkiksi jonkin sovitefunktion avulla. Jos mittauspisteet ovat lähellä toisiaan, varsinaista sovitefunktiota ei tarvitse lisätä.
- Vastauksen tulee olla niin selkeä, että opettajalle ja sensorille on selvää, mitä kokelas tarkoittaa.
Erityyppisissä tehtävissä tarvittavia taitoja
- Erilaisten materiaalien (videot, kuvat, taulukot, graafiset esitykset jne.) analysointi ja tulkinta
- Tutkimusten suunnittelu ja opetussuunnitelman mukaisten kokeellisten menetelmien suoritus
- Tutkimustulosten analysointi, tulkinta ja johtopäätösten tekeminen
- Kemialle tyypillisten kaavojen ja tekstien (mukaan lukien reaktioyhtälöiden ja kuvaajien) tuottaminen digitaalisilla välineillä
Huolellisuutta, kun...
- kirjoitat alkuaineiden merkkejä tai yhdisteiden kaavoja.
- kopioit annettuja lähtötietoja (suuruusluokat, yksiköt, kaavat jne.).
- kirjoitat reaktioyhtälöitä (kaavat, olomuodot, reaktionuolet, kertoimet).
- piirrät kaavioita tai graafisia kuvaajia (akselien nimet, yksiköt, asteikko).
- ilmoitat numeerisen tehtävän vastauksen (pyöristys oikeaan tarkkuuteen ja oikea yksikkö).
- tunnistat tai nimeät orgaanisten yhdisteiden funktionaalisia ryhmiä tai luokittelet
- yhdisteitä eri yhdisteryhmiin (yhdisteluokkiin).
- esität orgaanisten yhdisteiden rakennekaavoja (sidosten suuntautuminen, isomeria).
Laskennalliset tehtävät
- Lue tehtävä huolellisesti!
- Listaa tehtävänannosta annettujen suureiden kirjaintunnukset, lisää suureiden lukuarvot annetulla tarkkuudella ja merkitse annettu yksikkö.
- Ole tarkkana yksikkömuunnosten ja merkitsevien numeroiden kanssa!
- Esimerkiksi 10 ml = 0,010 ja 100 mg = 0,100 g.
- Kirjaa näkyviin tarvittavat moolimassat taulukkokirjan suhteellisten atomimassojen tarkkuudella laskettuina. (Älä pyöristä atomimassoja!)
- Selvitä, mitä pitää ratkaista eli mikä on kysytty suure.
- Mieti, mitä suureyhtälöä käyttämällä saat ratkaistua kysytyn suureen ja kirjoita suureyhtälö näkyviin käyttäen suureiden kirjaintunnuksia.
- Sijoita tunnetut lukuarvot ja niiden yksiköt.
- Suorita laskutoimitus ja merkitse mahdollinen välitulos riittävän tarkasti.
- Yleensä välitulos, jossa on kaksi merkitsevää numeroa enemmän kuin epätarkimmassa laskussa käytetyssä lähtöarvossa, on riittävän tarkka.
- Käytä välituloksessa ja vastauksessa desimaalilukuja – ei murtolukuja.
- Kirjoita vastaus vielä erikseen ja pyöristä vastaus oikealle merkitsevien numeroiden tarkkuudelle sekä varmista, että myös yksikkö on oikea ja tulos järkevä!
Pistevähennykset
- Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti.
- Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä.
- Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. (ei-VSE)
- Muiden puutteiden tai virheiden kohdalla virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen.
- Kokeen loppupään vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät.
- Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p.
Aineen rakenne
Puhtaat aineet ja seokset
Olomuodot
Atomi
Jaksollinen järjestelmä
Puhtaat aineet ja seokset
aine
puhdas aine
seos
alkuaine
yhdiste
homogeeninen seos
heterogeeninen seos
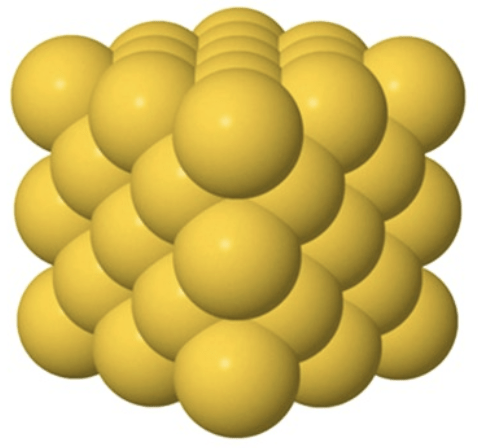
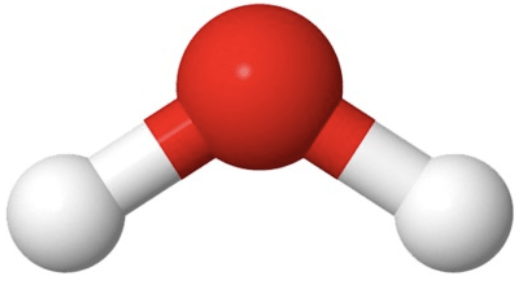
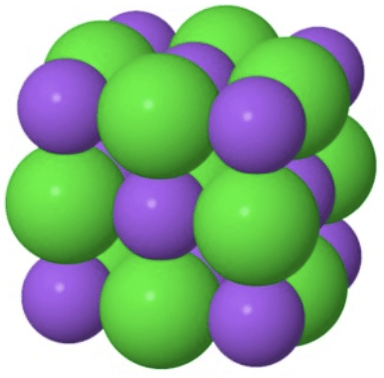
kaikki rakenneosat ovat samanlaisia


molekyyli-yhdiste
ioni-yhdiste
koostuu kahdesta tai useammasta reagoineesta alkuaineesta
tasakoosteinen
sekakoosteinen
liuokset
esim.
esim.
kolloidi
suspensio




hiukkaskoko <1 µm, osat eivät erotu toisistaan seisottamalla
erotettavissa vain yksi faasi
erotettavissa vähintään kaksi faasia




kaasu-seokset
lejeeringit eli metalli-seokset
hiukkaskoko >1 µm, osat erottuvat toisistaan seisottamalla
metallit
epämetallit
puolimetallit
Kaasut (g)
Nesteet (l)
Kiinteät aineet (s)
- tiheys hyvin pieni
- hiukkaset liikkuvat vapaasti joka suuntaan \(\rightarrow\) kaastu täyttävät astian koko tilavuuden
- kaasun tilavuus kasvaa, kun
- paine pienenee
- lämpötila nousee
- esim. \(\mathrm{O_2(g), H_2(g), Cl_2(g),}\) jalokaasut, ilma
- tiheys suurempi kuin kaasujen tiheys
- hiukkaset liikkuvat vapaasti toistensa lomitse \(\rightarrow\) neste mukautuu astian muotoon
- nesteitä voidaan puristaa kasaan vain hyvin vähän (hydrauliset laitteet)
- esim. Hg(l), \(\mathrm{Br_2(l),\ H_2O(l)}\)
- rakenneyksiköt pakkautuneet yleensä tiiviisti \(\rightarrow\) tiheys yleensä suurempi kuin nesteessä (pl. vesi)
- hilarakenne
- kiteisellä aineella säännöllinen hilarakenne ja tarkka sulamispiste
- amorfisella aineella ei säännöllistä hilarakennetta eikä tarkkaa sulamispistettä
- esim. metallit (pl. Hg(l)), C(s), ioniyhdisteet, glukoosi, \(\mathrm{I_2(s)}\)
Olomuodon muutokset
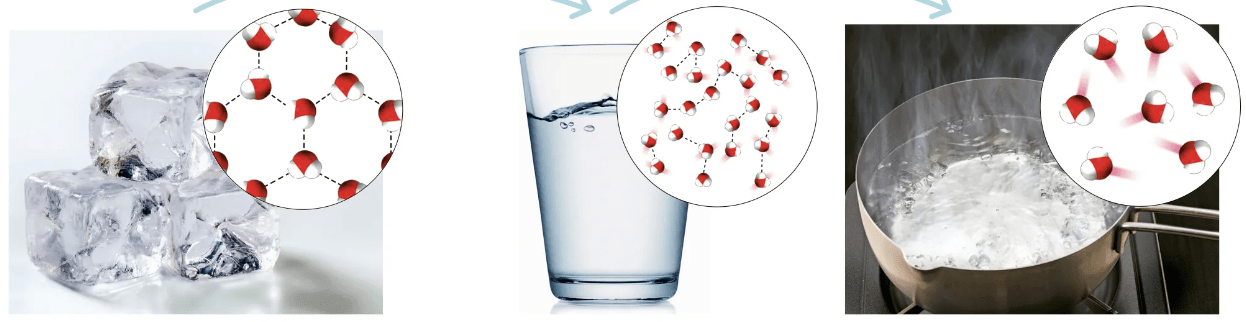
sulaminen
höyrystyminen
sublimoituminen
jähmettyminen
tiivistyminen
härmistyminen
kiinteä (s)
neste (l)
kaasu (g)
energiaa sitoutuu
energiaa vapautuu
eksoterminen tapahtuma
endoterminen tapahtuma
Atomi
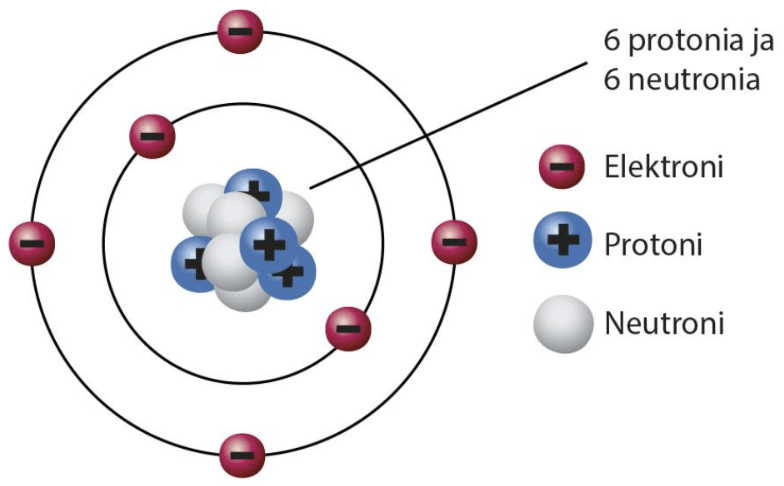
elektronipilvi
ydin
Atomissa protonien ja elektronien lukumäärä on aina yhtä suuri.
Alkuaine
Saman alkuaineen atomeilla on aina sama määrä protoneja.
Saman alkuaineen atomit, joissa on eri määrät neutroneja, ovat toistensa isotooppeja.
Isotooppi
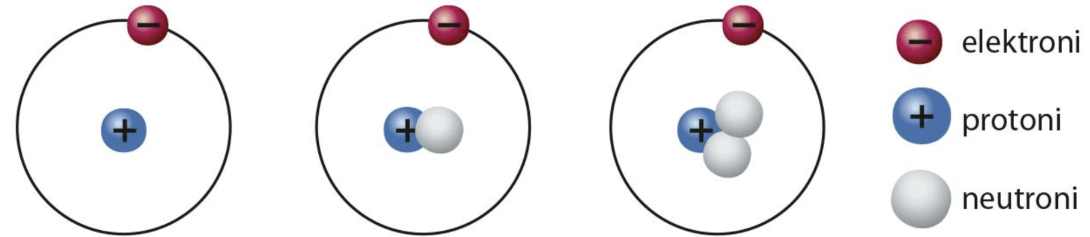
vedyn isotooppeja
Isotooppimerkintä
- Alkuaineen järjestysluku Z ilmoittaa atomien protonien lukumäärän
- Alkuaineen massaluku A kertoo ytimen hiukkasten yhteismäärän
isotooppimerkintä
järjestysluku
massaluku
alkuaineen kemiallinen merkki

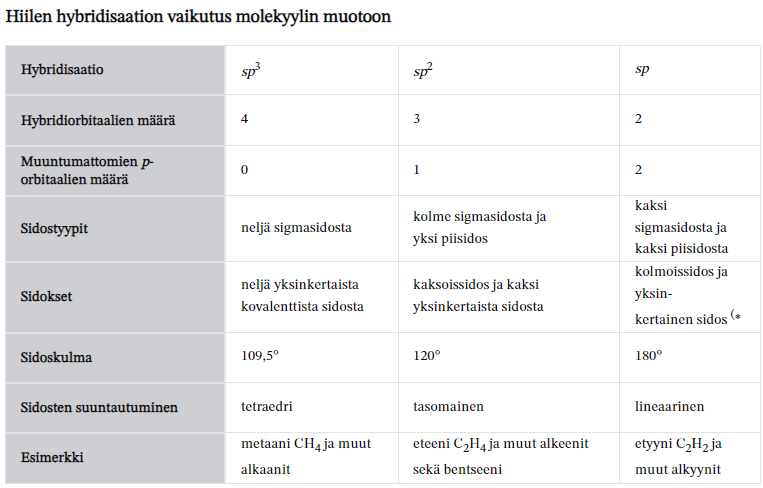
Hiiliatomi
Hiiliatomi
Typpiatomi
\(\mathrm{p^+}\)
\(\mathrm{e^-}\)
n
6
6
7
6
6
7
12 - 6 = 6
13 - 6 = 7
14 - 7 = 7
Hiiliatomit ovat toistensa isotooppeja.
Tiettyyn isotooppiin viitataan sen massaluvulla.
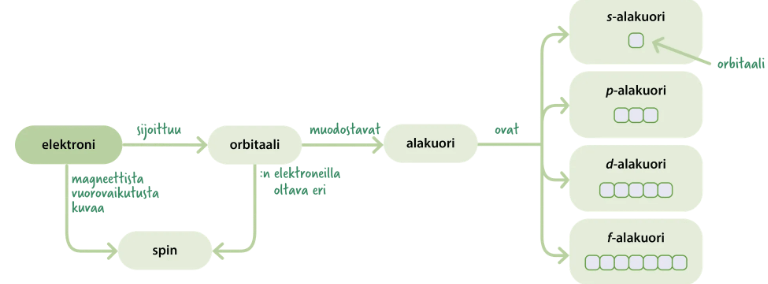
Kvanttimekaaninen atomimalli
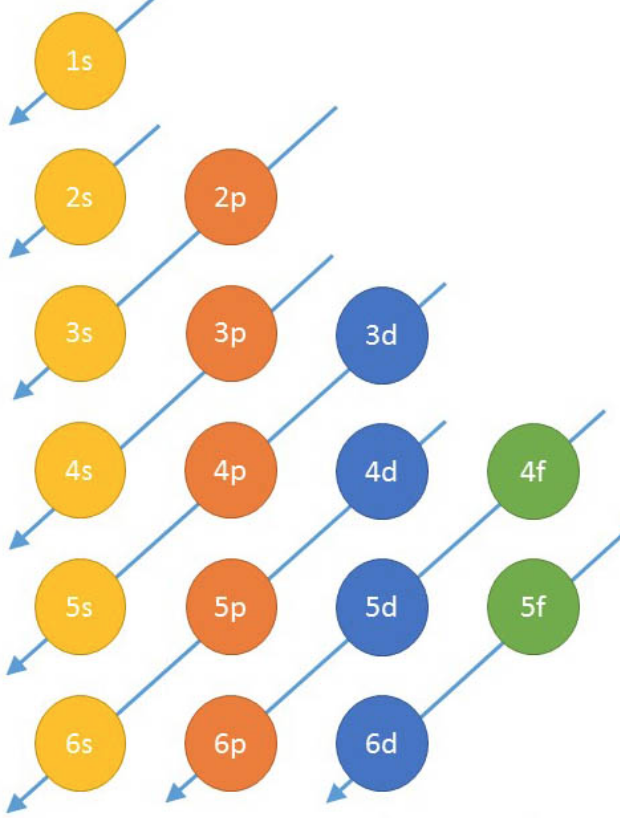
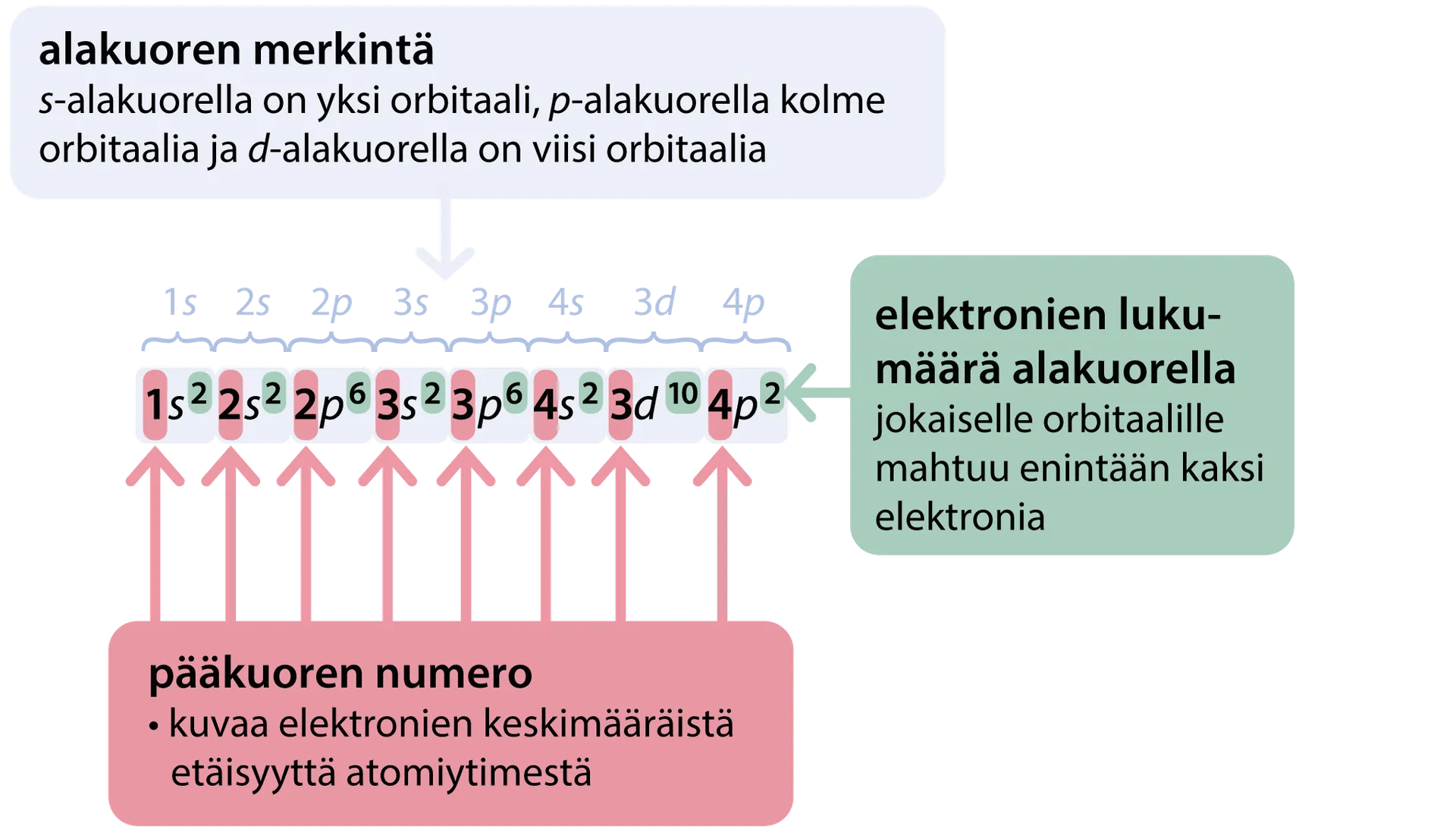
Elektronirakenteen kirjoittaminen
- Minimienergiaperiaate: Elektroni asettuu aina atomin energialtaan alimmalle orbitaalille.
- Hundin sääntö: orbitaaleille, joilla on sama energia, asettuu aina ensin vain yksi elektroni.
- Paulin kieltosääntö: Samalle orbitaalille ei voi asettua enempää kuin kaksi elektronia.
Esimerkki: Kvanttimekaaninen atomimalli

a) X: 12 elektronia
Mg, magnesium
Y: 22 elektronia
Ti, titaani
Z: 16 elektronia
S, rikki
3s
3p
b)
c) Rikillä on uloimmalla kuorellaan 6 elektronia, joten siltä puuttuu oktetista 2 elektronia. Jos rikki ottaa vastaan 2 elektronia, pääsee se oktettiin, joten sen varaukseksi tulee -2.
MUISTISÄÄNNÖT
- Pääkuoren (pääenergiatason) numero n, n=1,2,3,.....n
- Orbitaalien lukumäärä kuorella n on \(n^2\)
- Elektronien maksimimäärä kuorella n on \(2n^2\)
epämetalli
puolimetalli
metalli
Suurin osa alkuaineista on metalleja!
Tätä versiota jaksollisesta järjestelmästä ei lyödy MAOLista. PAINA MIELEEN!
metalliluonne
atomikoko
ionisoitumisenergia
elektronegatiivisuus
metallioksidit
epämetallioksidit
pH < 7
pH > 7
Ominaisuuksien jaksollisuus
Sidokset
Vahvat sidokset
Heikot sidokset
Hilarakenteet
Miksi sidoksia syntyy?
- Alkuaineet pyrkivät energeettisesti tehokkaaseen rakenteeseen eli oktettiin
- oktetilla tarkoitetaan pääryhmän alkuaineen taipumusta ympäröityä kahdeksalla ulkoelektronilla saavuttaen pysyvän jalokaasurakenteen
- Alkuaine voi päästä oktettiin
- luovuttamalla elektroneita
- ottamalla vastaan elektroneita
- ottamalla elektroneita yhteiskäyttöön
- Kun uusia vahvoja sidoksia muodostuu tai katkeaa, tapahtuu kemiallinen reaktio
ionisidos
kovalenttinen sidos
SIDOKSET
VAHVAT SIDOKSET
HEIKOT SIDOKSET
ionisidos
metalli-
sidos
kovalenttinen sidos
vetysidos
dipoli-dipolisidos
dispersio-voimat
ioni-dipolisidos
molekyylien väliset vuorovaikutukset
HEIKOT SIDOKSET
atomien väliset vuorovaikutukset
vain epämetalleja
vain metalleja
usein metalli + epämetalli
poolinen sidos
pooliton sidos
pooliset
poolittomat
N-H
O-H
F-H
Ionisidos
Miten magnesium saavuttaa oktetin?
Mg
12
24,31
pääryhmä: 2
jakso: 3
\(e^-\): 12
2 ulkoelektronia
3 elektronikuorta
1. kuori: \(2\ e^-\)
2. kuori: \(8\ e^-\)
Jokaiselle kuorelle mahtuu \(2n^2\)
\(\mathrm{Mg^{2+}}\)
Mg
2, 8, 2
kuorimalli:
luovuttaa kaksi elektronia uloimmalta kuorelta
12 \(p^+\)
10 \(e^-\)
varaus: \(12\cdot(+1)+10\cdot(-1)\)
\(=+2\)
2, 8
kuorimalli:
Ionin kaava: \(\mathrm{Mg^{2+}}\)
Miten fluori saavuttaa oktetin?
F
9
19,00
pääryhmä: 17
jakso: 2
\(e^-\): 9
7 ulkoelektronia
2 elektronikuorta
1. kuori: \(2\ e^-\)
2. kuori: \(8\ e^-\)
Jokaiselle kuorelle mahtuu \(2n^2\)
\(\mathrm{F^{-}}\)
F
2, 7
kuorimalli:
ottaa vastaan yhden elektronin uloimmalle kuorelle
9 \(p^+\)
10 \(e^-\)
varaus: \(9\cdot(+1)+10\cdot(-1)\)
\(=-1\)
2, 8
kuorimalli:
Ionin kaava: \(\mathrm{F^{-}}\)
Ioniyhdiste eli suola
- yleensä metallien ja epämetallien muodostamia yhdisteitä
- kationit ja anionit sitoutuvat toisiinsa ionisidoksilla
- ionisidos on sähköinen vetovoima erimerkkisten ionien välillä
Millainen ioniyhdiste muodostuu magnesiumista ja fluorista?
magnesium
pääryhmä 2
2 ulkoelektronia
fluori
pääryhmä 17
7 ulkoelektronia
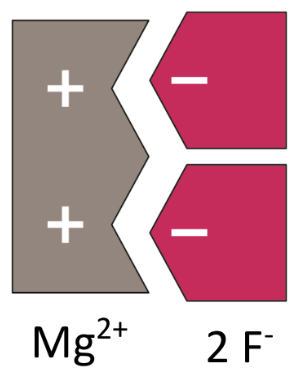
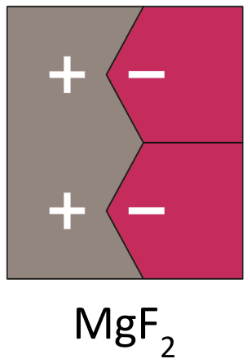
- varausten summan pitää olla nolla
- ensin positiivinen ioni, sitten negatiivinen ioni
- ionivarauksia ei kirjoiteta näkyviin
- ionien suhteellinen määrä ilmaistaan alaindekseillä
ensin kationin nimi, sitten anionin nimi
magnesiumfluoridi
Ioniyhdisteen kaava
Ioniyhdisteen ominaisuuksia
- Kiinteässä olomuodossa ioniyhdisteet muodostavat ionihilan
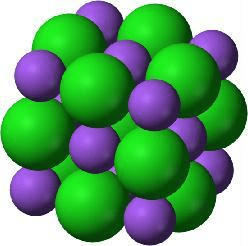
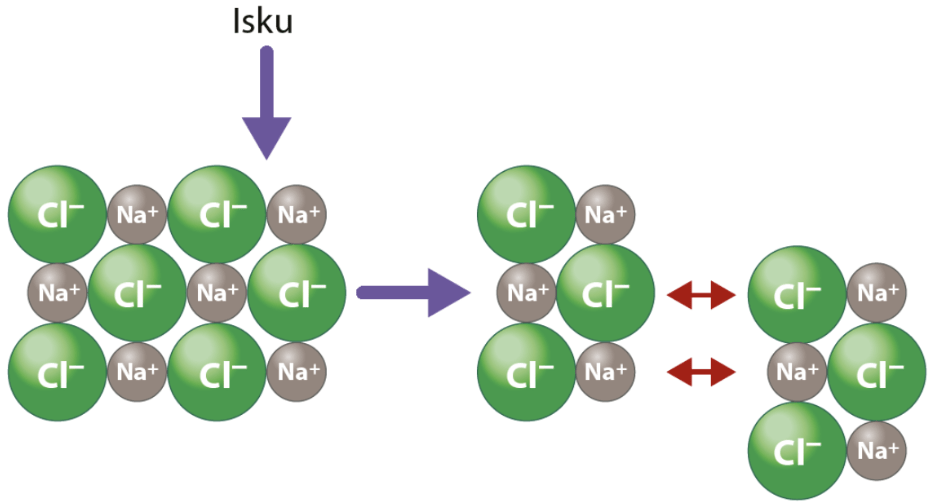
Suoloilla on korkeat sulamispisteet.
Ioniyhdisteet johtavat sähköä vesiliuoksena ja sulatteena, mutta eivät kiinteässä olomuodossa.
Ioniyhdisteet ovat kovia, mutta hauraita.
Ionisidos on vahva ja sen katkaisemiseen tarvitaan paljon energiaa.
Suolaliuoksessa ja -sulatteessa ionit pääsevät liikkumaan vapaasti, mikä tekee niistä sähköä johtavia
Kiinteässä hilassa ei ole vapaita ioneja --> virta ei kulje
Metallisidos
Metallisidos ja metallihila
- Kiinteässä olomuodossa metallit muodostavat metallihilan.
- Metallihilaa pitää koossa metallisidos.

metallikationi
esim.
ulkoelektronit otetaan yhteiskäyttöön
elektronikaasu
"kationisaaret ja elektronimeri"
delokalisoituneet ulkoelektronit

Metallien ominaisuudet
Metallit ovat yleensä kiinteitä.
Metallit johtavat hyvin lämpöä ja sähköä.
Metallit ovat muokattavia.
Metallit ovat kiiltäviä ja läpinäkymättömiä.
Metallihilaa koossa pitävä metallisidos on vahva ja sen katkaisemiseen tarvitaan paljon energiaa.

Lämpö aiheuttaa lämpövärähtelyä, joka siirtyy tiivistä metallihilaa pitkin.
Metallihilassa on vapaasti liikkuvia elektroneja, jotka toimivat sähkövirran kuljettajina.
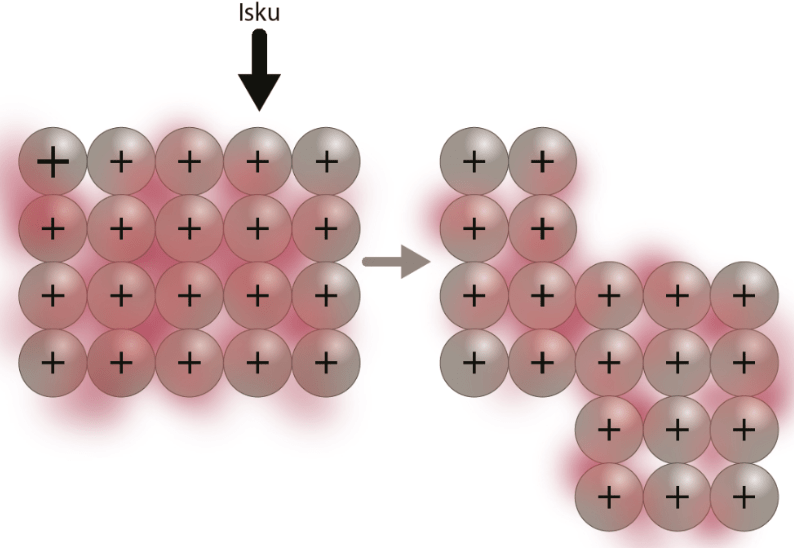
Delokalisoituneiden elektronien takia kationien välinen hylkimisvoima ei pääse hajottamaan metallihilaa.
Näkyvä valo osuu metallin pintaan, jolloin delokalisoituneet elektronit virittyvät. Viritystila purkautuu ja vapautuva energia näkyy valona.
Osa valosta imeytyy tiiviiseen metallihilaan. Näkyvän valon aallonpituudet eivät läpäise tiivistä metallikerrosta, joten metalli on läpinäkymätön.
Kovalenttinen sidos
Kovalenttinen sidos
- Epämetallit eivät luovuta elektroneja kokonaan toisille atomeille, vaan ne ottavat elektronit yhteiskäyttöön
Kovalenttinen sidos
- Yhdisteitä, jotka muodostuvat kovalenttisin sidoksin, kutsutaan molekyyleiksi
Miten alkuainemolekyylit muodostuvat?
pääryhmä: 1
pääryhmä: 16
pääryhmä: 15
H
H
H
H
O
1 elektroni
yksi elektronipari
O
2 elektronia
kaksi elektroniparia
O
O
N
N
N
N
yksinkertainen kovalenttinen sidos
3 elektronia
kovalenttinen kaksoissidos
kovalenttinen kolmoissidos
kolme elektroniparia
puuttuu:
yhteiskäyttöön:
muodostuu:
Lewisin rakenne
Elektronegatiivisuus
- Alkuaineen elektronegatiivisuus kuvaa sitä, kuinka voimakkaasti atomi vetää puoleensa yhteisiä sidoselektroneita
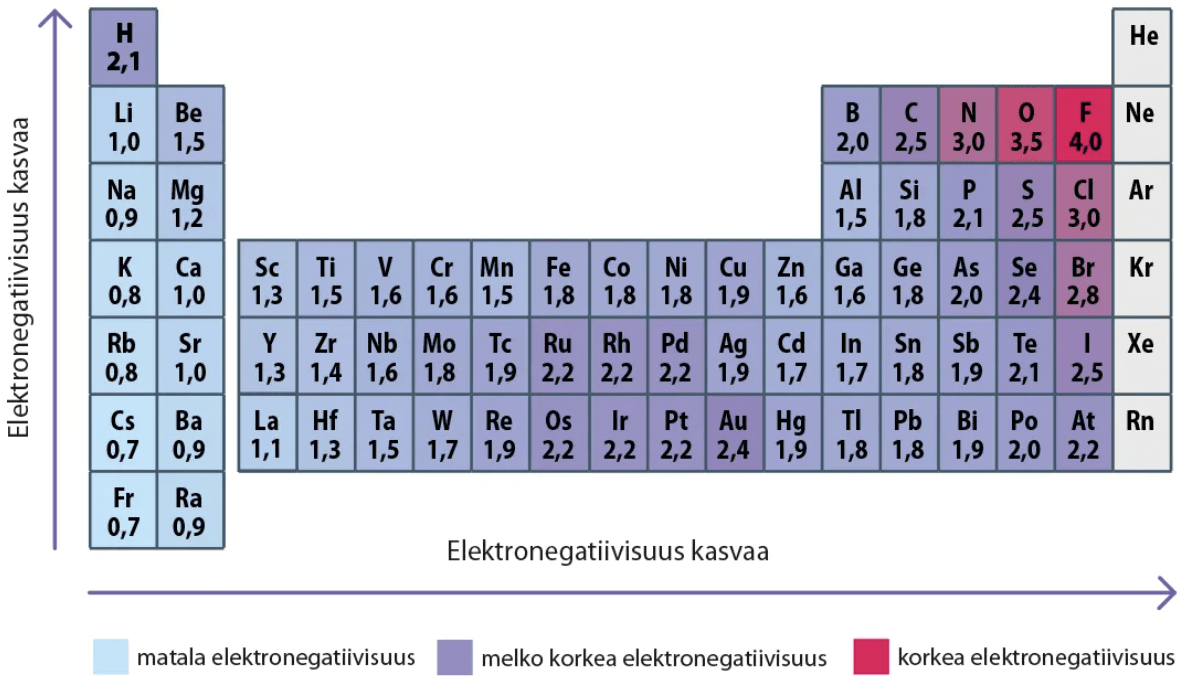
Metallien elektronegatiivisuus-arvot ovat pääsääntöisesti pienempiä kuin epämetallien arvot.
Jalokaasuille ei ole määritetty elektronegatiivisuusarvoa
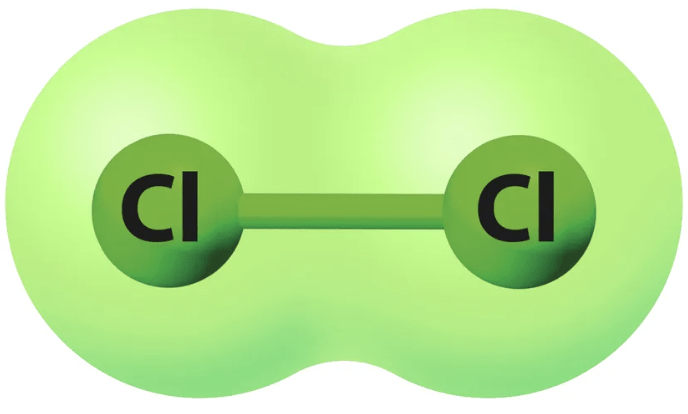
Pooliton kovalenttinen sidos
Poolinen kovalenttinen sidos
- alkuaineilla sama elektronegatiivisuusarvo
- atomit vetävät sidoselektroneja puoleensa yhtä voimakkaasti
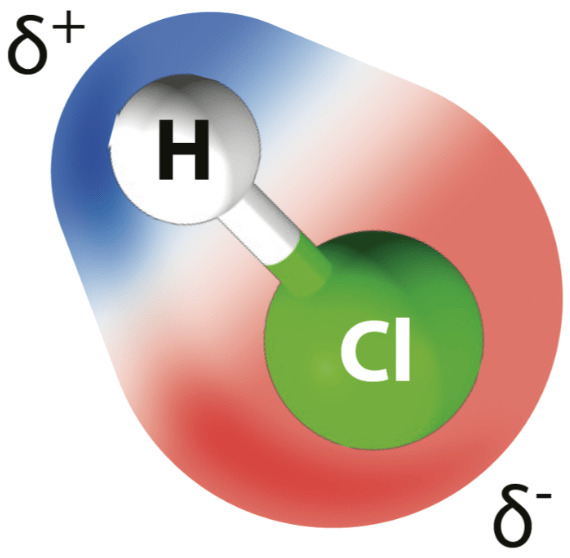
vety: 2,1
kloori: 3,0
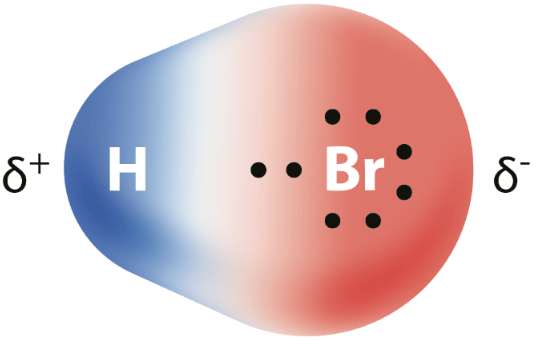
- elektronegatiivisempi alkuaine vetää yhteisiä sidoselektroneja voimakkaammin puoleensa
elektronitihentymä
elektronivajaus
elektronegatiivisuusero:
A
A
Sidoksen ioniluonne
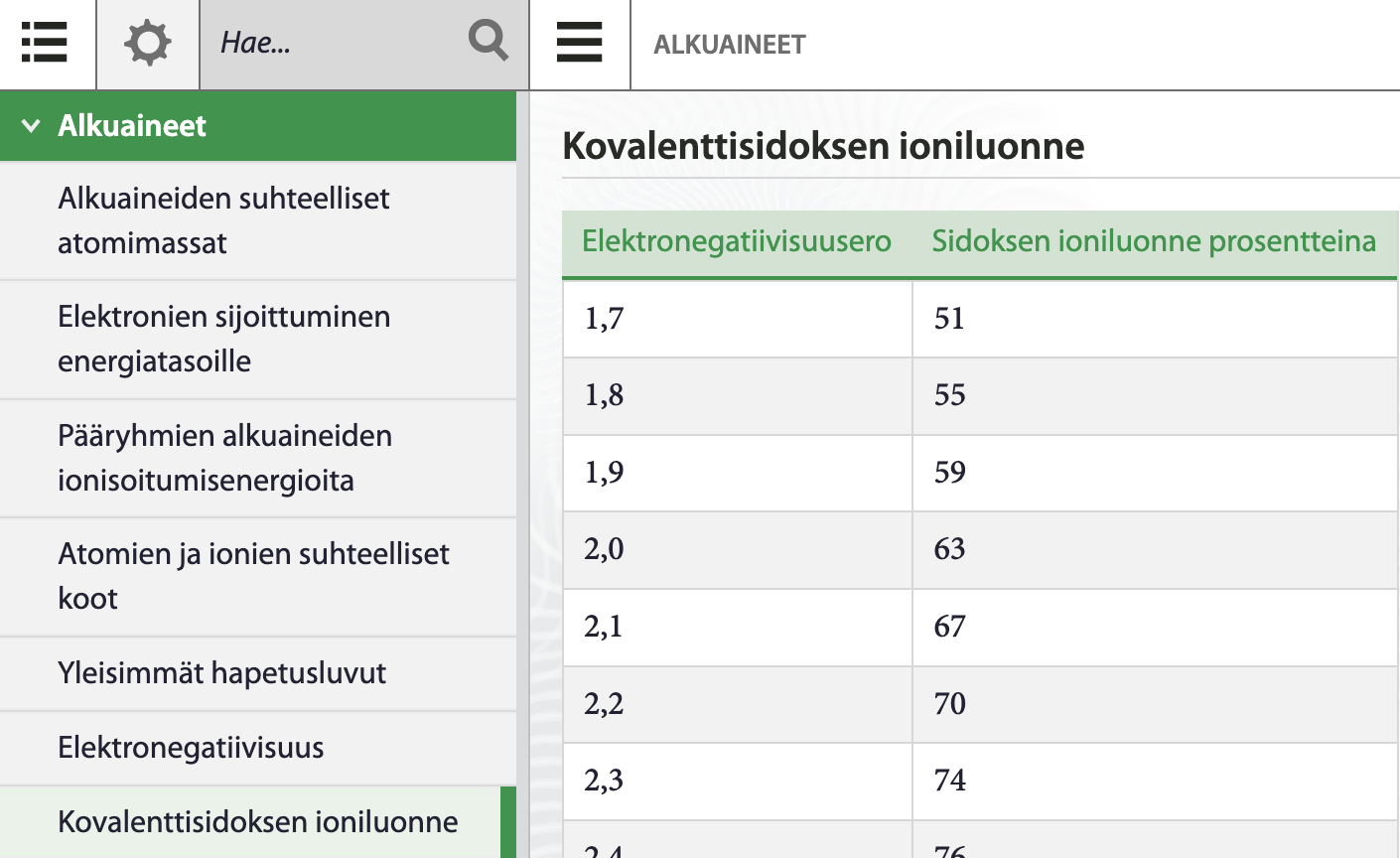

Taulukon alla!
B
A
B
B
A
D
C
sidoksen ioniluonne kasvaa
+
-
pooliton kovalenttinen sidos
poolinen kovalenttinen sidos
ionisidos
Sidoksen poolisuus
Millainen sidos alkuaineiden välille muodostuu?
C ja C
C ja H
H ja O
K ja Br
pooliton kovalenttinen sidos
heikosti poolinen kovalenttinen sidos
poolinen kovalenttinen sidos
ionisidos
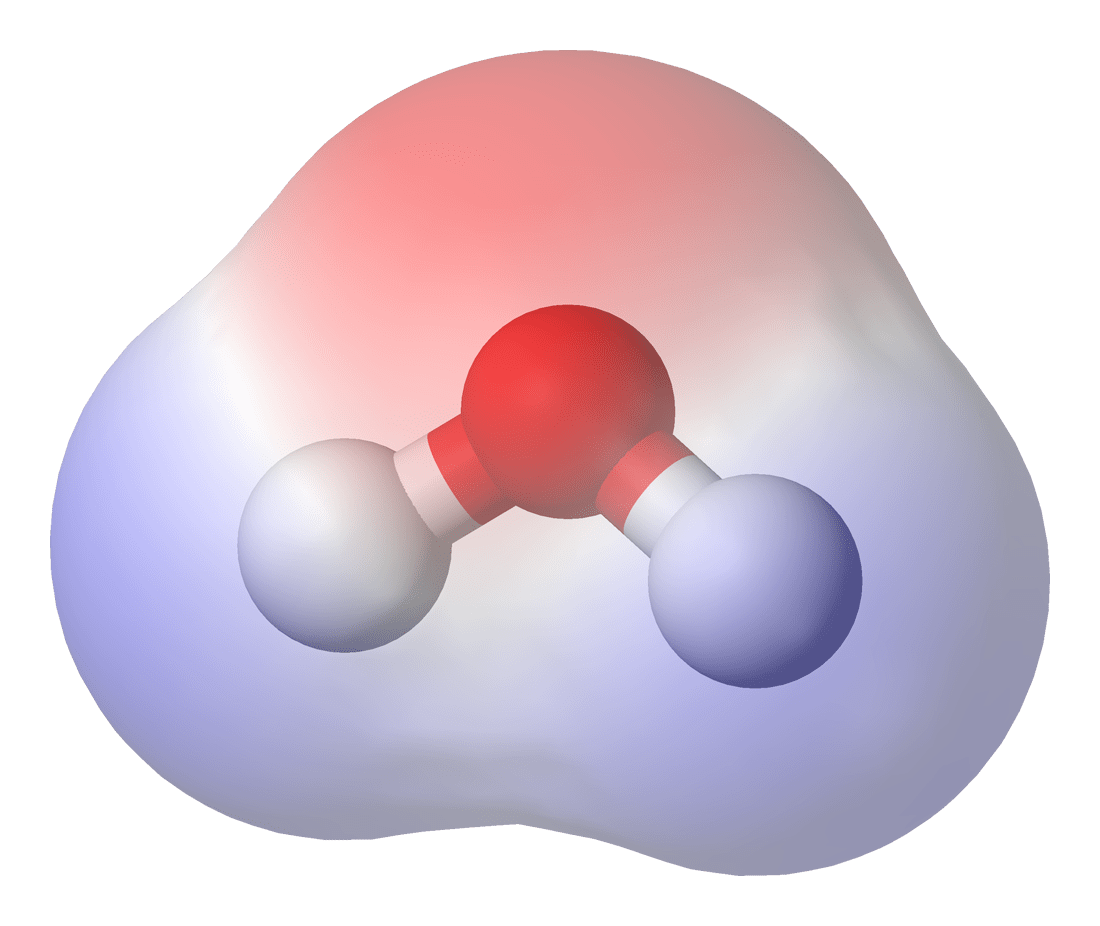
Molekyylin poolisuus
Molekyylin muoto vaikuttaa poolisuuteen
- Vaikka molekyylissä olisi poolisia sidoksia, on molekyyli pooliton, jos osittaisvaraukset kumoutuvat
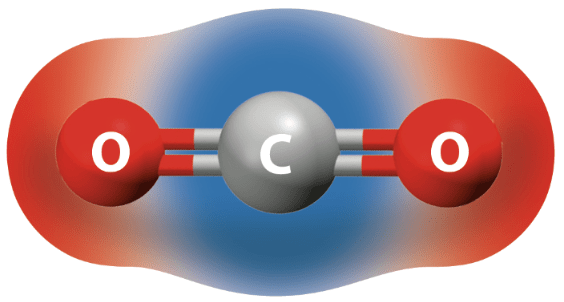

- Osittaisvaraukset kumoutuvat, jos elektronegatiivisuusarvoltaan samanlaiset atomit ovat
- lineaarisen molekyylin vastakkaisissa päissä
- samassa tasossa 120° kulmassa toisiinsa nähden
- tetraedrin kulmissa
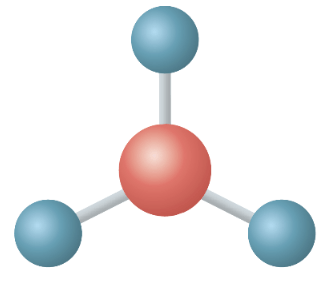
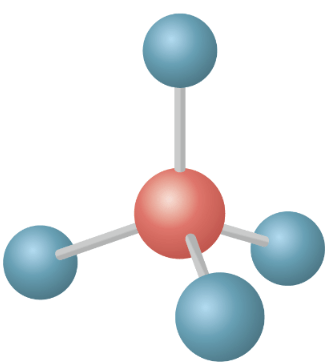
Muodot, jotka kumoavat poolisuuden, jos sidokset ovat samanlaisia
Molekyyli
POOLINEN MOLEKYYLI
POOLITON MOLEKYYLI
kaikki sidokset poolittomia
molekyylissä vain yksi sidos, joka poolinen
DIPOLI
pysyvät osittaisvaraukset
sisältää poolisia sidoksia, mutta osittaisvaraukset kumoutuvat
muodon takia

Onko molekyyli poolinen vai pooliton?
- Miten poolisia sidokset ovat?
- Kuinka monta poolista sidosta molekyylissä on?
- Kumoutuvatko osittaisvaraukset?
- Miten suuri osuus poolisilla sidoksilla on poolittomaan osaan verrattuna?
Heikot sidokset
Atomien ja molekyylien välisten vuorovaikutusten katkeaminen
Atomien väliset vuorovaikutukset
Molekyylien väliset vuorovaikutukset
- Jos nämä vuorovaikutukset katkeavat, aine muuttuu toiseksi.
kemiallinen reaktio
- Jos nämä vuorovaikutukset katkeavat, olomuoto muuttuu.
- aine pysyy samana
vaatii aina energiaa!
vetysidokset
dipoli-dipolisidokset
dispersiovoimat

vetysidos
nestemäinen vesi
vetysidoksia katkeaa ja muodostuu jatkuvasti
kiinteä vesi
vetysidokset pysyvät paikoillaan
ionisidos
metallisidos
kovalenttinen sidos
vahvuus
Molekyylien väliset vuorovaikutukset
molekyyli on poolinen
DIPOLI-DIPOLISIDOS
- erimerkkisten osittaisvarausten välille muodostuu vetovoima
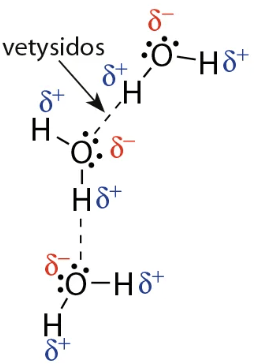
VETYSIDOS
-
dipoli-dipolisidoksen erikoistapaus
- molekyylissä
N-H, O-H tai F-H
- molekyylissä
- vahvin molekyylien välisistä vuorovaikutuksista
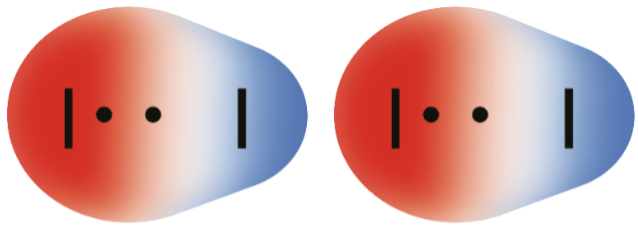
molekyyli on pooliton
DISPERSIOVOIMAT
- hetkellisten dipolien välinen vuorovaikutus
- mitä enemmän molekyylissä on elektroneja ja mitä suurempi molekyyli on, sitä suurempia ovat dispersiovoimat
- esiintyy kaikkien atomien, ionien ja molekyylien välillä


Heikkojen sidosten vaikutus aineen ominaisuuksiin
Pohdi sidosten avulla, miksi
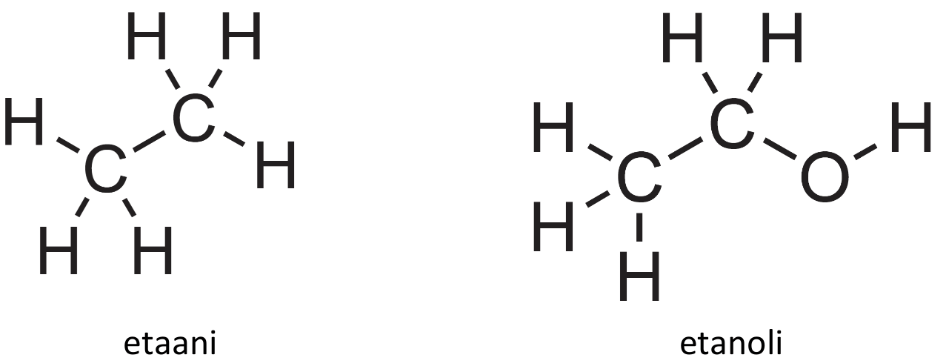
etanolin \(\mathrm{C_2H_5OH}\) kiehumispiste on korkeampi kuin etaanin \(\mathrm{C_2H_6}\).
happi \(\mathrm{O_2}\) on huoneenlämpötilassa kaasu, mutta vesi on neste
\(\mathrm{O_2}\)
- atomien välillä pooliton kovalenttinen sidos
pooliton molekyyli
molekyylien välillä dispersiovoimia
heikoin
kaasu
\(\mathrm{H_2O}\)
- atomien välillä poolisia kovalenttisia sidoksia + O-H-sidos

vetysidokset
neste
vahvoja!
pooliton molekyyli
poolinen molekyyli
vetysidokset
dispersiovoimat
Mitä voimakkaampia molekyylien väliset vuorovaikutukset ovat, sitä enemmän energiaa olomuodonmuutokseen kiinteästä nesteeksi tarvitaan (kiehumispiste). Vetysidokset ovat vahvempia kuin dispersiovoimat, joten etanolin kiehumispiste on korkeampi kuin etaanilla.
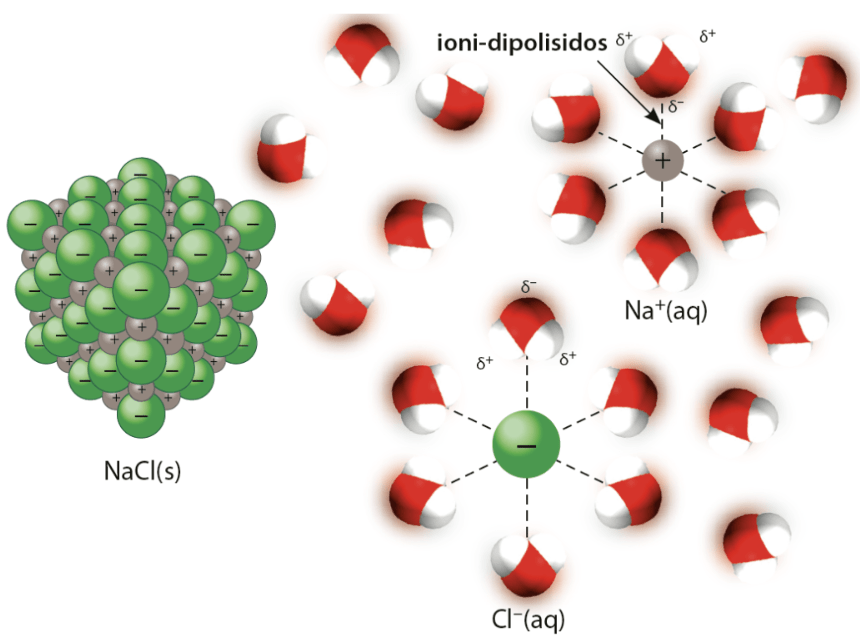
Ioniyhdisteen vesiliukoisuus
- ioniyhdisteen liukenemista veteen kutsutaan hydratoitumiseksi
- akvaioni muodostuu, kun ioni on sitoutunut veteen ioni-dipolisidoksin
- ioni-dipolisidos on heikko sidos, joka on kuitenkin vahvempi kuin molekyylien väliset sidokset
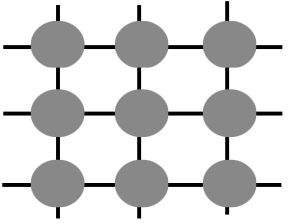
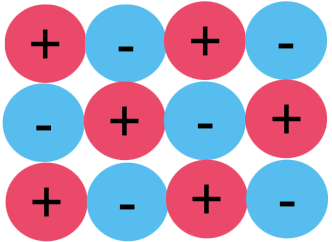
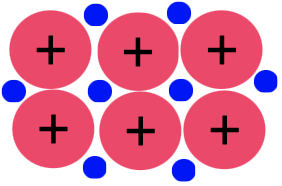
Hilarakenteet
Ionihila
Hilatyyppi
Rakenneosat
Kovalenttinen hila
Metallihila


Poolinen molekyylihila
Pooliton molekyylihila
kationit ja anionit
atomit tai poolittomat molekyylit
metalli-kationit ja vapaat elektronit
pooliset molekyylit
poolittomat molekyylit
Hilaa koossapitävät sidokset
ionisidos
kovalenttiset sidokset
metallisidos
vetysidokset tai dipoli-dipolisidokset
dispersiovoimat
vahva sidos
vahva sidos
vahva sidos
heikko sidos
heikko sidos
Alkuaineatomien välillä
ionisidos
vahva sidos
kovalenttiset sidokset
vahva sidos
metallisidos
vahva sidos
poolinen kovalenttinen sidos
pooliton tai poolinen kovalenttinen sidos
vahva sidos
vahva sidos
Tarkastellaan seuraavia aineita: timantti(s), \(\mathrm{K_2SO_4(aq),\ NH_3(g),\ NaCl(s),\ PH_3(s)}\).
a) Onko aineella hilarakenne ja jos on, niin millainen se on? Mitä sidoksia aineessa on? (13 p.)
b) Katso video liekkikokeista. Mitkä yllä olevista aineista voidaan tunnistaa oheisen liekkikokeen perusteella? Minkä värinen liekki on? (2 p.)
Katso video "Liekkikokeet"
Esimerkki
\(\mathrm{K_2SO_4(aq)}\)
ei hilarakennetta
Hilarakenne
Sidokset
ioni-dipolisidokset ionien ja veden välillä
vetysidokset vesimolekyylien välillä
timantti(s)
kovalenttinen hila
poolittomat kovalenttiset sidokset hiiliatomien välillä
\(\mathrm{NH_3(g)}\)
ei hilarakennetta
pooliset kovalenttiset sidokset vety- ja typpiatomien välillä
kaasussa vain vähän hetkellisiä vetysidoksia
NaCl(s)
ionihila
ionisidokset natrium- ja kloridi-ionien välillä
\(\mathrm{PH_3(s)}\)
pooliton molekyylihila
poolittomat kovalenttiset sidokset fosfori- ja vetyatomien välillä
dispersiovoimat molekyylien välillä
Kovalenttinen hila
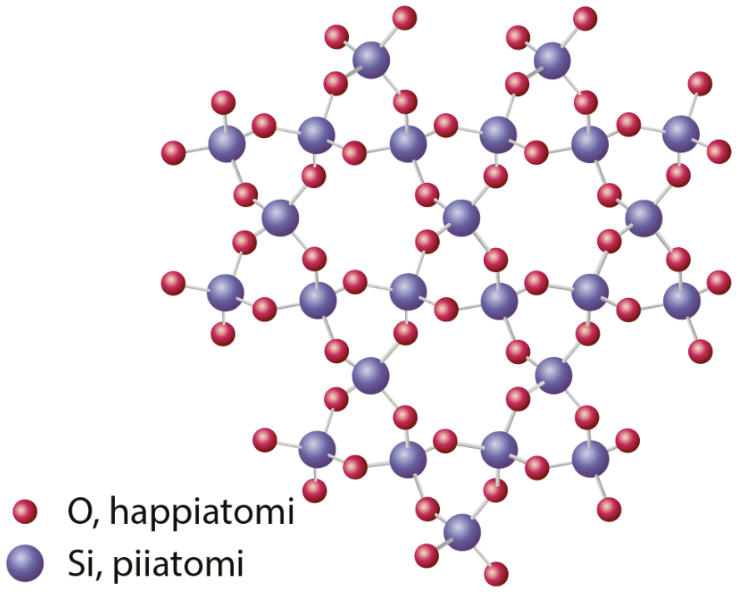


- säännöllisesti järjestynyt rakenne, jossa atomit liittyvät toisiinsa kovalenttisin sidoksin
- voi koostua yhdestä tai useammasta alkuaineesta
Molekyylihila
Poolinen molekyylihila
- pooliset molekyyliyhdisteet muodostavat poolisen molekyylihilan
- pysyy kasassa dipoli-dipolisidosten tai vetysidosten avulla
Pooliton molekyylihila
- poolittomat molekyyliyhdisteet muodostavat poolittoman molekyylihilan
- pysyy kasassa dispersiovoimien avulla
- kiinteässä olomuodossa olevissa molekyyleissä esiintyvä säännöllinen rakenne


Reaktioyhtälöt
Reaktioyhtälöt
- Reaktioyhtälön kertoimiksi pienimmät mahdolliset kokonaisluvut.
- Reaktioyhtälöön kirjoitetaan näkyviin aineiden olomuotojen tunnukset.
- Ilmassa esiintyvät alkuaineet ja yhdisteet ovat kaasuja, joten niiden olomuodoksi merkitään (g).
- Suolat eli kaikki ioniyhdisteet ovat huoneen lämpötilassa kiinteitä aineita (s).
- Metallit elohopeaa lukuun ottamatta ovat huoneenlämpötilassa kiinteitä (s).
- Reaktioyhtälössä esiintyvä vesi on olomuototunnukseltaan (l). Poikkeuksen muodostaa palamisreaktiossa muodostuva vesihöyry
- Liuosten olomuototunnuksena käytetään merkintää (aq), kun liuottimena on vesi.
- Kiinteät ja nestemäiset alkuaineet kirjoitetaan reaktioyhtälöön yksiatomisina kuten Cu, Fe, Ni, Hg. Poikkeuksena kiinteä jodi ja nestemäinen bromi kirjoitetaan kaksiatomisina
- Kaasumaiset alkuaineet kirjoitetaan kaksiatomisina. Poikkeuksena kaikki jalokaasut kirjoitetaan yksiatomisina.
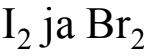
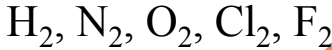

Reaktioyhtälöt

Tehtävätyyppejä
- Suhde-, molekyyli- ja rakennekaava (tulee orgaanisen kemian yhteydessä)
- Rajoittava tekijä (lähtöaine loppuu kesken)
- Reaktion saanto
- Kaasulaskut
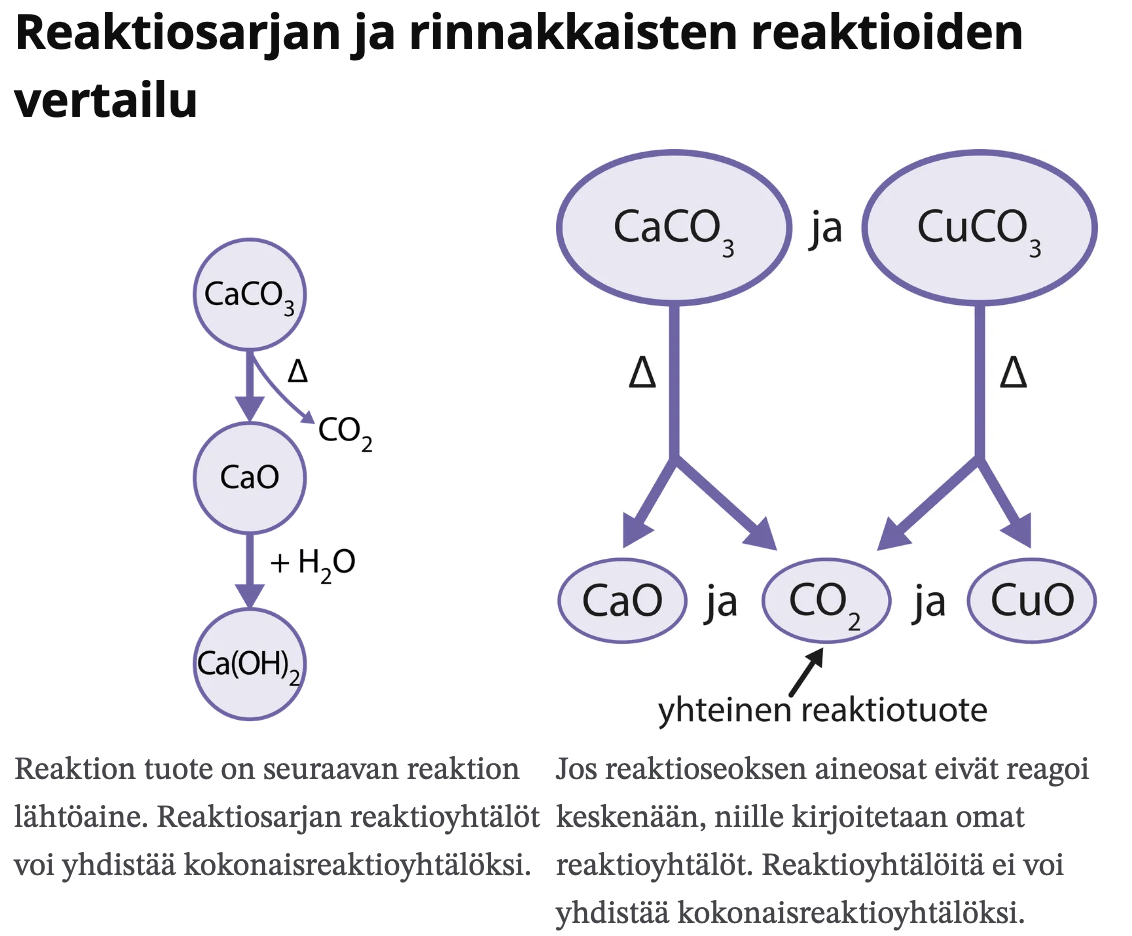
- Seoslaskut (rinnakkaiset reaktiot)
- Reaktiosarja

Hapetuslukuja
Erilaisia reaktioita
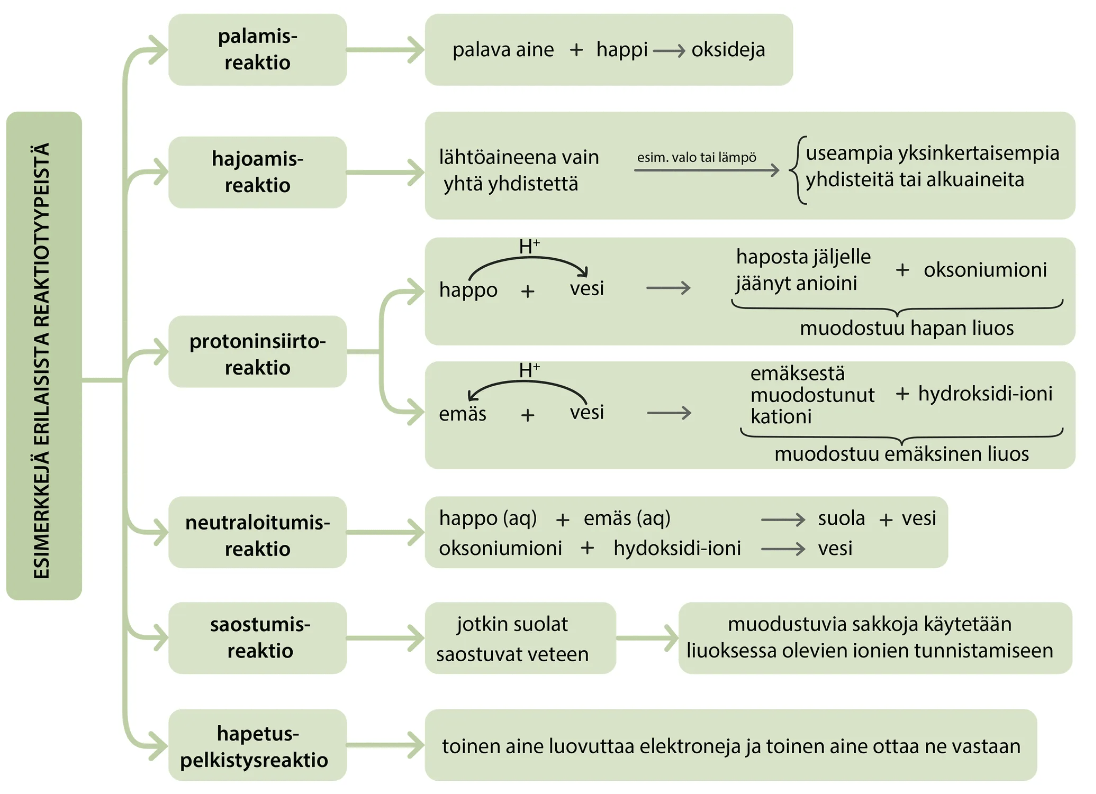
Orgaaniset yhdisteet
- Esitä kysyttyjen yhdisteiden rakenteet niin, ettei jää epäselväksi, mikä on esittämäsi vastaus
- Älä jätä ylimääräisiä rakenteita vastaukseesi!
- Jos vastauksessa on sekä oikea rakenne että joku muu rakenne ilman selkeästi esitettyä vastausta, tulkitaan, että vastaus on sekä oikein että väärin, ja se menee nollille
- Tarkista yhdisteestä, että
- funktionaalisen ryhmän rakenne on oikein
- vastauksen rakenteessa ei ole ylimääräisiä tai puuttuvia hiiliatomeja
- atomeista lähtee oikea määrä sidoksia
- varaukset ovat oikein ja oikeissa kohdissa
- vastauksen rakenne vastaa tehtävänantoa
- Jos rakennekaavat ovat osana reaktioyhtälöä, muista tasapainottaa reaktioyhtälö.
Rakennekaavat
Esimerkki
Piirrä 2-hydroksibentoehappo.
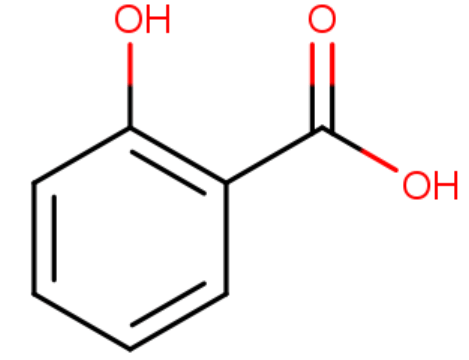
Jos tehtävänannossa on viivakaava, mieluiten vastaukseksi viivakaava.
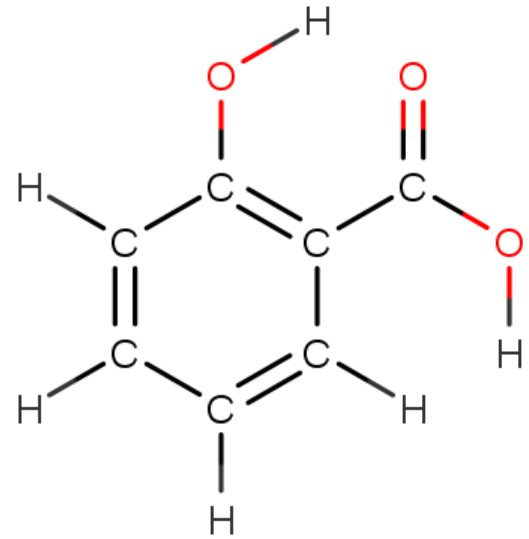
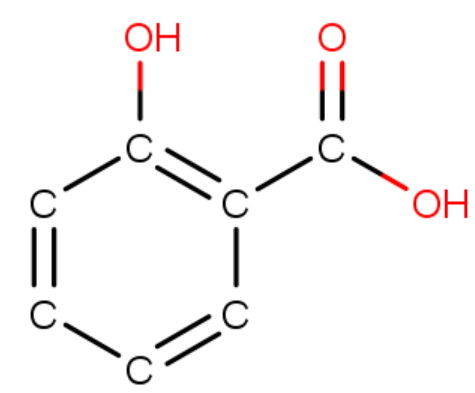
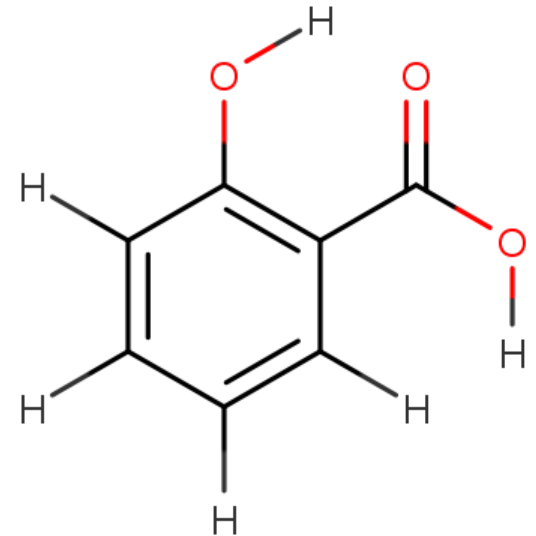
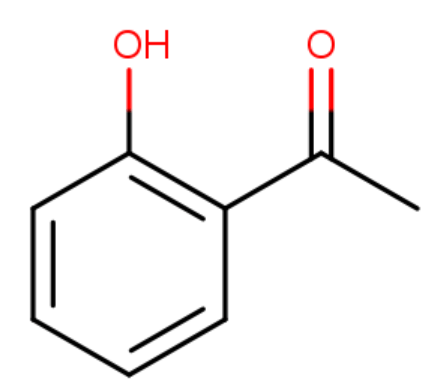
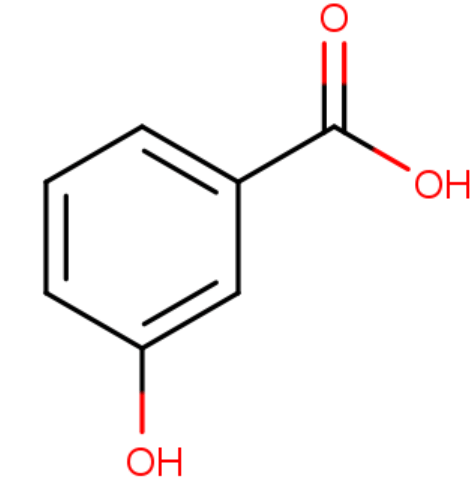
puuttuvat vedyt
vedyt näkyvissä, hiilet ei
väärä funktionaalinen ryhmä
väärä paikka
EI NÄIN!
VAAN NÄIN!
Tyypillisiä virheitä
- Funktionaalinen ryhmä ja yhdisteryhmä menevät sekaisin
- esimerkiksi amiinissa oleva funktionaalinen ryhmä on aminoryhmä, ei "amiiniryhmä"
- Rakennekaavoihin on merkitty hiiliatomit näkyviin C-kirjaimille, mutta vetyatomit puuttuvat
- Orgaanisen reaktioyhtälön tasapainotus puuttuu
- Orgaanisessa suolassa ionien väliin on merkitty kovalenttinen sidosviiva
- ionien välistä sidosta ei kirjoiteta, vaan ionit kirjoitetaan vierekkäin ilman ionivarauksia tai ionivarausten kanssa
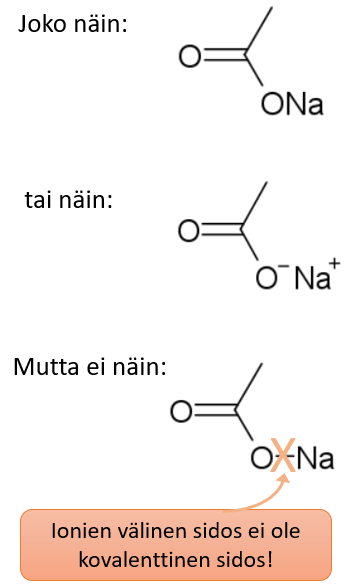
Orgaaninen suola
Hiilivetyjen luokittelu
rakenteessa bentseenirengas?
kyllä
aromaattinen yhdiste
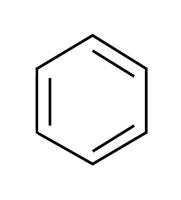
ei
alifaattinen yhdiste
rakenteessa kaksois- tai kolmoissidos?
kyllä
ei
tyydyttymätön yhdiste
tyydyttynyt yhdiste
alkaani
alkeeni
alkyyni
syklinen yhdiste
voi olla
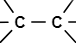
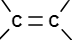
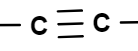

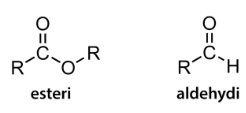

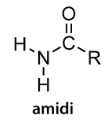
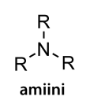
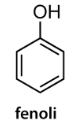
Orgaaniset yhdisteryhmät
Orgaaniset happiyhdisteet
Orgaaniset typpiyhdisteet
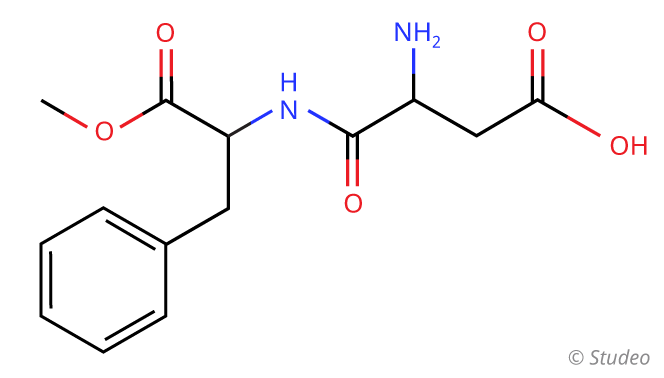
Esimerkki
aminoryhmä
karboksyyliryhmä
amidiryhmä
esteriryhmä
Mihin yhdisteryhmiin yhdiste voidaan luokitella?
esterit, amidit, amiinit, karboksyylihapot
Bentseenirengasta ei tarvitse mainita!
Hiilivetyjen ominaisuudet
C - C
C - H
(C = C, C ≡ C)
elektronegatiivisuusero
2,5-2,1=0,4
elektronegatiivisuusero
2,5-2,5=0

pooliton sidos
heikosti poolinen sidos
Molekyylin poolisuus:
- 4 poolitonta C-C -sidosta
- 12 heikosti poolista C-H -sidosta
- sidokset suuntautuneet tetraedrin muotoon
\(\rightarrow\) molekyyli pooliton
\(\rightarrow\) molekyylien välillä dispersiovoimia
Hiilivetyjen ominaisuuksia
- C-H -sidos on heikosti poolinen, mutta molekyylin muoto on niin symmetrinen, että sidosten vähäinen poolisuus kumoutuu
poolittomia yhdisteitä
molekyylien välille muodostuu dispersiovoimia
liukenevat vain heikosti veteen
hiilivetyjen sulamis- ja kiehumispisteet kohoavat, kun moolimassa kasvaa
Opettele yhdisteryhmien ominaisuuksia kokonaisuutena, niin ei tarvitse päätellä yksittäisten sidosten poolisuutta!
Alkoholit
- sisältävät poolisen hydroksiryhmän -OH
-
yleisimmin alkoholimolekyyleissä hiiliatomien välillä vain yksinkertaisia kovalenttisia sidoksia
- alkoholit ovat tyydyttyneitä yhdisteitä
-
jos alkoholimolekyylin ketjussa on bentseenirengas, kyseessä on aromaattinen alkoholi
- jos OH-ryhmä suoraan kiinni bentseenirenkaassa, yhdiste on fenoli, ei alkoholi!
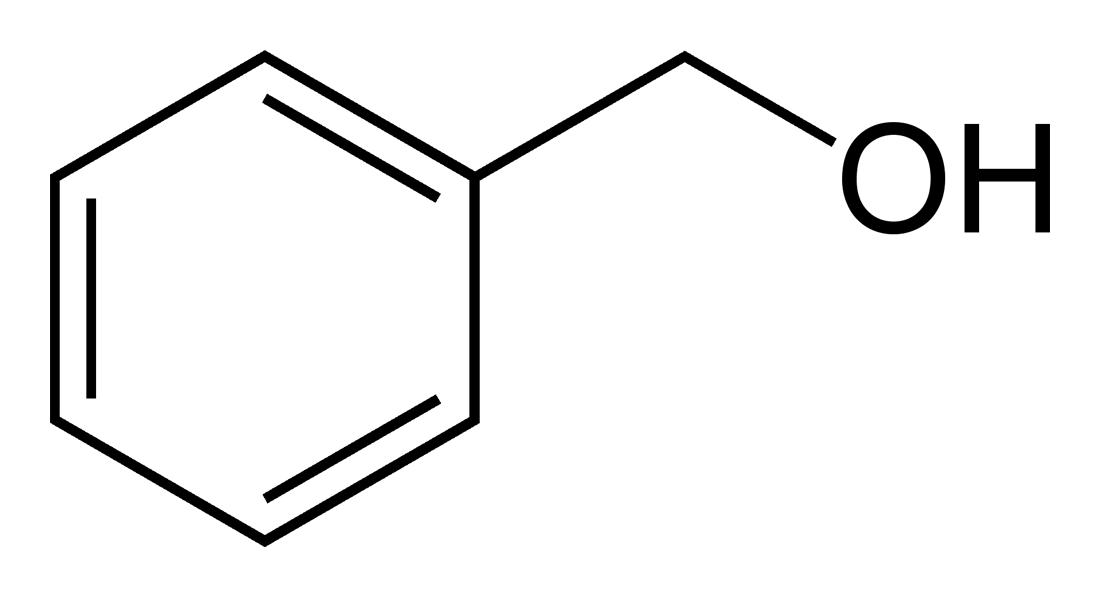
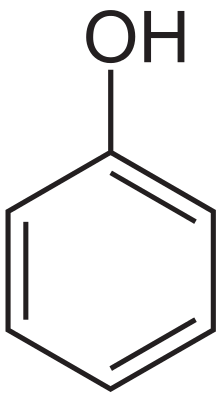
aromaattinen alkoholi
bentsyylialkoholi
fenoli eli karbolihappo
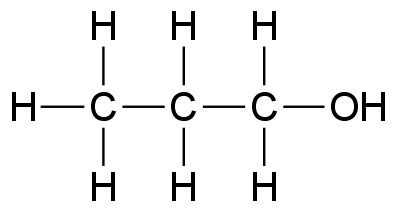
propanoli
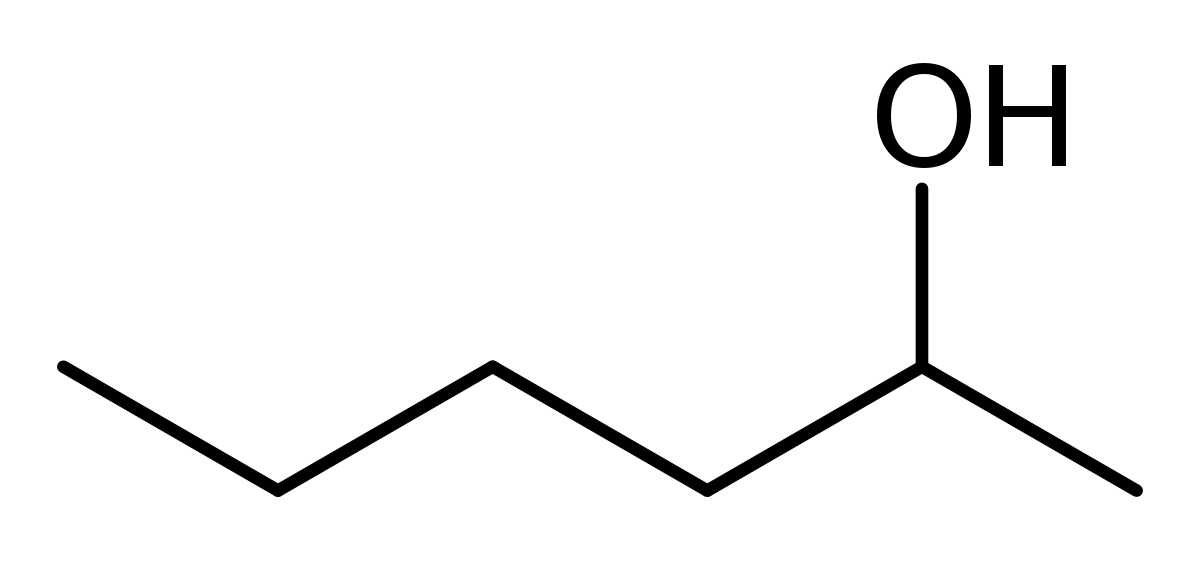
2-heksanoli
Alkoholien luokittelu
-
hydroksiryhmien lukumäärän perusteella
- yksiarvoisissa alkoholeissa yksi OH-ryhmä
- moniarvoisissa alkoholeissa kaksi tai useampia OH-ryhmiä
-
sen perusteella, kuinka monta hiiliatomia on liittynyt OH-ryhmää sitovaan hiileen
- primäärinen alkoholi
- OH-ryhmää sitovaan C-atomiin liittynyt 1 hiiliketju
- sekundäärinen alkoholi
- OH-ryhmää sitovaan C-atomiin liittynyt 2 hiiliketjua
- tertiäärinen alkoholi
- OH-ryhmää sitovaan C-atomiin liittynyt 3 hiiliketjua
- primäärinen alkoholi


Alkoholien ominaisuuksia
-
OH-ryhmä on vahvasti poolinen
- hiili- ja vetyatomeilla positiivinen osittaisvaraus
- happiatomilla negatiivinen osittaisvaraus
-
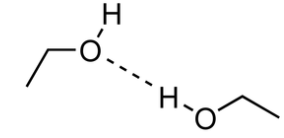
OH-ryhmä mahdollistaa vetysidosten muodostamisen
-
alkoholien sulamis- ja kiehumispisteet ovat korkeampia kuin samankokoisilla alkaaneilla
- sulamis- ja kiehumispisteet kasvavat hiiliketjun pidetessä
-
lyhytketjuiset alkoholit liukenevat helposti veteen
- hiiliketjun pidetessä vesiliukoisuus heikkenee
-
alkoholien sulamis- ja kiehumispisteet ovat korkeampia kuin samankokoisilla alkaaneilla

Karbonyyliyhdisteet

Aldehydit
- karbonyyliryhmä hiiliketjun päässä
- metanaali eli formaldehydi
- etanaali eli asetaldehydi
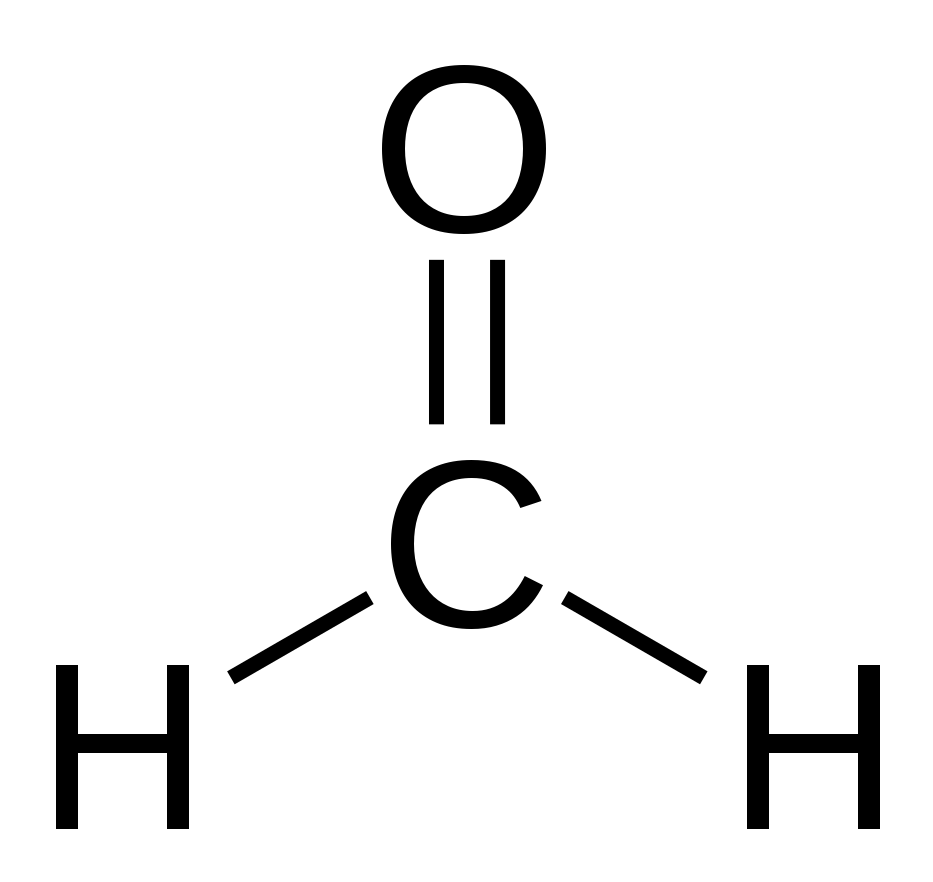
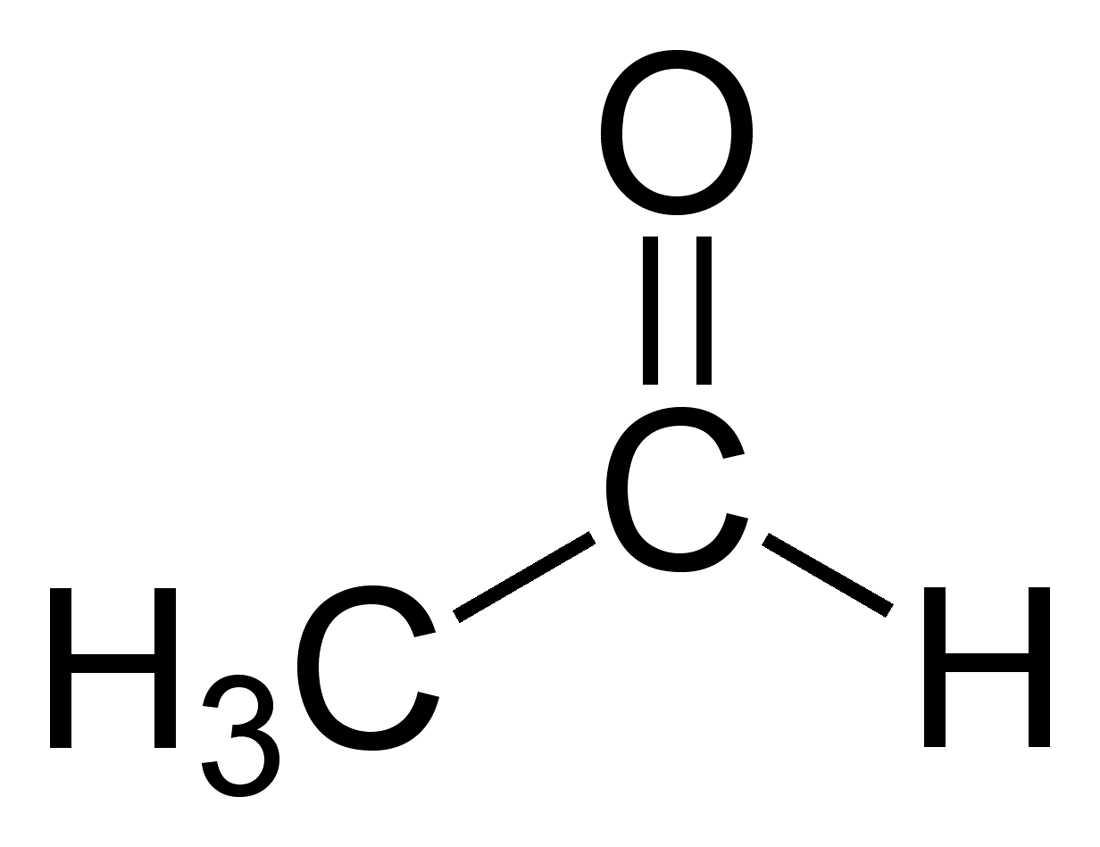

Ketonit
- karbonyyliryhmä hiiliketjun keskellä
- propanoni eli asetoni
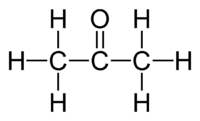

- molekyylien välille dipoli-dipolisidoksia
- pienet molekyylit vesiliukoisia
- vesiliukoisuus heikkenee hiiliketjun pidetessä
Ominaisuudet
aldehydiryhmä
ketoryhmä
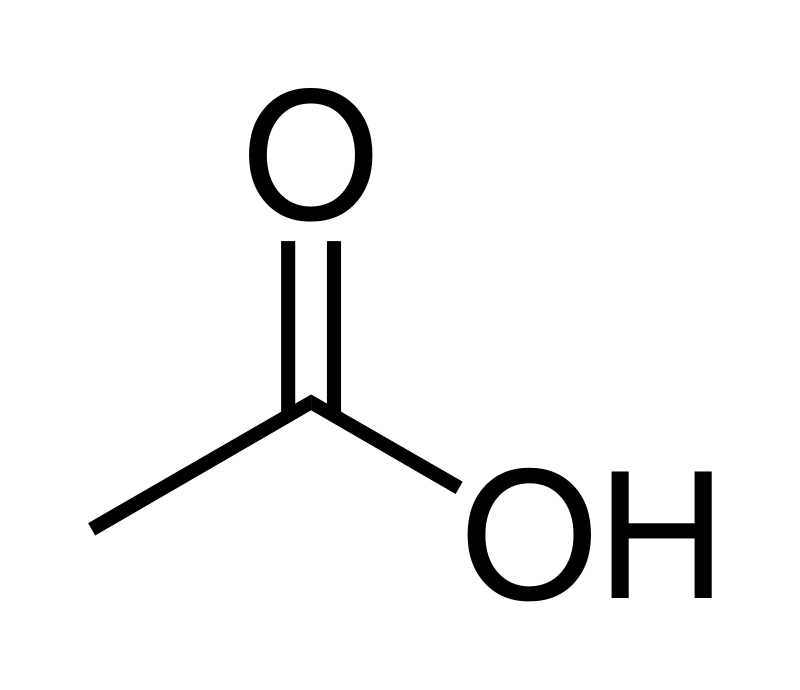
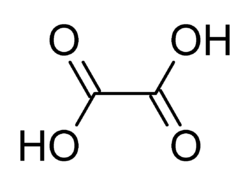
Karboksyylihapot
- sisältävät karboksyyliryhmän
- etaanihappo
- oksaalihappo
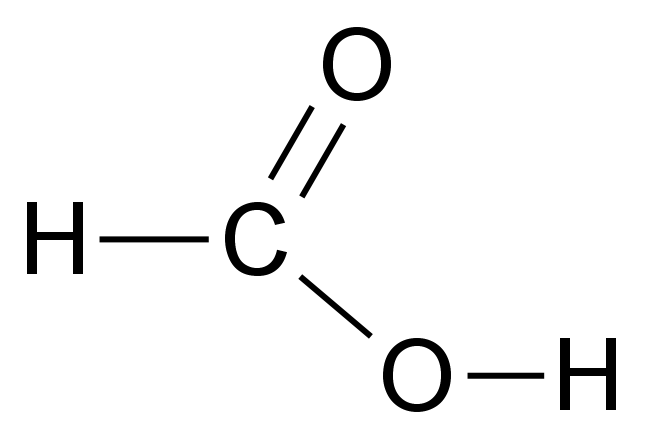
Ominaisuudet

- molekyyli on hyvin poolinen
- molekyylien välille muodostuu vetysidoksia ja dipoli-dipolisidoksia
- liukenevat hyvin veteen
- sulamis- ja kiehumispisteet korkeita
- mitä useampia karboksyyliryhmiä molekyylillä on, sitä paremmin se liukenee veteen
- kun hiiliketju pitenee, sulamis- ja kiehumispisteet nousevat ja vesiliukoisuus heikkenee
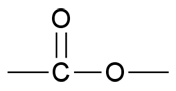
ESTERIT
- sisältävät esteriryhmän
- esiintyvät luonnossa marjojen ja hedelmien aromiaineina
- käytetään limonadeissa ja karkeissa aromiaineena sekä muovien ja kuitujen valmistuksessa
- eivät ole vesiliukoisia

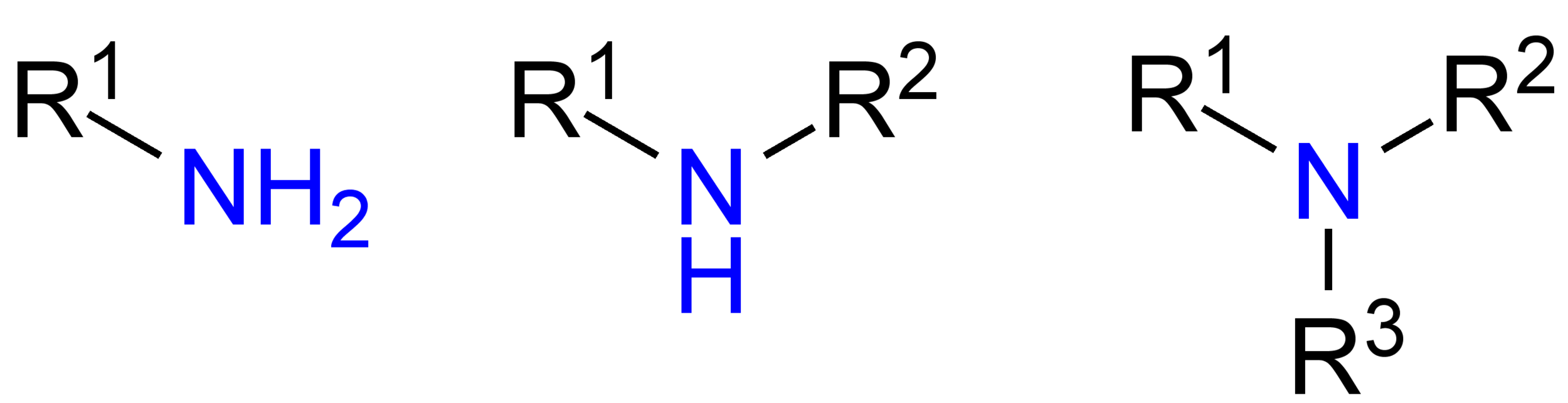
Amiinit
Luokittelu
- primääriset amiinit
- sekundääriset amiinit
- tertiääriset amiinit
N
:
Ominaisuudet
- poolisia
- muodostavat vetysidoksia
- liukenevat hyvin veteen
- kiehumispisteet alhaisempia kuin samankokoisilla alkoholeilla
Amidit
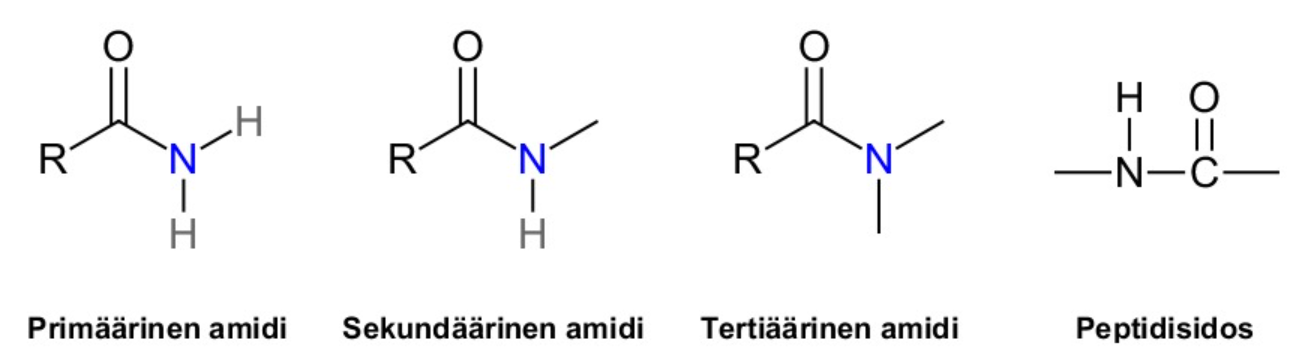
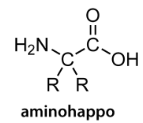
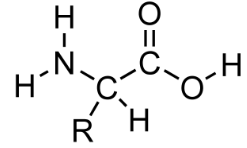
Aminohapot
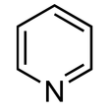
Heterosykliset yhdisteet
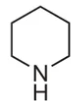
- rengasrakenteinen yhdiste, jossa on renkaassa hiilen tilalta jokin muu alkuaine (esim. typpi, happi tai rikki)
- kaksi funktionaalista ryhmää: aminoryhmä ja karboksyyliryhmä
- proteiinit rakentuvat aminohapoista
Isomeria
Isomeria
Isomeerit = yhdisteitä, joilla on sama molekyylikaava, mutta eri rakennekaava
Rakenneisomeria (konstituutioisomeria)
- atomien sitoutumisjärjestys on erilainen
Stereoisomeria (avaruusisomeria)
- sama rakenne, mutta atomit tai atomiryhmät suuntautuvat avaruudessa eri tavoin
- Konformaatioisomeria
- Cis-trans-isomeria
- enantiomeria eli peilikuvaisomeria
- Ketju- eli runkoisomeria
- Paikkaisomeria
- Funktioisomeria
Rakenne- eli konstituutioisomeria
1) Runkoisomeria (ketjuisomeria)
- hiiliketju on haarautunut eri tavoin
-
vaikuttaa hiiliyhdisteiden sulamis- ja kiehumispisteisiin
- suoraketjuisten hiilivetyjen sulamis- ja kiehumispisteet ovat korkeammat kuin yhtä monta hiiltä sisältävillä haarautuneilla hiilivedyillä
- dispersiovoimat vaikuttavat suoraketjuisilla molekyyleillä isommalle alalle kuin haaratuneilla molekyyleillä
- suoraketjuisten hiilivetyjen sulamis- ja kiehumispisteet ovat korkeammat kuin yhtä monta hiiltä sisältävillä haarautuneilla hiilivedyillä
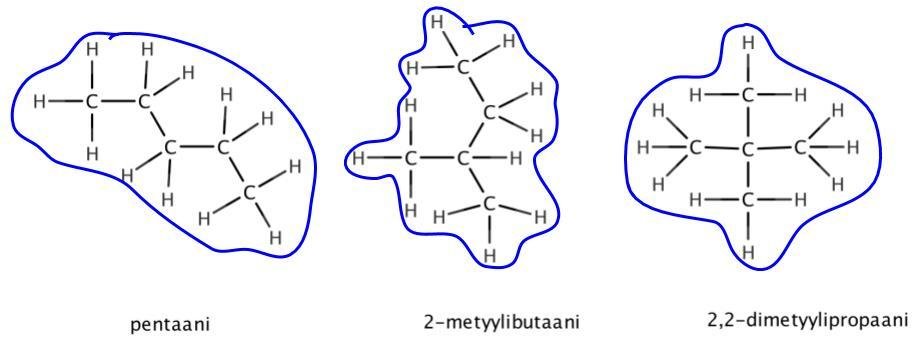
kiehumispiste 36 °C
kiehumispiste 28 °C
kiehumispiste 10 °C
Rakenne- eli konstituutioisomeria
2) Paikkaisomeria
- funktionaalisen ryhmän paikka vaihtelee


Rakenne- eli konstituutioisomeria
3) Funktioisomeria
- molekyyleissä eri funktionaaliset ryhmät
- ominaisuudet poikkeavat merkittävästi!

Avaruus- eli stereoisomeria
1) Cis-trans-isomeria
- esiintyy yhdisteillä, joissa on kaksoissidos tai rengasrakenne
- kaksoissidos on "jäykkä", joten atomit / atomiryhmät eivät pääse kiertymään sen ympäri
- cis-muoto
- atomiryhmät samalla puolella kaksoissidosta tai rengasta
- trans-muoto
- atomiryhmät eri puolilla kaksoissidosta tai rengasta



E/Z-Isomeria
- kaksoissidokseen on liittynyt kolme tai neljä erilaista atomia tai atomiryhmää
-
E/Z-muotojen nimeäminen tapahtuu atomimassojen perusteella
- (E)-isomeereissä kevyemmät kaksoissidoksen hiiliatomeihin liittyneet atomit ovat eri puolilla kaksoissidosta
- (Z)-isomeereissä samalla puolella
trans
cis
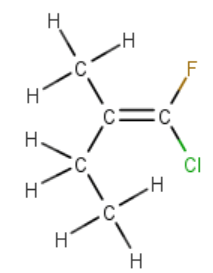
Vasen puoli:
\(\mathrm{M(CH_3)}=15{,}034\text{ g/mol}\)
\(\mathrm{M(CH_2CH_3)}=29{,}06\text{ g/mol}\)
Oikea puoli:
\(\mathrm{M(F)}=19{,}004\text{ g/mol}\)
\(\mathrm{M(Cl)}=35{,}45\text{ g/mol}\)
(Z)-1-fluori-1-kloori-2-metyylibut-1-eeni
Avaruus- eli stereoisomeria
2) Enantiomeria eli peilikuvaisomeria
-
esiintyy yhdisteillä, joilla on asymmetrinen hiiliatomi eli kiraliakeskus
- kiraliakeskus = hiiliatomi, johon on liittynyt 4 erilaista ryhmää
- merkitään tähdellä *
- optiset isomeerit ovat toistensa peilikuvia

- raseeminen seos = seos, joka sisältää jonkin yhdisteen molempia optisia isomeerejä yhtä paljon
Avaruus- eli stereoisomeria
3) Konformaatioisomeria
-
hiiliketjuun liittyneet ryhmät pääsevät kiertymään yksinkertaisen sidoksen ympäri
- molekyylien asento on erilainen

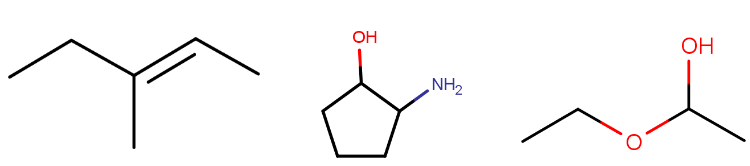
Mitä stereoisomerian lajeja molekyylillä on?
Yhdiste A
Yhdiste B
Yhdiste C
cis-transisomeria
etyyli- ja metyyliryhmät eri puolilla kaksoissidosta
kaksoissidos
trans-isomeeri
rengas
ei kiralisia hiiliä
yhdisteellä voi esiintyä cis-trans-isomeriaa, mutta molekyylistä ei voi nähdä, kumpi isomeeri on kyseessä
ei cis-trans-isomeriaa
enantiomeria
enantiomeria
kaikilla yksinkertaisia sidoksia \(\rightarrow\) kaikilla konformaatioisomeriaa
Isomeria MarvinSketchilla
Nimeäminen
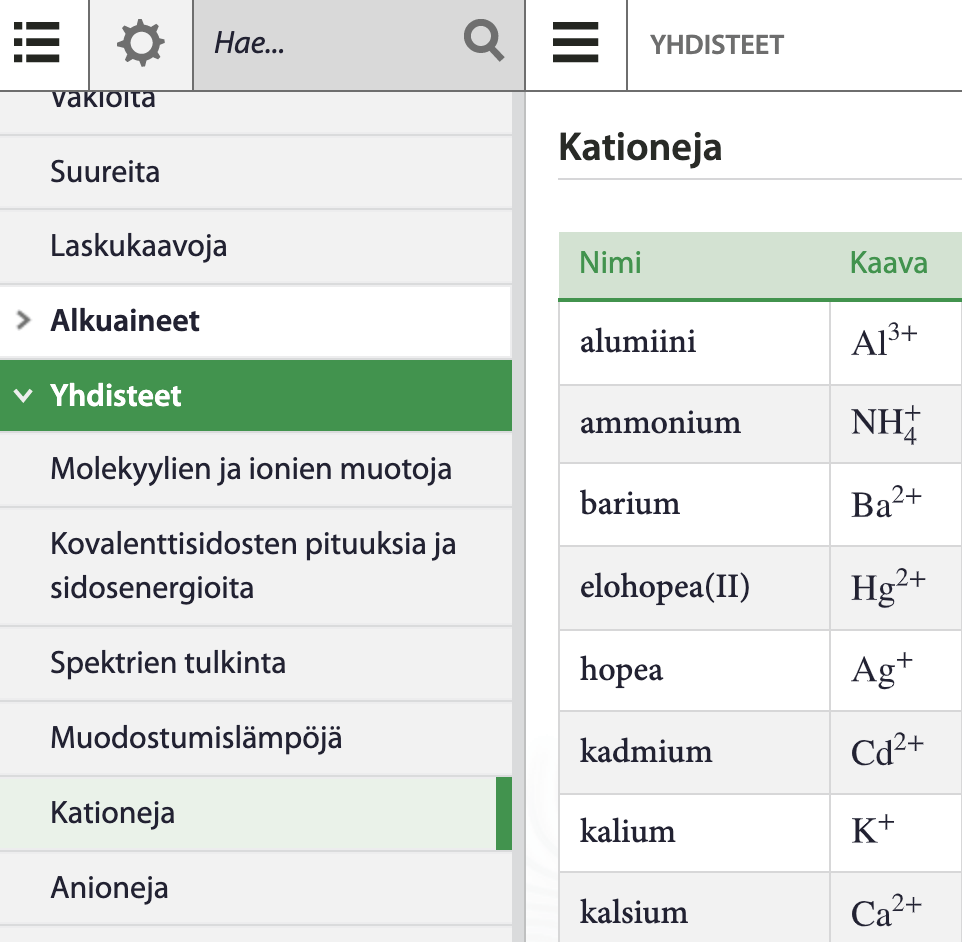
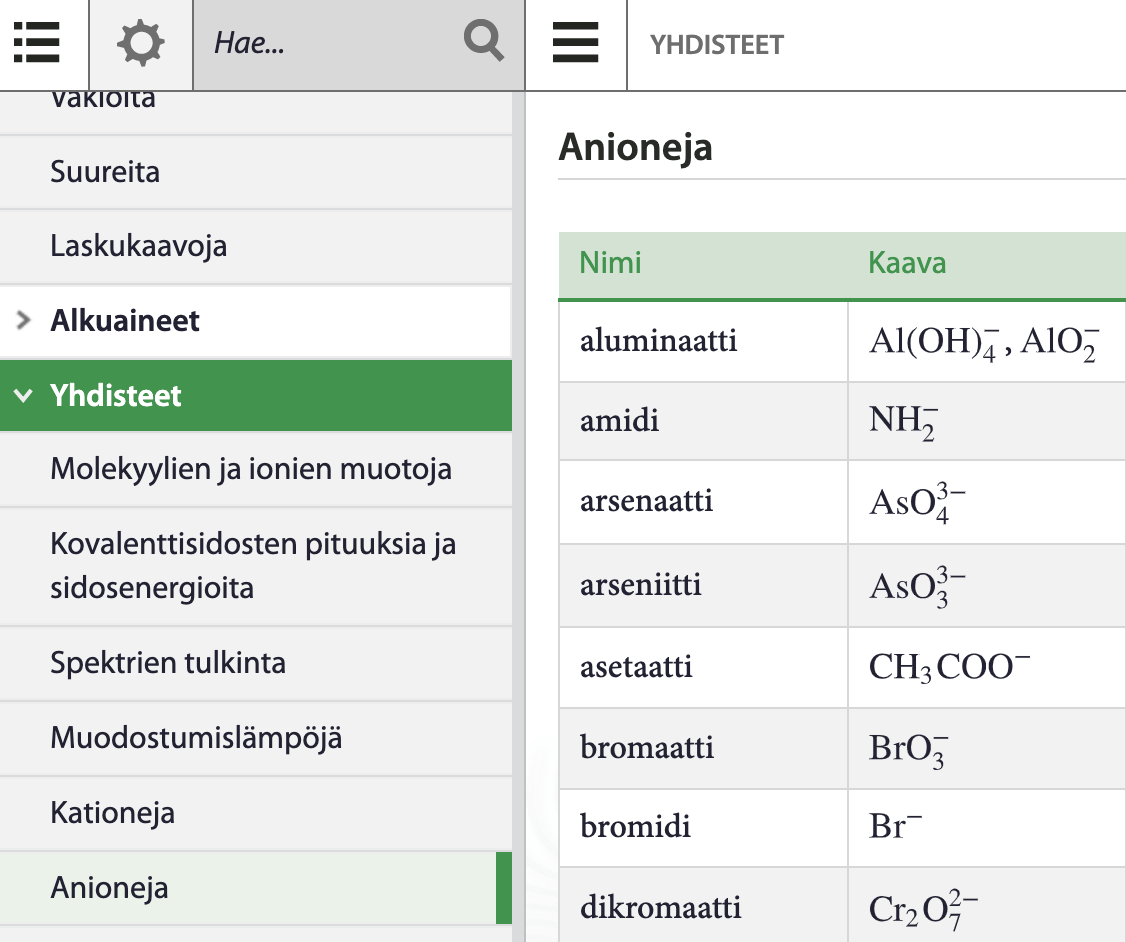
Ionin nimen ja varauksen voi tarkistaa MAOLista
Molekyyliyhdisteen kaava ja nimi
- alkuaineet merkitään yleensä elektronegatiivisuusjärjestyksessä pienimmästä suurimpaan
- nimen alkuosa tulee ensimmäiseksi merkitystä alkuaineesta, loppuosalle -idi-pääte
- atomien lukumäärä ilmaistaan etuliitteillä
- etuliitteitä ei tarvita, jos aineiden välisiä yhdisteitä on olemassa vain yksi
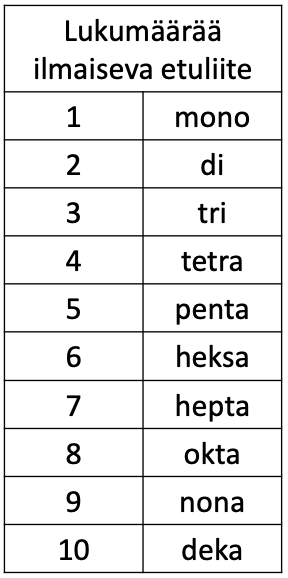
typpimonoksidi
dityppioksidi
typpidioksidi
dityppipentoksidi
CO
\(\mathrm{H_2S}\)
\(\mathrm{P_4O_{10}}\)
\(\mathrm{H_2O}\)
NO
hiilimonoksidi
divetysulfidi
tetrafosforidekaoksidi
divetyoksidi
Orgaanisten yhdisteiden nimeäminen
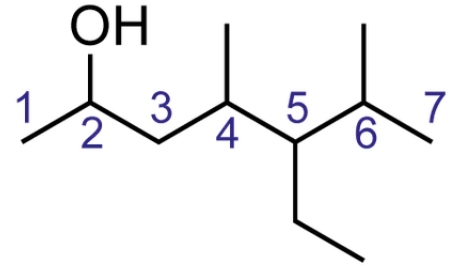
1
2
3
4
5
6
7
Kuinka monta hiiltä pisimmässä hiiliketjussa?
\(\rightarrow\) hept-
Onko yhdisteessä funktionaalista ryhmää?
\(\rightarrow\) alkoholi
\(\rightarrow\) -oli-pääte
Onko sivuketjuja?
heptan-
2-oli
Missä hiilessä?
Missä hiilessä?
1 hiili
\(\rightarrow\) metyyli-
2 hiili
\(\rightarrow\) etyyli-
Kirjoitetaan aakkosjärjestyksessä!
5-etyyli-
4,6-dimetyyli
2 kappaletta
\(\rightarrow\) di
Sähkökemia
Hapettuminen ja pelkistyminen
- Hapettuminen on elektronien luovuttamista
- hapetusluku kasvaa
- Pelkistyminen on elektronien luovuttamista
- hapetusluku pienenee
- Hapetus-pelkistysreaktiossa yksi alkuaine hapettuu ja toinen pelkistyy
- yhden alkuaineen hapetusluku pienenee, yhden alkuaineen hapetusluku kasvaa
Tyypillisiä virheitä
- veden hapettumis- ja pelkistymisreaktiot luetaan taulukkokirjassa väärältä riviltä tai väärään suuntaan
- veden reaktiot löytyvät kahdelta eri riviltä eli hapettumiseen ja pelkistymiseen valitaan eri rivien reaktioyhtälöt

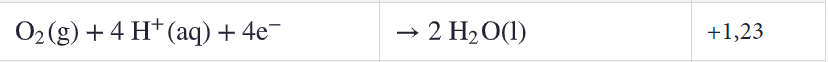
Hapettuminen
Pelkistyminen
- elektronit tuotteissa
- elektronit lähtöaineissa
Tyypillisiä virheitä
- taulukkokirjasta luetaan hapettumis- pelkistymisreaktio väärään suuntaan
- jos kuparia on lähtötilanteessa kiinteänä eli metallisena, sitä ei ole ionimuodossa (liuoksena), eikä tällöin kuparin pelkistymisreaktio ole mahdollinen
- anodi ja katodi tai positiivinen ja negatiivinen elektrodi merkitään väärinpäin
- anodi on kemiallisessa parissa negatiivinen elektrodi ja elektrolyysissa positiivinen elektrodi
Tyypillisiä virheitä
- varauksenkuljettajat sekoitetaan
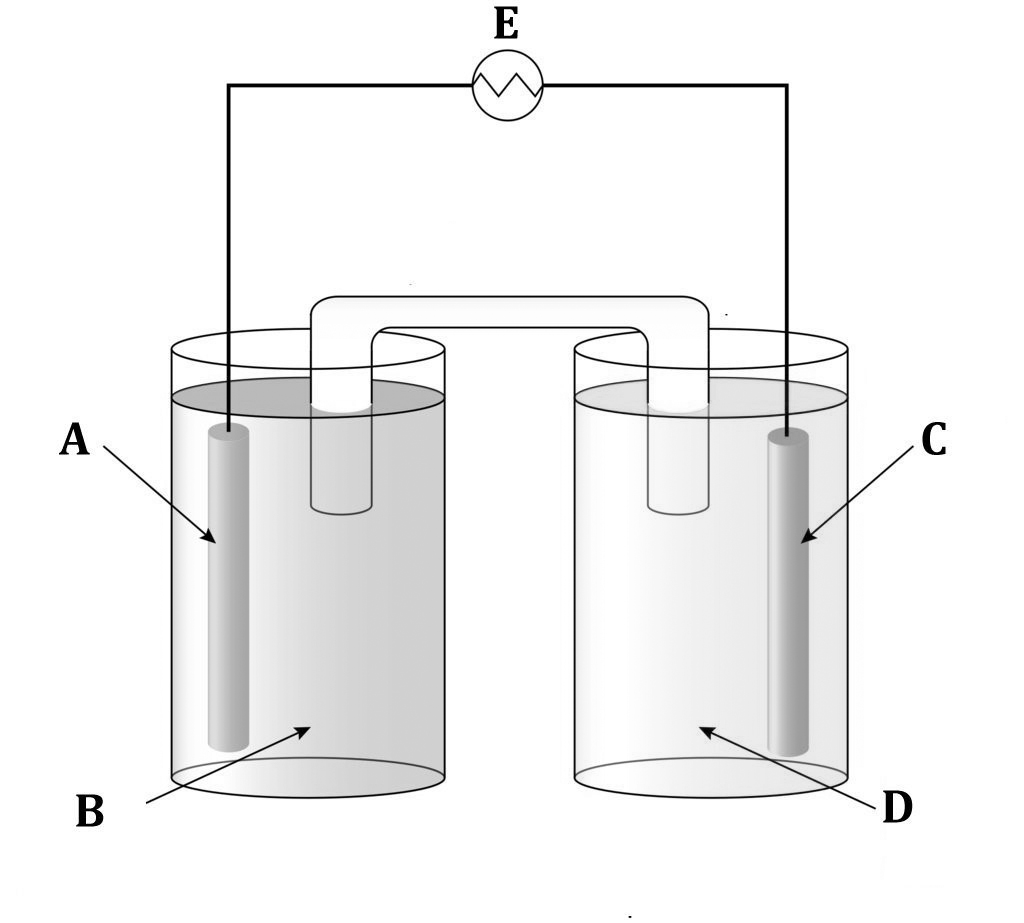
"elektronit kulkevat suolasiltaa pitkin"
"elektronit liikkuvat elektrolyyttiliuoksessa"
"ionit liikkuvat johtimissa"
Todellisuudessa suolasillassa siirtyy ioneja molempiin liuoksiin tasaamaan niihin muodostuvaa varausepätasapainoa
- suolasulatteelle käytetään virheellistä olomuotomerkintää
- taulukkokirjassa puolireaktioissa olomuotomerkintä aq, kun suolasulatteessa l.
a) Kaliumia voidaan valmistaa kaliumfluorisulatteen elektrolyysillä. Kuinka monta kilogrammaa kaliumia voidaan tuottaa 24 tunnissa 100,0 ampeerin sähkövirralla?
Esimerkki
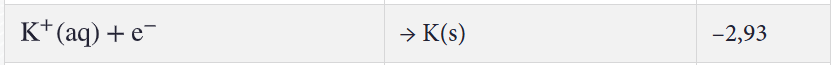
Ratkaisu:
Väärä olomuoto, ei kannata liittää ratkaisuun reaktioyhtälöä suoraan Standardipotentiaaleja -taulukosta!
voi päätellä ajan yksikön!
sijoitetaan arvot suureyhtälöön
b) Sähkökemiallisen parin kennokaavio on
Co(s) | \(\mathrm{CoSO_4(aq)}\) || \(\mathrm{AgNO_3(s)(aq)}\)| Ag(s)
Mikä on parin jännite?
c) Muodosta kokonaisreaktio. Päättele ja perustele, onko kyseessä spontaani reaktio. Minkälaisesta sähkökemiallisesta systeemistä on kyse?
Hapettuminen:
\(\mathrm{2\ Fe(s)\rightarrow 2\ Fe^{2+}(aq)+4\ e^-, E^\circ=0{,}45\ V}\)
Pelkistyminen:
\(\mathrm{O_2(g)+2\ H_2O(l)+4\ e^-\rightarrow 4\ OH^-(aq), E^\circ=0{,}40\ V}\)
d) Päättele seuraavaan reaktioon osallistuvien alkuaineiden hapetusluvut sekä tunnista hapetin ja pelkistin.
Energia
Entalpiamuutokset
- \(\Delta H<0\ \rightarrow\) eksoterminen reaktio
- energiaa vapautuu
- lämpötila kasvaa
- \(\Delta H>0\ \rightarrow\) endoterminen reaktio
- energiaa sitoutuu
- lämpötila laskee
Hessin laki
- eri reaktioiden entalpian muutokset voidaan laskea osareaktioiden summan avulla: \(\Delta H_3=\Delta H_1+\Delta H_2\)

Jos tehtävässä ei ole annettu valmiiksi entalpiamuutoksia, voidaan hyödyntää muodostumislämpöjä.
Entalpiamuutos voidaan määrittää myös sidosenergioiden avulla. Sidoksen katkeaminen vaatii energiaa (endoterminen vaihe) ja muodostuminen vapauttaa sitä (eksoterminen vaihe)!
Reaktioentalpia
Entalpiamuutoksen mittaaminen
- onnistuu kalorimetrillä
- jos kalorimetrissä on vettä ja reaktion seurauksena lämpötila muuttuu:
\(c=\) veden ominaislämpökapasiteetti (4,19 \(\mathrm{\frac{kJ}{kg\cdot K}}\))
\(m=\) veden massa
\(\Delta T=\) lämpötilan muutos
ei siis konsentraatio!
8.2/S2022
Eräässä laboratoriokokeessa 24,0 g puhdasta hiiltä C(s) paloi olosuhteissa, joissa happea oli vain rajallinen määrä. Tällöin energiaa vapautui 481,2 kJ. Palamisessa tapahtuivat samanaikaisesti reaktiot (1) ja (2):

Laske tuotteina muodostuneiden hiilimonoksidin ja hiilidioksidin ainemäärät.
4/S2020
Tutkimuksessa määritettiin kokeellisesti metanolin, formaldehydin ja vedyn palamisentalpiat tietyssä lämpötilassa ja saatiin seuraavat tulokset:
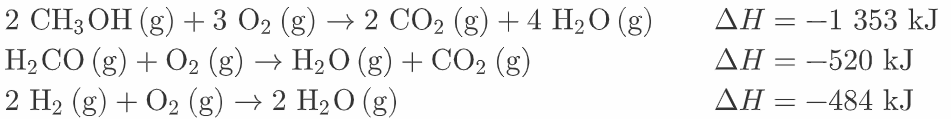
4.1 Polttokennoautoissa voidaan käyttää polttoaineena vetyä tai metanolia. Vetyä ja metanolia poltetaan kumpaakin 1,00 kg. Kummassa palamisreaktiossa vapautuu enemmän energiaa?
4.2 Metanolista voidaan valmistaa formaldehydiä, jota käytetään monien yhdisteiden lähtöaineena:
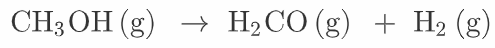
Määritä reaktioentalpia \(\Delta H_r\) annettujen kokeellisten palamisentalpioiden avulla.
Tasapaino
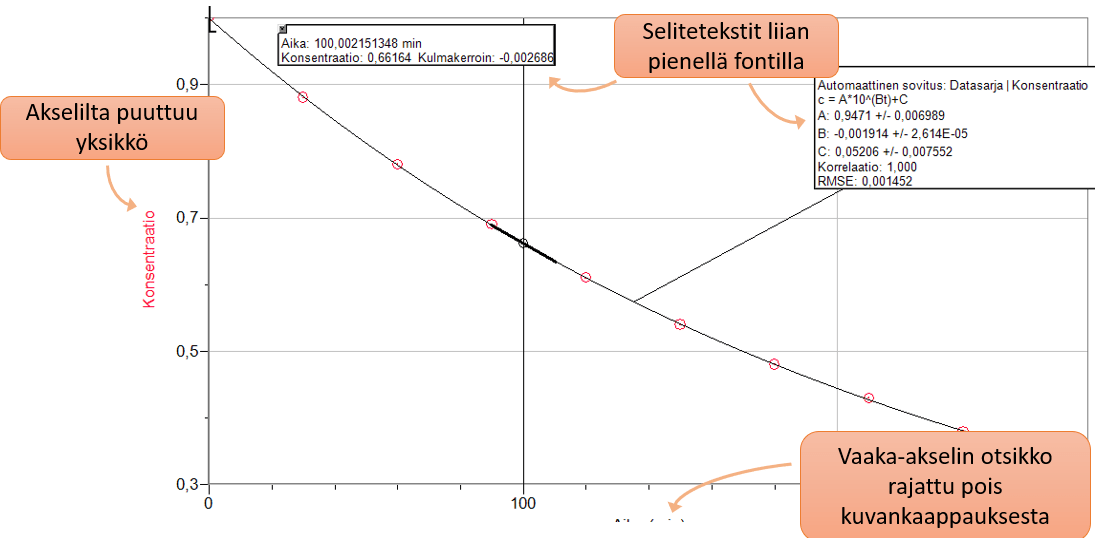
Tyypillisiä virheitä: Kuvaajien piirtäminen
- Ei mainita, mistä lukuarvot tulevat. \(\rightarrow\) "Arvo luettiin kuvaajalta."
Tyypillisiä virheitä: Tasapainolaskut
- pH-arvon merkitsevät numerot
- pH:ssa merkitseviä numeroita desimaalipilkun jälkeiset numerot
- Laskinohjelmassa liian epätarkka numerotarkkuus
- välitulosta ei kannata pyöristää, sillä liiallisesta pyöristyksestä voi tulla virheitä lopputulokseen
- Tasapainovakion lauseketta ei ole merkitty näkyviin ennen sijoitusta
- Tasapainotaulukossa ei ole huomioitu reaktioyhtälön kertoimia
- Tasapainovakion lausekkeessa ei ole huomioitu reaktioyhtälön kertoimia eksponenteissa
- Neutraloitumisreaktiossa tasapainonuoli
- neutraloituminen ei ole koskaan tasapainoreaktio, vaikka aineet olisivat heikkoja protolyyttejä