Elektroneja ja sidoksia
KE3: Molekyylit ja mallit 3/5
Orbitaalit
Keskeiset asiat:
-
orbitaali
-
pää- ja alakuoret
-
Paulin kieltosääntö
-
Hundin sääntö
-
elektronikuorien täyttyminen
-
elektronikonfiguraatio
-
ionisoitumisenergia
Sidos 3: Luku 7
Tuntitehtävä: Piirrä atomimalli.
a) Muistele, millainen on atomi. Mallinna atomimalli piirtämällä ja palauta se kuvana tähän. Voit mallintaa mallin koneella tai paperille.
b) Vertaa piirtämääsi atomimallia muiden ryhmäläistesi atomimalleihin. Voisiko atomimalliasi kehittää jotenkin?
KE1KE2-opintojakson atomimallit:
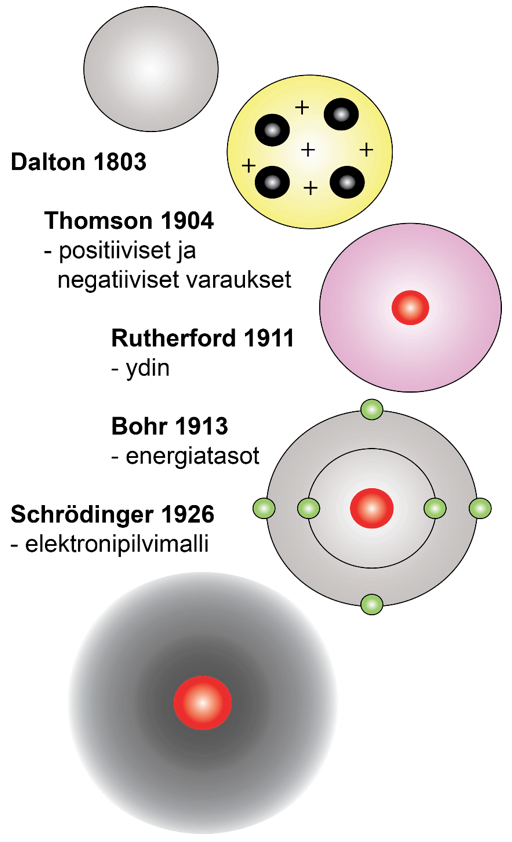
Atomimallin historiaa
- Atomin käsitteen otti käyttöön John Dalton
- Joseph Thomson löysi elektronin – atomi on sähköisesti neutraali, koostuu kuitenkin + ja - merkkisesti varautuneista hiukkasista. (rusinapullamalliksi)
- Ernest Rutherford päätteli sirontakokeen jälkeen ytimen muodostavan valtaosan atomin massasta
- Niels Bohr ehdotti, että elektronit kiertävät ydintä ellipsin muotoisilla kiertoradoilla eri energiatasoilla
- James Chadwick päätteli, että atomin ydin koostuu positiivisesta varatuista protoneista ja varauksettomista neutroneista
- Kvanttimekaanisen atomimallin mukaan elektronit eivät kierrä ydintä radoilla vaan muodostavat elektronipilven

Kvanttimekaaninen atomimalli
- Elektroni on delokalisoitunut eli sillä ei ole tiettyä paikkaa
- Elektroni on todennäköisimmin tietyllä alueella atomiytimen ympärillä
\(\rightarrow\) alue on nimeltään orbitaali
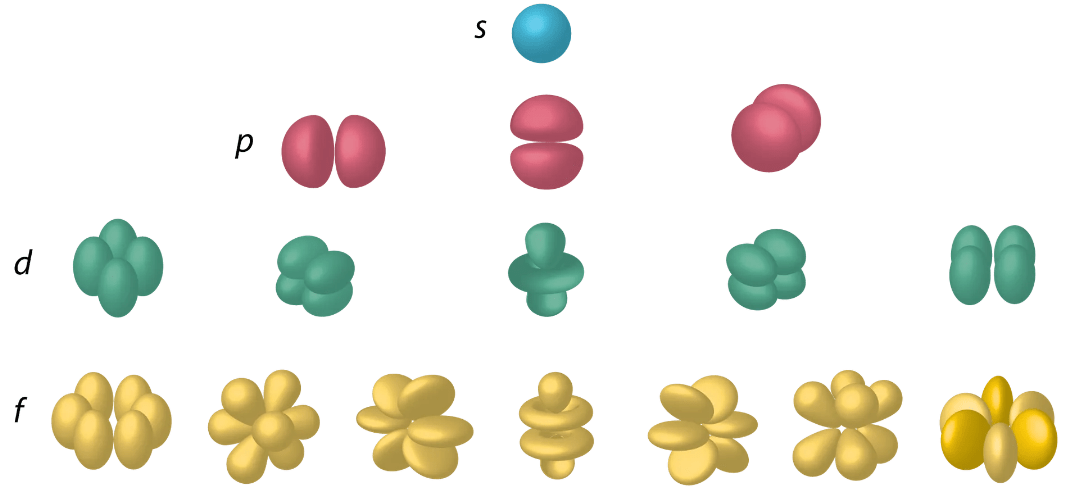
Eri orbitaalit ovat erimuotoisia!
Kvanttimekaaninen atomimalli
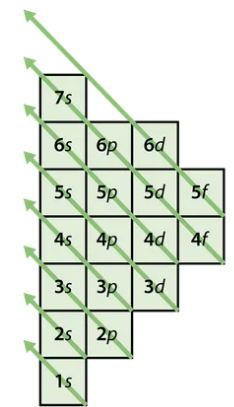
atomiorbitaali
- se avaruuden osa, jossa elektroni todennäköisimmin esiintyy
- jokaiselle orbitaalille mahtuu kaksi elektronia
- kaikilla saman pääkuoren elektroneilla lähes sama energia
- mitä suurempi pääkuoren numero n, sitä kauempana atomin ytimestä
1
2
3
1s
2s
3s
2p
3p
3d
alakuori
- samalla pääkuorella olevat "samannimiset" atomiorbitaalit
- esim. 2s / 2p / 3d
pääkuori
energia
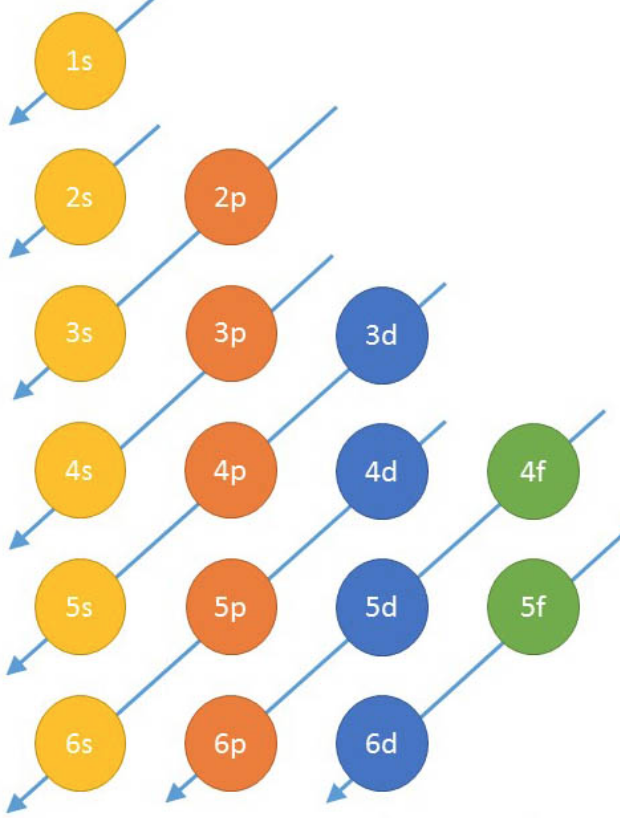
Elektronirakenteen kirjoittaminen
- Minimienergiaperiaate: Elektroni asettuu aina atomin energialtaan alimmalle orbitaalille.
- Hundin sääntö: orbitaaleille, joilla on sama energia, asettuu aina ensin vain yksi elektroni.
- Paulin kieltosääntö: Samalle orbitaalille ei voi asettua enempää kuin kaksi elektronia.
Esimerkki
Kirjoita koboltin elektronikonfiguraatio.
\(\mathrm{_{27}^{ }Co}\)
energia
1s: 2 kpl
2s: 2 kpl
Jäljellä:
27-2=25
25-2=23
2p: 6 kpl
23-6=17
3s: 2 kpl
17-2=15
3p: 6 kpl
15-6=9
3d: 7 kpl
\(1s^22s^22p^63s^23p^64s^23d^7\)
4s: 2 kpl
9-2=7
Hybridisaatio
Keskeiset asiat:
-
sidosorbitaali
-
\(\mathrm{sp^3}\)-hybridisaatio
-
\(\mathrm{sp^2}\)-hybridisaatio
-
sp-hybridisaatio
-
sigmasidos ja piisidos
Sidos 3: Luku 8
Kovalenttisen sidoksen muodostuminen
- Kovalenttinen sidos muodostuu, kun kahdella atomilla on yhteinen elektronipari.
- Sidokseen osallistuvien elektronien atomiorbitaalit sulautuvat yhteen sidosorbitaaliksi.
sigmasidos
\(\sigma\)-sidos
sidosorbitaali
= yksinkertainen kovalenttinen sidos
Hiilen sitoutuminen
\(2s\)
\(2p_x\)
\(2p_y\)
\(2p_z\)
- Hiili muodostaa neljä samanlaista sidosta

\(\rightarrow\) elektronit eivät voi olla erilaisilla orbitaaleilla
- Hiilen elektronirakenne:
elektronipari
\(\rightarrow\) eivät muodosta sidosta
kaksi paritonta elektronia
\(\rightarrow\) muodostaisi vain kaksi yksinkertaista sidosta
\(2s\)
\(2p_x\)
\(2p_y\)
\(2p_z\)
\(\rightarrow\) atomiorbitaalit muuntuvat keskenään samanlaisiksi hybridiorbitaaleiksi
\(2sp^3\)
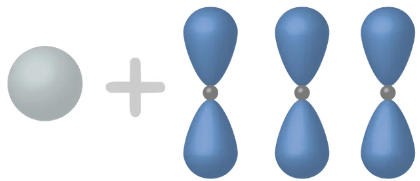

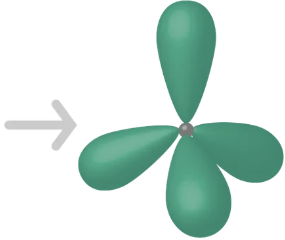
\(\mathrm{sp^3}\)-hybridisaatio
\(2s\)
\(2p_x\)
\(2p_y\)
\(2p_z\)
\(2sp^2\)
Kaksoissidoksen muodostuminen
\(2p_z\)
\(\mathrm{sp^2}\)-hybridisaatio
- kolme atomiorbitaalia hybridisoituu ja yksi p-orbitaali jää hybridisoitumatta
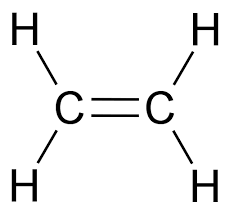

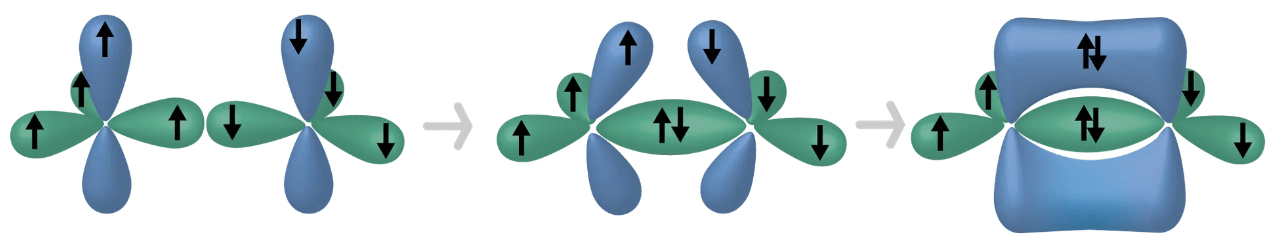
sigmasidos
piisidos
(\(\pi\)-sidos)
- hybridisoitumattomat p-orbitaalit sulautuvat yhteen
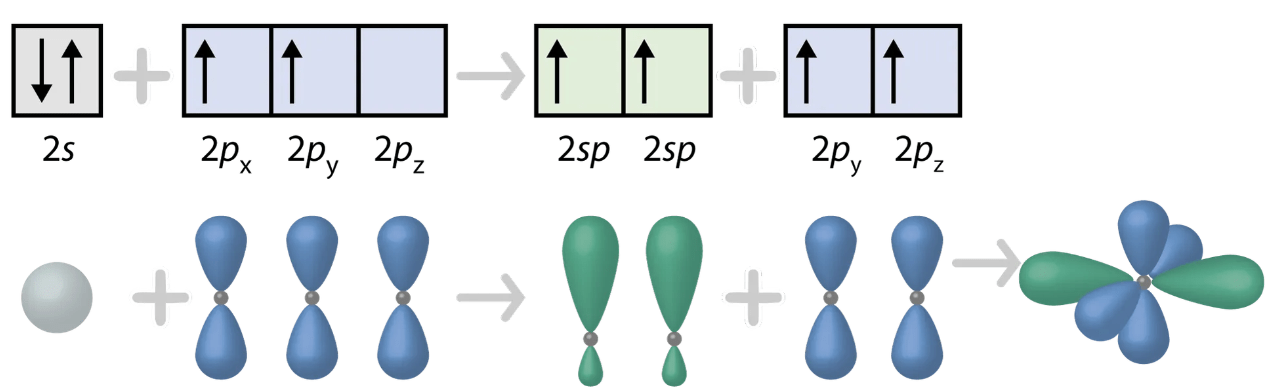
\(\mathrm{sp}\)-hybridisaatio
- kaksi atomiorbitaalia hybridisoituu ja kaksi p-orbitaalia jää hybridisoitumatta
Kolmoissidoksen muodostuminen

sigmasidos
2 piisidosta
Molekyylin muoto
Keskeiset asiat:
-
vapaa elektronipari
-
molekyylin muoto
-
sidoskulma
Sidos 3: Luku 9
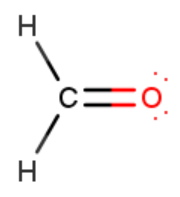
Lewisin kaava



- kuvaa atomin elektronien jakautumista vapaisiin ja sidoselektronipareihin
happimolekyyli \(\mathrm{O_2}\)
vesimolekyyli \(\mathrm{H_2O}\)
vetysyanidimolekyyli HCN
vapaa elektronipari
= atomin uloimman kuoren elektronipari, joka ei osallistu sidoksen muodostamiseen
Tutustukaa simulaation avulla molekyylin muodon määrittämiseen VSEPR-teoriassa. Pyrkikää selvittämään vastaukset seuraaviin kysymyksiin:
Tuntitehtävä
- Mikä näyttäisi olevan perusohje siihen, miten ryhmät (= yksinkertaisella, kaksois- tai kolmoissidoksella sitoutuneet atomit tai vapaat elektroniparit) järjestäytyvät?
- Mikä on suurin ero vapaiden elektroniparien ja muiden ryhmien sitoutumisessa?
- Miten vapaat elektroniparit vaikuttavat molekyylin muotoon?
- Miten ryhmien määrä vaikuttaa molekyylin muotoon?
- Minkämuotoisia molekyylejä pystytään muodostamaan? Miten nämä muodot voidaan nimetä?
- Mikä vaikuttaa sidoskulmiin?
Tutustukaa simulaatioon ja varmistakaa, että koko ryhmä ymmärtää, miten VSEPR-teoria toimii.
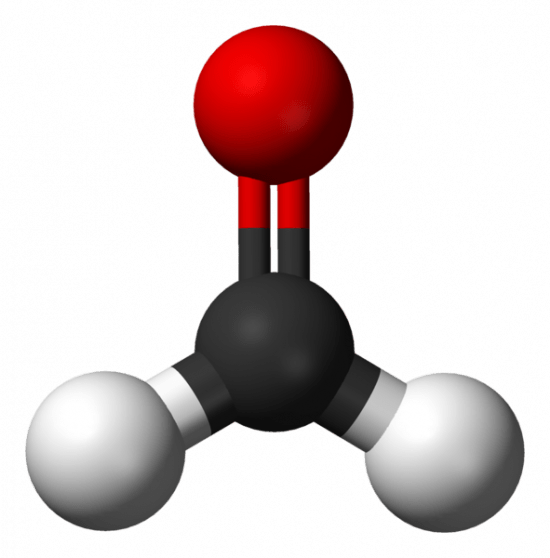

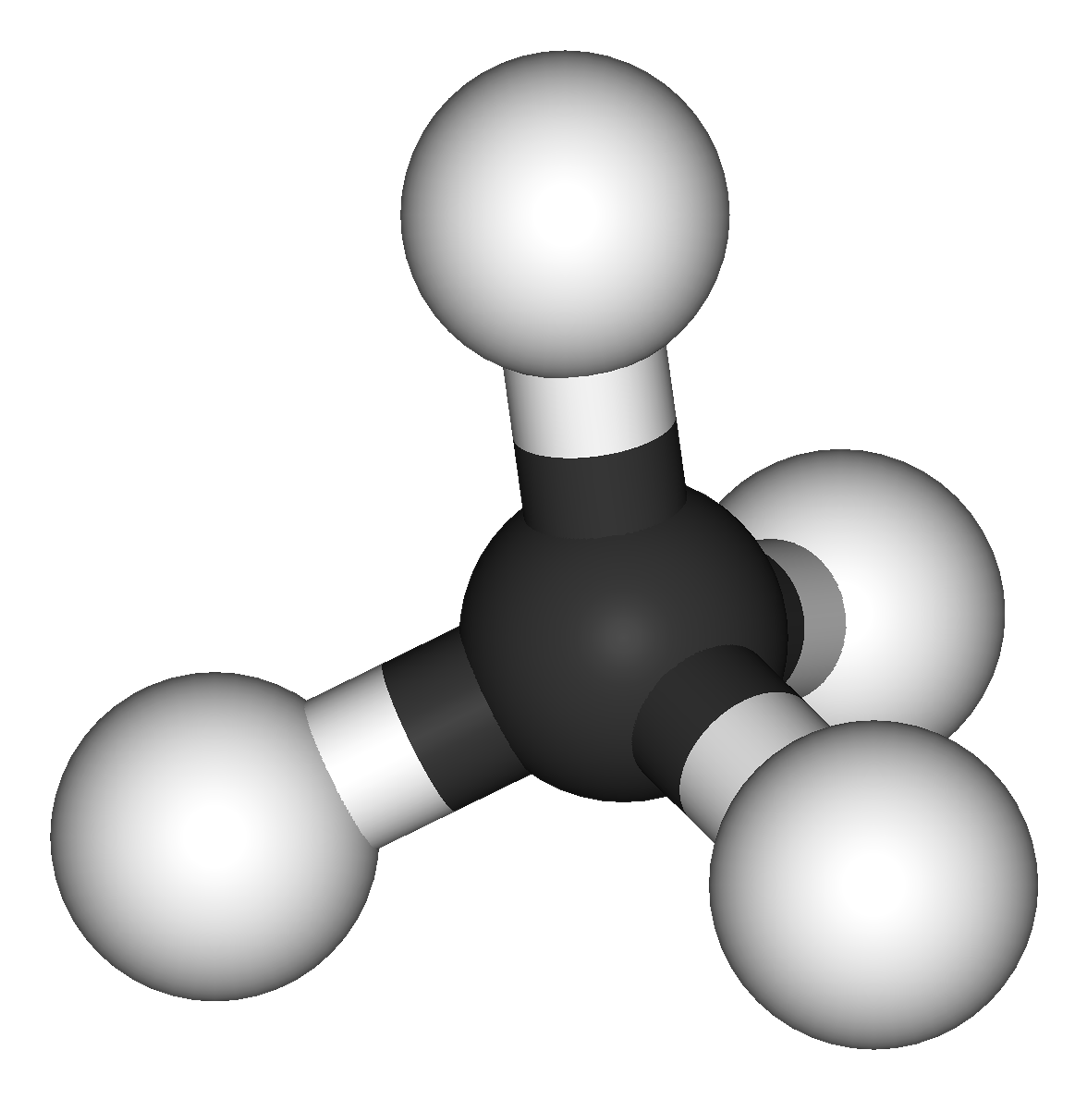
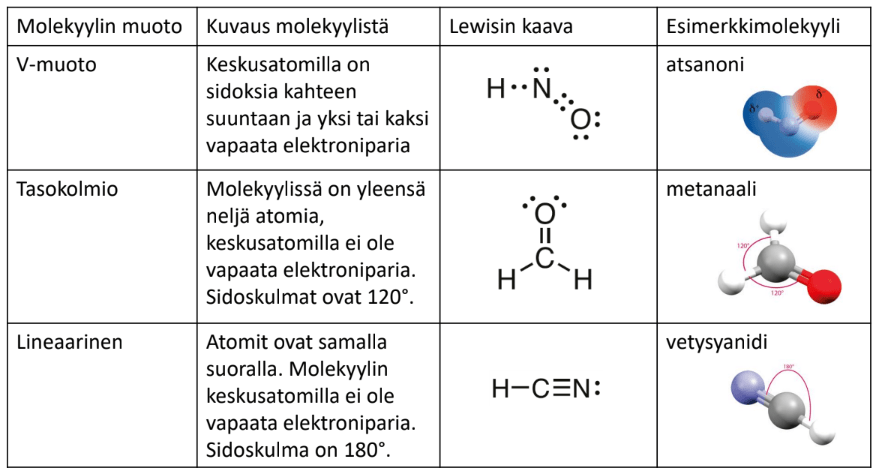
Molekyylin muoto
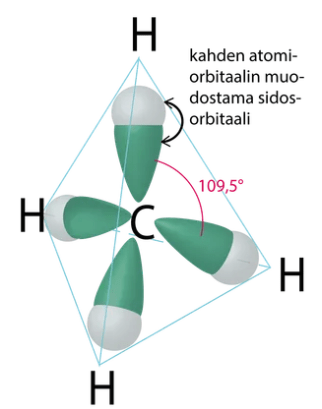
- Molekyylien perusmuodot:
tetraedri
tasokolmio
lineaarinen
\(109,\!5^\circ\)
\(120^\circ\)
\(180^\circ\)
liittynyt neljä atomia tai atomiryhmää
liittynyt kolme atomia tai atomiryhmää
liittynyt kaksi atomia tai atomiryhmää

Minkä muotoinen on
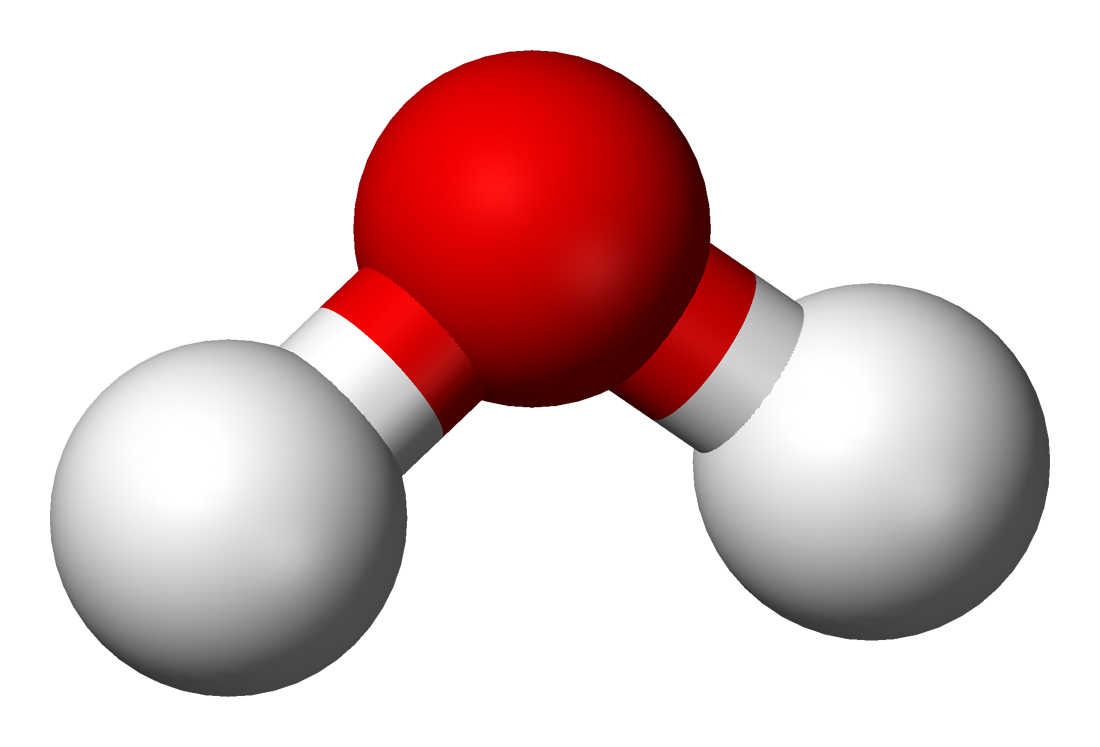
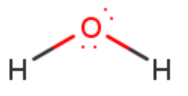
vesimolekyyli \(\mathrm{H_2O}\)?
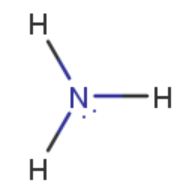
ammoniakkimolekyyli \(\mathrm{NH_3}\)?
- keskusatomi: happi
- liittynyt: 2 x vety
hypoteesi:
- keskusatomi: typpi
- liittynyt: 3 x vety
hypoteesi:
lineaarinen
tasokolmio
vapaat elektroniparit vievät enemmän tilaa kuin sidoselektroniparit
\(\rightarrow\) sidokset taipuvat
\(\rightarrow\) sidoskulmat ovat pienemmät kuin perusmuodon mukaan voisi olettaa
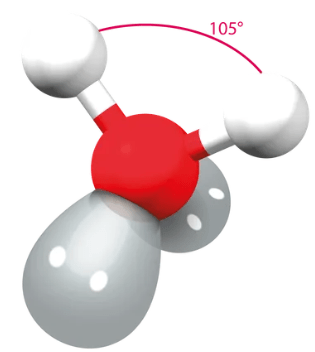
2 vapaata elektroniparia
asetetaan 4 "ryhmää" tetraedrin kärkiin
\(\rightarrow\) V-muoto
1 vapaa elektronipari
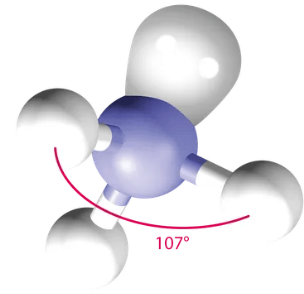
asetetaan 4 "ryhmää" tetraedrin kärkiin
\(\rightarrow\) kolmiopohjainen pyramidi
Ulkokuoren elektroniparien repulsioteorian avulla voidaan ennustaa molekyylin muotoa. Perusajatuksena on, että
- kovalenttisen sidoksen muodostuessa atomiorbitaalit osuvat toisiinsa ja menevät osittain päällekkäin, koska ulkoelektronit pariutuvat
- muodostuneet sidokset suuntautuvat avaruudessa mahdollisimman kauas toisistaan, koska sidoselektronit hylkivät toisaan (repulsio)
- jos keskusatomille jää vapaita elektronipareja, ne vaikuttavat molekyylin muotoon.
VSEPR-teoria
(Valence shell electron pair repulsion theory)
Molekyylin muoto vaikuttaa myös molekyylin ominaisuuksiin!
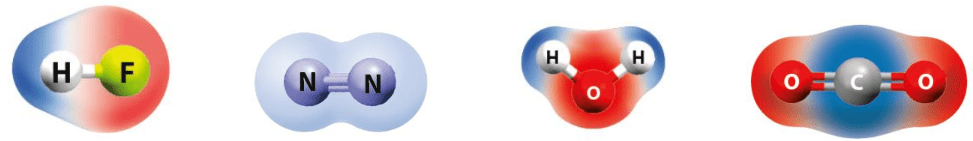
Molekyylien muotoja
Molekyylien muotoja
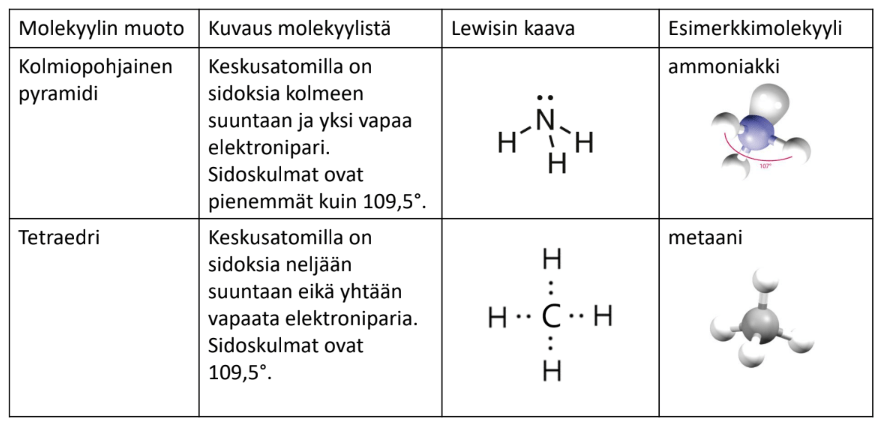
Muotoja on muitakin ja niitä on listattu esimerkkeineen MAOLiin
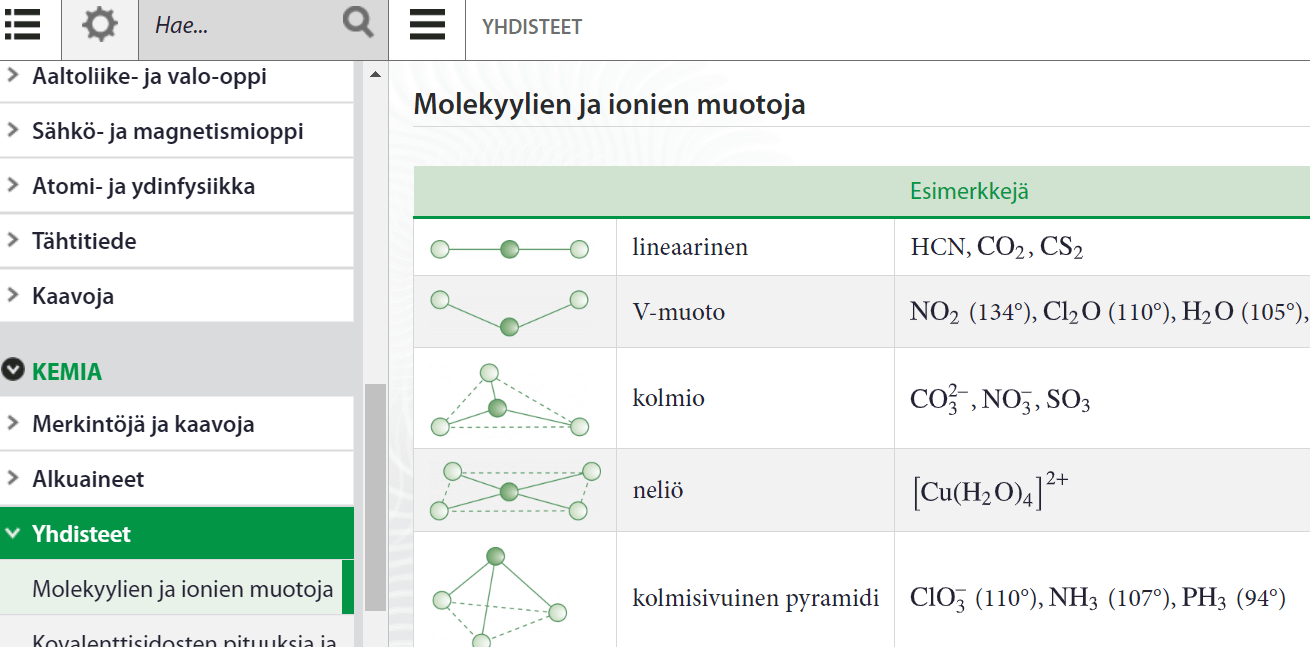
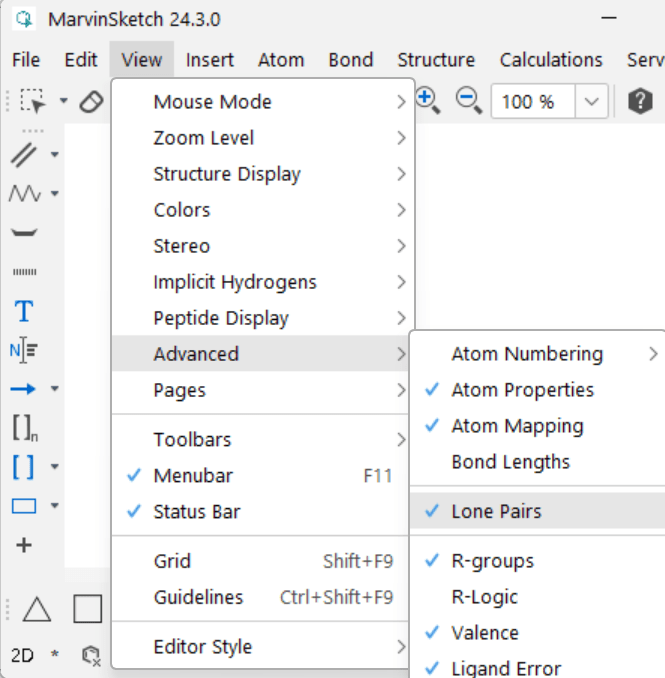
Vapaat elektroniparit näkyviin MarvinSketchillä: