Kemian kertaus
KE07: Kemian kertaus
Kemian ylioppilaskoe ja siihen valmistautuminen
Kemian ylioppilaskokeen rakenne
Osio I (MONIVALINTA)
- 10 kohtaa, jokaisesta 2 pistettä
- osan voi päätellä nopeasti kemian perustiedoilla, osassa on laskettava tai pohdittava pidempään
Osio II (15 pisteen tehtävät)
- tehdään neljä tehtävää seitsemästä
- tehtävät käsittelevät kemian perusasioita ja jonkin verran niiden soveltamista
Osio III (20 pisteen tehtävät)
- tehdään kaksi tehtävää kolmesta
- jokainen tehtävä on 20 pisteen arvoinen
- työläämpiä ja soveltavampia kuin osan II tehtävät
- voivat sisältää myös aineistoja, joiden pohjalta on omaksuttava uutta teoriaa

- Yksi kemian YO-tehtävä käsittelee tyypillisesti aiheita useista kemian osa-alueista eri moduuleista.
- Osatehtävät ovat usein erilaisia. Sama tehtävä voi esimerkiksi sisältää reaktioyhtälön kirjoittamista, laskun ja selitystä.
- Keskeisiä käsitteitä ja sisältöjä sovelletaan vastauksessa eikä niinkään kysytä suoraan.
- Kaikissa tehtävissä on sekä helppoja että vaikeita asioita eri osatehtävissä
-
Suositus:
- Harjoittele kokeeseen valmistautuessasi erilaisten tehtävien tekemistä.
- Vastaa joka tapauksessa kaikkiin seitsemään tehtävään, koska kaikissa tehtävissä on helpompia osuuksia, joista voi saada helpommin pisteitä.
Kemian YO-kokeesta
Kokeeseen valmistautuminen
- Opiskele ahkerasti, mutta muista myös nukkua riittävästi ja rentoutua välillä.
- Tee realistinen lukusuunnitelma, joka on mahdollista toteuttaa.
-
Tehtävien tekeminen on tärkeämpää kuin pelkkä teorian lukeminen.
-
Tee tehtäviä Mafynetistä:
-
Kun aloitat jotakin aihepiiriä, katso ensin aiheen Tavoitetehtävät. Jos osaat tehdä ne suoraan, riittää todennäköisesti, että vain silmäilet osion "harjoitustehtävät".
-
Voit tehdä tehtäviä myös keskustellen kaverin kanssa, jos se sopii tehtävän luonteeseen.
-
-
Tee palautettavat tehtävät huijaamatta. Muista, että opiskelet itseäsi varten!
-
Tee tehtäviä Mafynetistä:
Kokeeseen valmistautuminen
-
Kiinnitä huomiota ohjelmistojen käyttöön ja käyttämiisi merkintöihin. Tee jokainen tehtävä kuin se olisi YO-kokeen tehtävä!
-
Hyödynnä moduulien KE1–KE6 oppikirjoja.
-
Käy läpi käsitelistat oppikirjojen liitteistä.
-
Käy läpi kokeellisia töitä esim. videoiden avulla.
-
-
Tutustu aiempien vuosien YO-kokeisiin.
-
Käy läpi taulukkokirja, jotta tiedät, mitä tietoa sieltä löytyy.
-
Kertaa ohjelmistojen käyttöä.
-
Kysy tarvittaessa apua!
Hyvän vastauksen rakentaminen
Hyvän vastauksen piirteet
-
Vastauksissa hyödynnetään kemialle tyypillistä esitystapaa sekä kemian käsitteiden ja termien oikeaa ja täsmällistä käyttöä.
-
Reaktioyhtälöt esitetään ilman hapetuslukuja käyttäen pienimpiä mahdollisia kokonaislukukertoimia ja olomuotoja.
-
Orgaanisten yhdisteiden reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei vaadita. Jos ne on tehtävässä annettu, kopioidaan ne myös vastaukseen.
-
Rakennekaavojen eri esitystavat hyväksytään.
-
-
Essee- ja selitystehtävissä vastauksen tulee sisältää kirjoitettua tekstiä, jota täydennetään reaktioyhtälöillä, kaavoilla tai kuvioilla.
-
Ilmiöitä selitetään sanallisesti makroskooppisella, mikroskooppisella ja symbolisella tasolla.
-
Kun vastauksessa edellytetään tehtävään liittyvän aineiston hyödyntämistä, soveltamista tai analysointia, hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Hyvän vastauksen piirteitä
- Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa, että vastaaja on ymmärtänyt tehtävänannon oikein ja osaa soveltaa ratkaisussaan asianmukaista periaatetta tai lakia.
- Vastauksesta tulee ilmetä, kuinka lopputulokseen on päädytty, mutta laajoja välivaiheita ei tarvitse esittää.
- Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
- Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä.
- Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten ekvivalenttikohta titrauskäyrässä tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
- Mittauspisteisiin sovitetaan asianmukainen suora tai käyrä esimerkiksi jonkin sovitefunktion avulla. Jos mittauspisteet ovat lähellä toisiaan, varsinaista sovitefunktiota ei tarvitse lisätä.
- Vastauksen tulee olla niin selkeä, että opettajalle ja sensorille on selvää, mitä kokelas tarkoittaa.
Erityyppisissä tehtävissä tarvittavia taitoja
- Erilaisten materiaalien (videot, kuvat, taulukot, graafiset esitykset jne.) analysointi ja tulkinta
- Tutkimusten suunnittelu ja opetussuunnitelman mukaisten kokeellisten menetelmien suoritus
- Tutkimustulosten analysointi, tulkinta ja johtopäätösten tekeminen
- Kemialle tyypillisten kaavojen ja tekstien (mukaan lukien reaktioyhtälöiden ja kuvaajien) tuottaminen digitaalisilla välineillä
Huolellisuutta, kun...
- kirjoitat alkuaineiden merkkejä tai yhdisteiden kaavoja.
- kopioit annettuja lähtötietoja (suuruusluokat, yksiköt, kaavat jne.).
- kirjoitat reaktioyhtälöitä (kaavat, olomuodot, reaktionuolet, kertoimet).
- piirrät kaavioita tai graafisia kuvaajia (akselien nimet, yksiköt, asteikko).
- ilmoitat numeerisen tehtävän vastauksen (pyöristys oikeaan tarkkuuteen ja oikea yksikkö).
- tunnistat tai nimeät orgaanisten yhdisteiden funktionaalisia ryhmiä tai luokittelet
- yhdisteitä eri yhdisteryhmiin (yhdisteluokkiin).
- esität orgaanisten yhdisteiden rakennekaavoja (sidosten suuntautuminen, isomeria).
Laskennalliset tehtävät
- Lue tehtävä huolellisesti!
- Listaa tehtävänannosta annettujen suureiden kirjaintunnukset, lisää suureiden lukuarvot annetulla tarkkuudella ja merkitse annettu yksikkö.
- Ole tarkkana yksikkömuunnosten ja merkitsevien numeroiden kanssa!
- Esimerkiksi 10 ml = 0,010 ja 100 mg = 0,100 g.
- Kirjaa näkyviin tarvittavat moolimassat taulukkokirjan suhteellisten atomimassojen tarkkuudella laskettuina. (Älä pyöristä atomimassoja!)
- Selvitä, mitä pitää ratkaista eli mikä on kysytty suure.
- Mieti, mitä suureyhtälöä käyttämällä saat ratkaistua kysytyn suureen ja kirjoita suureyhtälö näkyviin käyttäen suureiden kirjaintunnuksia.
- Sijoita tunnetut lukuarvot ja niiden yksiköt.
- Suorita laskutoimitus ja merkitse mahdollinen välitulos riittävän tarkasti.
- Yleensä välitulos, jossa on kaksi merkitsevää numeroa enemmän kuin epätarkimmassa laskussa käytetyssä lähtöarvossa, on riittävän tarkka.
- Käytä välituloksessa ja vastauksessa desimaalilukuja – ei murtolukuja.
- Kirjoita vastaus vielä erikseen ja pyöristä vastaus oikealle merkitsevien numeroiden tarkkuudelle sekä varmista, että myös yksikkö on oikea ja tulos järkevä!
Pistevähennykset
- Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti.
- Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä.
- Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. (ei-VSE)
- Muiden puutteiden tai virheiden kohdalla virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen.
- Kokeen loppupään vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät.
- Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p.
Reaktioyhtälöt
Reaktioyhtälöt
- Reaktioyhtälön kertoimiksi pienimmät mahdolliset kokonaisluvut.
- Reaktioyhtälöön kirjoitetaan näkyviin aineiden olomuotojen tunnukset.
- Ilmassa esiintyvät alkuaineet ja yhdisteet ovat kaasuja, joten niiden olomuodoksi merkitään (g).
- Suolat eli kaikki ioniyhdisteet ovat huoneen lämpötilassa kiinteitä aineita (s).
- Metallit elohopeaa lukuun ottamatta ovat huoneenlämpötilassa kiinteitä (s).
- Reaktioyhtälössä esiintyvä vesi on olomuototunnukseltaan (l). Poikkeuksen muodostaa palamisreaktiossa muodostuva vesihöyry
- Liuosten olomuototunnuksena käytetään merkintää (aq), kun liuottimena on vesi.
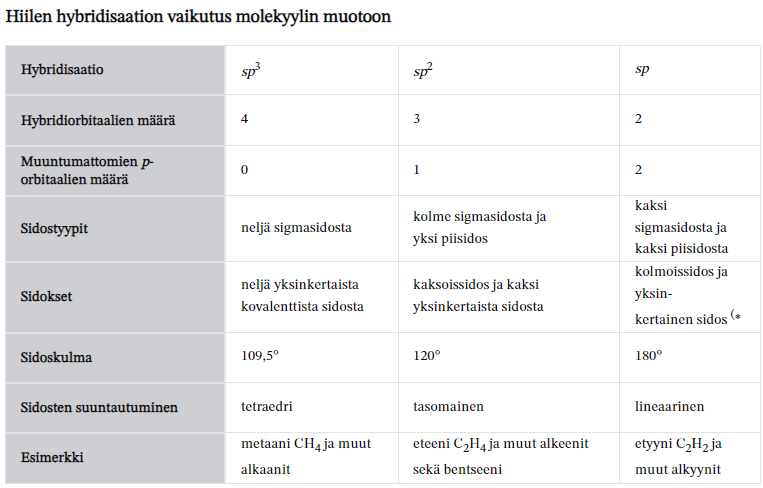
- Kiinteät ja nestemäiset alkuaineet kirjoitetaan reaktioyhtälöön yksiatomisina kuten Cu, Fe, Ni, Hg. Poikkeuksena kiinteä jodi ja nestemäinen bromi kirjoitetaan kaksiatomisina
- Kaasumaiset alkuaineet kirjoitetaan kaksiatomisina. Poikkeuksena kaikki jalokaasut kirjoitetaan yksiatomisina.
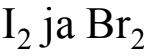
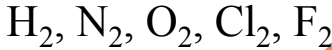

Reaktioyhtälöt

Tehtävätyyppejä
- Suhde-, molekyyli- ja rakennekaava (tulee orgaanisen kemian yhteydessä)
- Rajoittava tekijä (lähtöaine loppuu kesken)
- Reaktion saanto
- Kaasulaskut
- Seoslaskut (rinnakkaiset reaktiot)
- Reaktiosarja
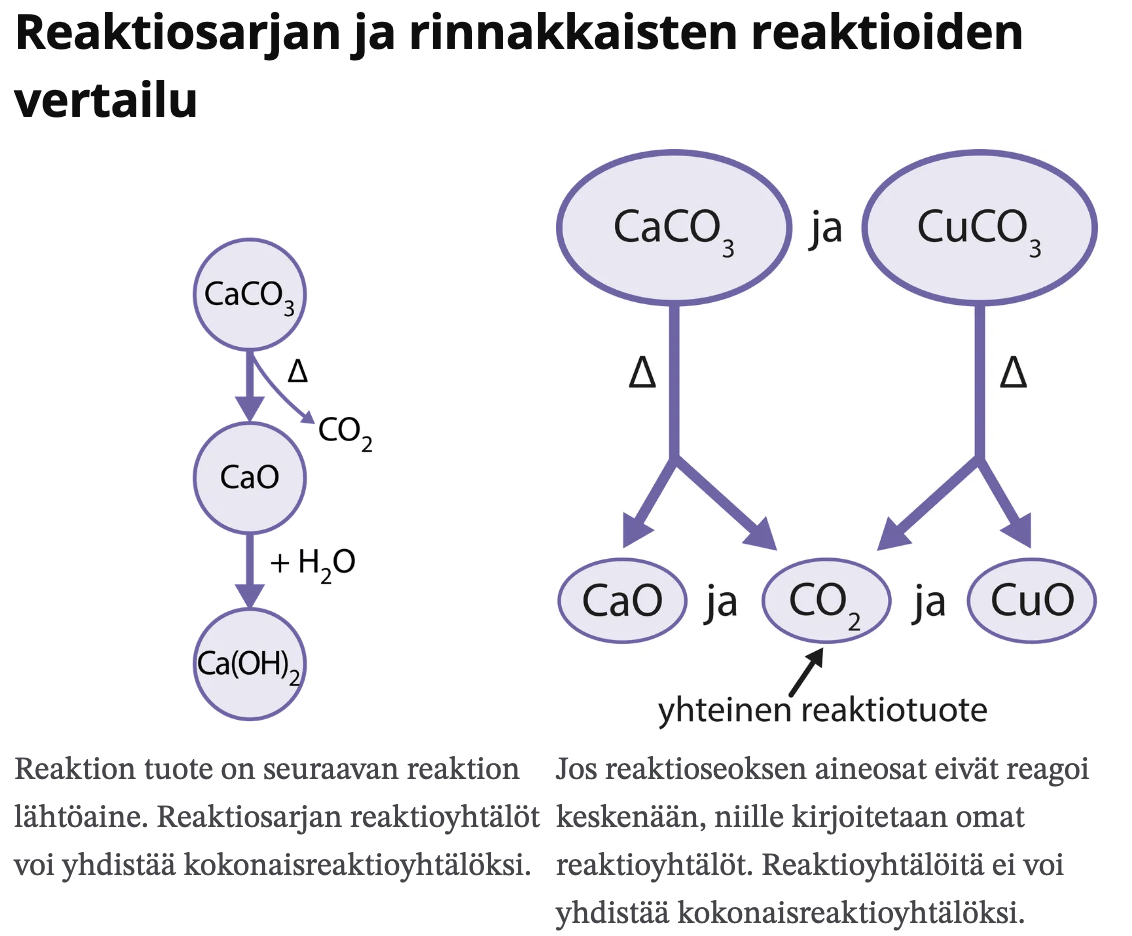

Hapetuslukuja
Erilaisia reaktioita
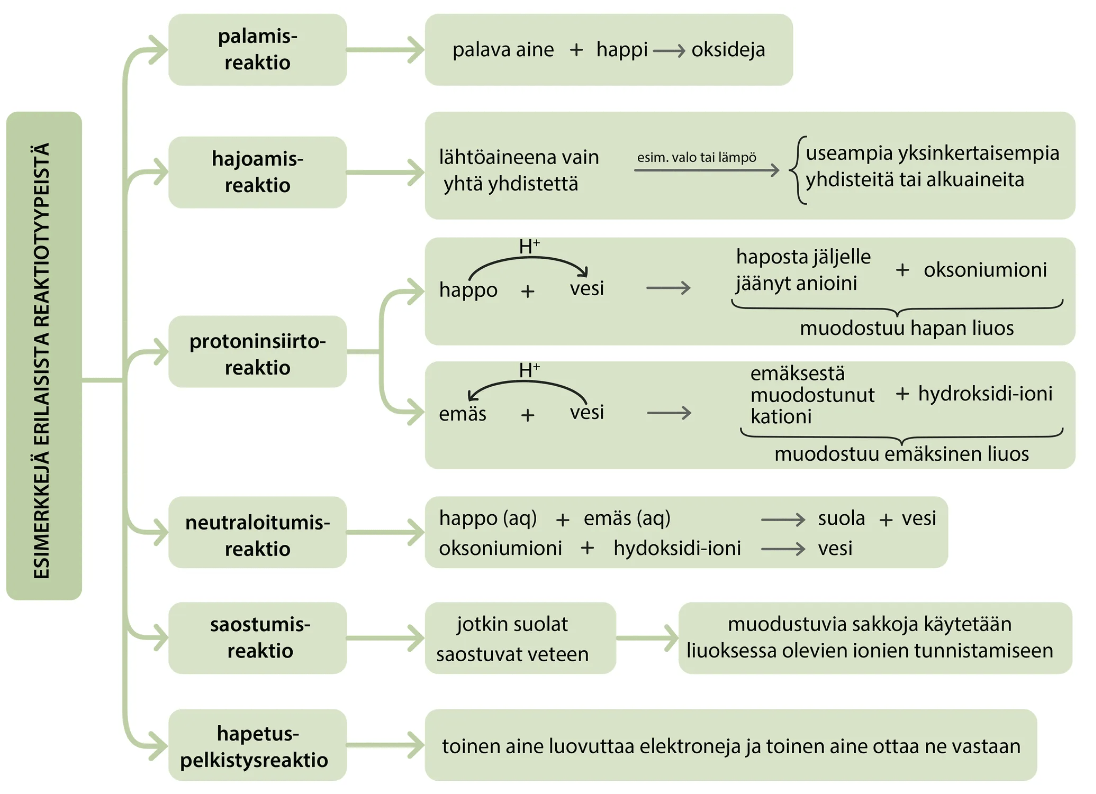
Aineen rakenne

Aineen rakenne
- Aineet voidaan jaotella rakenteen mukaan puhtaisiin aineisiin ja seoksiin
Aineen rakenne
- Aineet voidaan jaotella rakenteen mukaan puhtaisiin aineisiin ja seoksiin

Puhdas aine
-
Puhdas aine koostuu keskenään samanlaisista rakenneosista.
-
Alkuaineet ja yhdisteet ovat puhtaita aineita.
Yhdiste
-
Yhdiste on aine, jossa vähintään kahden eri alkuaineen atomit tai ionit ovat liittyneet toisiinsa kemiallisella sidoksella.
-
Yhdisteen muodostavilla alkuaineilla on tietty ainemääräsuhde, jonka mukaan yhdisteen kaava kirjoitetaan.
Homogeeniset ja heterogeeniset seokset
-
Homogeenisessä eli tasakoosteisessa seoksessa kaikki aineosat ovat samassa faasissa.
-
Heterogeenisessä eli sekakoosteisessa seoksessa kaikki aineet eivät ole samassa faasissa.



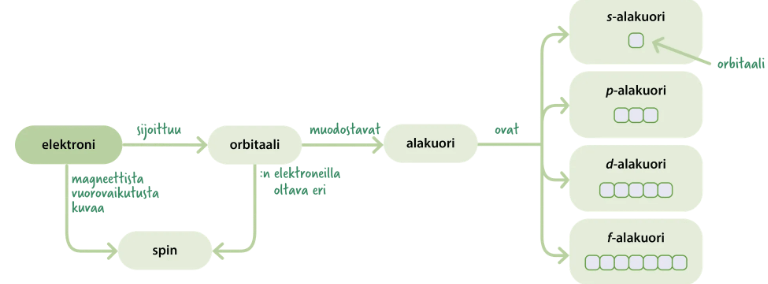

1. Pyrkimys energiaminimiin
Minimienergiaperiaatteen
mukaisesti elektroni asettuu aina
alhaisimmalle mahdolliselle
energiatasolle.
2. Paulin kieltosääntö
Atomissa ei ole kahta energialtaan täysin samanlaista
elektronia, koska samallakin orbitaalilla olevien
elektronien spinit eroavat.
3. Hundin sääntö
Elektronit asettuvat samanenergiselle orbitaalille saman
suuntaisesti yksitellen (parittomina) niin pitkälle kuin
mahdollista


Elektronien täyttyminen
MUISTISÄÄNNÖT
- Pääkuoren (pääenergiatason) numero n, n=1,2,3,.....n
- Alatasojen lukumäärä kuorella n on n
- Alatasojen täyttymisjärjestys on samalla niiden energioiden järjestys:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p....
- Orbitaalien lukumäärä kuorella n on
- Elektronien maksimimäärä kuorella n on