UNIDAD EDUCATIVA
MANUELA SÁENZ DE AIZPURU D7



2do Bachillerato General Unificado
QUIMICA
TEMA: RENDIMIENTO DE REACCION
21 - 12 - 2020

RENDIMIENTO DE REACCION
RAZONES POR LAS CUALES LA CANTIDAD OBTENIDA DE UNA REACCION ES INFERIOR A LA ESPERADA:
. Muchas reacciones son reversibles, por lo que la transformación no es completa.
• A veces, no es posible separar totalmente el producto obtenido.
• Los productos formados pueden producir reacciones secundarias.
• Muchas moléculas no están suficientemente activadas parareaccionar, etc.

Se debe tomar en cuenta que lo esperado de una reacción química es la relación entre la cantidad de producto final obtenido (rendimiento real) y la cantidad que debía obtenerse según la estequiometría de la ecuación (rendimiento teórico)

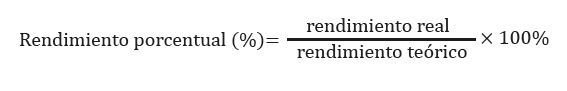
RENDIMIENTO DE REACCION
El intervalo del porcentaje del rendimiento puede fluctuar desde 1% hasta 100%. En química y en procesos industriales se busca tener el rendimiento más alto posible. Los rendimientos industriales son generalmente bajos, por ejemplo, para producir en una industria aceite de oliva se tiene un rendimiento del 24%.
RENDIMIENTO REAL




RENDIMIENTO DE REACCION
EJEMPLO DE RENDIMIENTO DE REACCION


Se hacen reaccionar diez gramos de óxido de aluminio (Al2O3) con un exceso de ácido clorhídrico (HCl) para obtener veinticinco gramos de cloruro de aluminio.
a. Calculamos el rendimiento de la reacción.
b. Si el rendimiento teórico fuera del 60%, ¿cuánto se esperaría que fuera el rendimiento real?
DATOS
Reactivos: 10 g de Al2O3 y HCl
Productos: 25 g de AlCl3 y H2O
Ecuación de la reacción : Al2O3(s) + HCl (ac) → AlCl3(ac) + H2O(l)
Ecuación balanceada de la reacción : Al2O3(s) + 6HCl (ac) → 2AlCl3(ac) + 3H2O(l)
Rendimiento teórico: 60%
DESARROLLO
Paso 1: Pasamos la cantidad de reactivo que se tenga a unidades de producto deseado.

EJEMPLO DE RENDIMIENTO DE REACCION


Paso 2: El valor del enunciado del producto va a ser equivalente al rendimiento real, en este caso es 25 gramos de cloruro de aluminio. El valor obtenido de 25,88 gramos de cloruro de aluminio es el rendimiento teórico porque se lo obtuvo mediante cálculos. Lo reemplazamos en la fórmula.
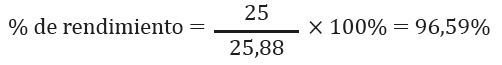
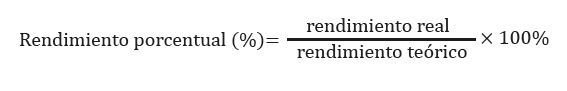
Los datos que conocemos para poder determinar el rendimiento real del literal b son: el rendimiento teórico calculado en el literal a. (25,88g de cloruro de aluminio) y el porcentaje de rendimiento (60%) mencionado en el enunciado del ejercicio.

RENDIMIENTO DE REACCION


RENDIMIENTO DE REACCION

