U.E. "11 de Noviembre"
QUIMICA
1ro BGU
TABLA PERIODICA




PRIMERAS CLASIFICACIONES DE LOS ELEMENTOS QUIMICOS
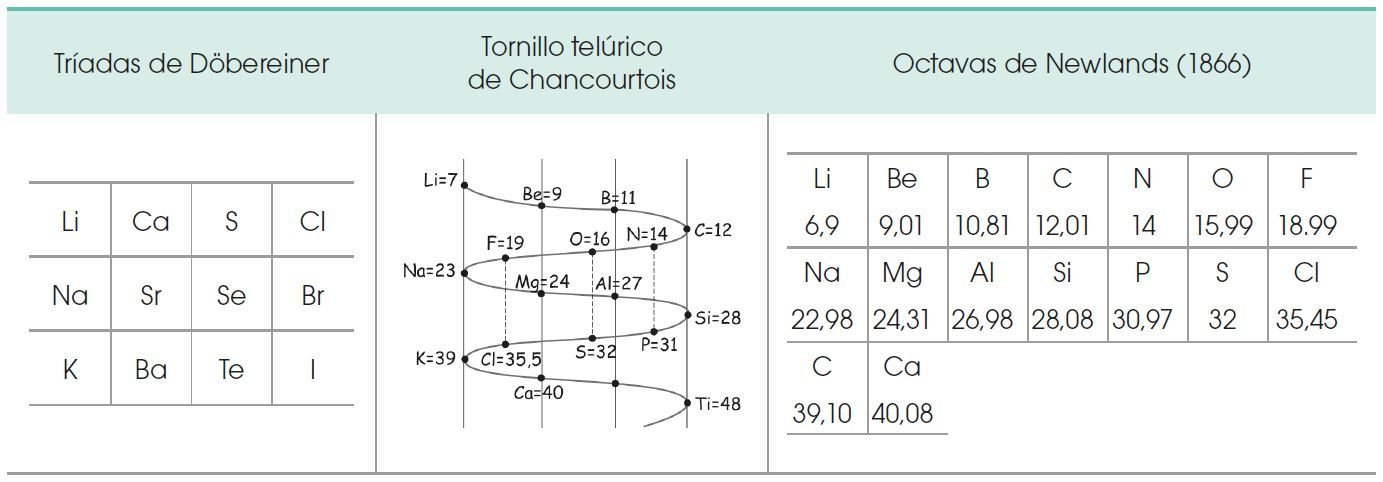
Lavoisier (1743-1794) clasificó a los elementos en metales y no metales.
Berzelius (1779-1848) creó la simbología química.
La actual tabla periódica se la debemos a Dimitri Mendeleiev y es este el mayor de los aportes en la clasificación y ubicación de los elementos químicos; posteriormente Seaborg (1912-1999) ordenó los elementos lantánidos junto a los transuránicos.

Para confeccionar su tabla periódica, Mendeleiev:
• Modificó el valor asignado a la masa atómica de algunos elementos, como el indio, el
berilio y el uranio.
• Colocó elementos en orden inverso a su masa atómica, como las parejas teluro/yodo
y cobalto/níquel.
• Dejó huecos en su tabla para nuevos elementos cuya existencia y propiedades predijo
(galio, germanio y escandio). El tiempo confirmó todas sus predicciones.








La tabla periódica actual consiste en un cuadro de doble entrada en el que los elementos están agrupados en siete períodos (filas) y dieciocho grupos (columnas). Veamos la siguiente característica:
• En cada período aparecen los elementos para los que el último nivel de su configuración electrónica coincide con el número del periodo, situados por orden creciente del número atómico.
LEY PERIODICA



@ Los elementos de un mismo período tienen el mismo número de niveles electrónicos, completos o no. Este número coincide con el número del período (tabla).
@Los elementos de un mismo grupo presentan la misma estructura electrónica en su nivel más externo, o capa de valencia.
ESTRUCTURA ELECTRONICA
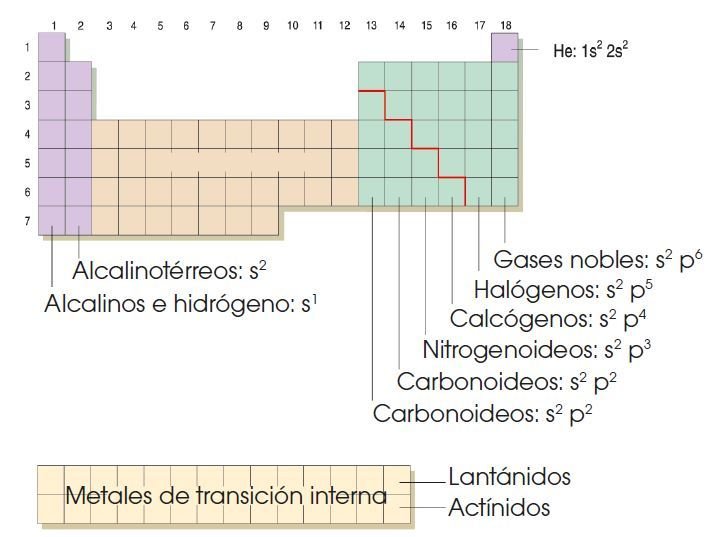






Los períodos se designan por números correlativos del 1 al 7. En ellos los elementos presentan propiedades diferentes que varían progresivamente desde el comportamiento metálicohasta el comportamiento no metálico, para acabar siempre con un gas noble.
ESTRUCTURA DE LA TABLA PERIODICA

Los elementos de un período determinado se caracterizan
por tener electrones en el mismo nivel más externo, que es
precisamente el número que designa cada período. Así, los
elementos del período 1 tienen electrones solo en el nivel 1,
los del período 2 tienen electrones ocupando hasta el nivel
2, los del tercer período tienen electrones hasta el nivel 3, y
así sucesivamente.
FAMILIAS DE LOS ELEMENTOS QUIMICOS
Grupos
Los elementos de un mismo grupo presentan la misma estructura electrónica en su nivel más externo, o capa de valencia. Por ello, con algunas excepciones, presentan propiedades químicas similares.
Los grupos se designan mediante números correlativos del 1 al 18.
• Los elementos metálicos se sitúan en los grupos 1 y 2.
• Los metales de transición ocupan los grupos del 3 al 12.
• Los no metales y los semimetales ocupan los grupos del 13 al 17.
• Los gases nobles constituyen el grupo 18.
Los grupos 1, 2 y del 13 al 18 están constituidos por los elementos que conocemos como elementos representativos.

Elementos representativos
• Los metales alcalinos: Corresponden al grupo o familia 1A de la tabla periódica y su nombre se debe a que forman álcalis, metales reactivos que producen óxidos fácilmente.
Constituyen el 4,8% de la corteza terrestre.

Los metales alcalinos térreos: Son metales del grupo o familia2A. Están en un 4% en la corteza terrestre, tienen unaapariencia terrosa, también forman óxidos básicos y son:
berilio, magnesio, calcio, estroncio, bario y radio.
Son un poco menos reactivos que el grupo 1A y no se encuentran libres; el radio es muy raro, tienen dureza variable; son muy ligeros y tienen dos electrones de valencia.








CARACTER METALICO DE LOS ELEMENTOS DE LA TABLA PERIODICA

CARACTER METALICO DE LOS ELEMENTOS DE LA TABLA PERIODICA




