UNIDAD EDUCATIVA
11 DE NOVIEMBRE
PRIMERO BACHILLERATO GENERAL UNIFICADO
ASIGNATURA: QUÍMICA
TEMA: ENLACE QUIMICO
MSc. FRANKLIN E. GALARZA C.
19 DE ENERO 2022




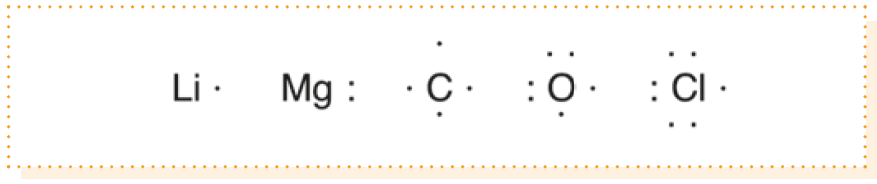
REPRESENTACION DE LEWIS
Para representar un átomo, escribimos el símbolo del elemento y lo rodeamos de tantos puntos como electrones de valencia tenga.
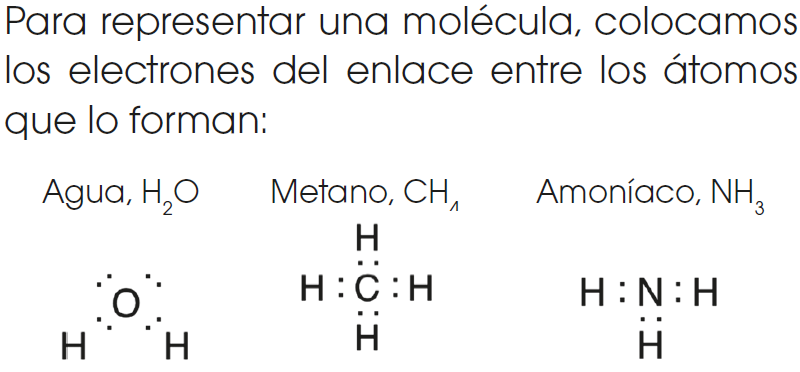
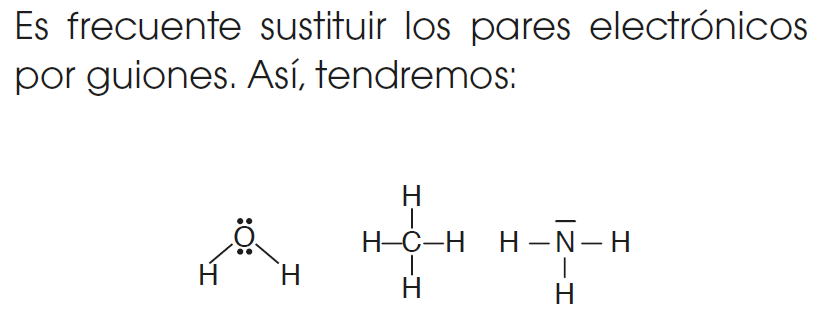



REGLA DEL OCTETO
Los gases nobles no presentan ninguna tendencia a reaccionar ni a formar agrupaciones de átomos y ello es debido a que poseen una gran estabilidad.
El análisis de sus configuraciones electrónicas muestra que, a excepción del helio, los gases nobles tienen ocho electrones en su nivel más externo.


Por ello, en general, y aunque existen excepciones, se admite que los átomos de los elementos se rodeen de ocho electrones en el subnivel más externo para ganar estabilidad.
Este comportamiento recibe el nombre de regla del octeto.
Así, los átomos de los elementos tienden a ganar, perder o compartir electrones para conseguir que su nivel más externo adquiera la configuración de gas noble.
Esta regla solo es una aproximación útil para comprender los enlaces. En muchas moléculas aparecen átomos rodeados por un número menor o mayor de ocho electrones.
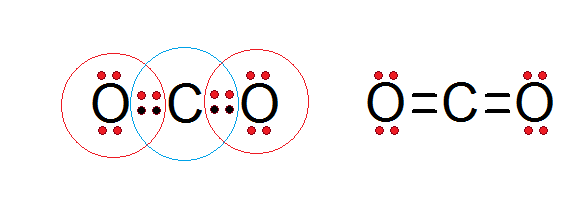

EXCEPCIONES A LA REGLA DEL OCTETO


Esta regla fue enunciada por el químico alemán Walther Kossel en 1916. Algunas de sus excepciones son:
En general, todos los elementos del tercer período y superiores pueden ampliar el octeto, es decir, tener más de ocho electrones en la capa de valencia.



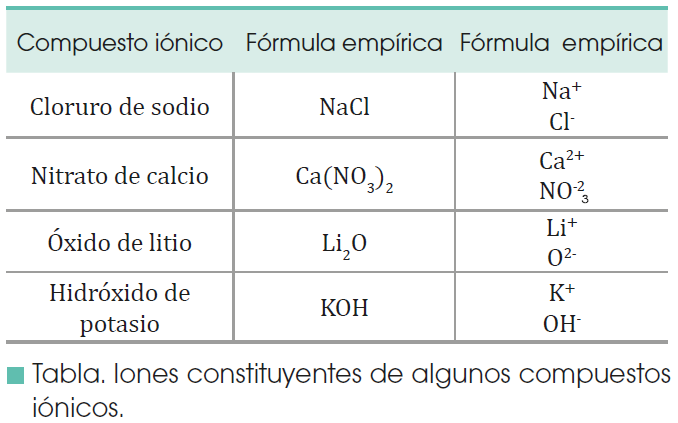
FORMACION DE IONES


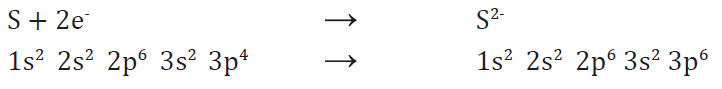
Existen muchas sustancias en las que no hay átomos propiamente dichos ni, por tanto, moléculas. Son sustancias constituidas por iones positivos y negativos. Veamos cómo se forman. Un elemento muy poco electronegativo puede perder uno, dos o más electrones:
Y, por el contrario, un elemento muy electronegativo puede ganar uno, dos o más electrones:
Los elementos metálicos, con pocos electrones de valencia y baja energía de ionización, tienden a convertirse en cationes.
Los elementos no metálicos, con muchos electrones de valencia y afinidad electrónica muy negativa, tienden a recibir electrones convirtiéndose en aniones.
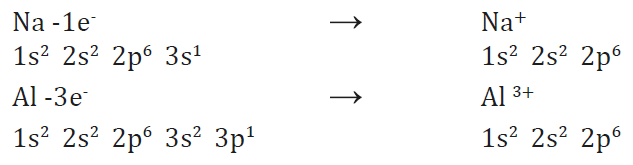
ENLACE QUIMICO
Las fuerzas que unen a los átomos, los iones o las moléculas que forman las sustancias químicas (elementos y compuestos) de manera estable se denominan enlaces químicos.
En la formación de un enlace, los átomos tienden a ceder, ganar o compartir electrones hasta que el número de estos sea igual a ocho en su nivel de valencia.

ENLACE IONICO
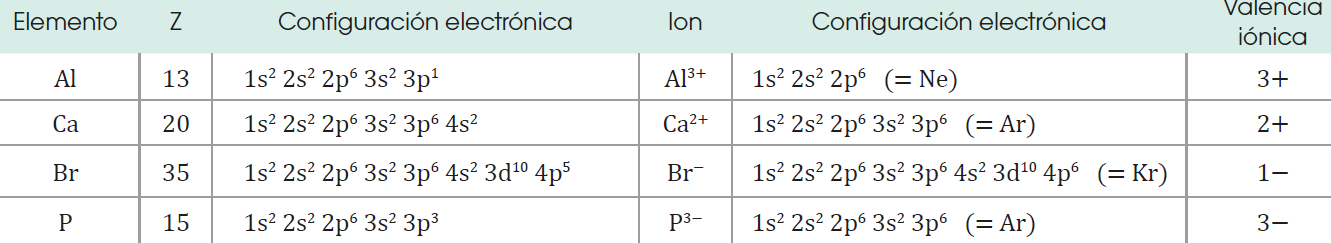
Los iones son átomos o grupos de átomos que poseen cargas positivas o negativas por haber cedido o adquirido electrones.
Según sea su estructura electrónica, cada átomo cede o recibe un número determinado de electrones hasta adquirir la configuración estable de gas noble.
De esta forma adquiere una cierta carga positiva o negativa, a la que denominamos valencia iónica.
La valencia iónica de un elemento es la carga que adquieren sus átomos al convertirse en iones positivos o negativos.
Veamos, por ejemplo, el potasio,
K (Z = 19).
Su estructura electrónica es
Si cede un electrón, adopta la configuración del gas noble argón (Z = 18).
Por tanto, su valencia iónica es 1+.
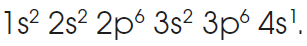

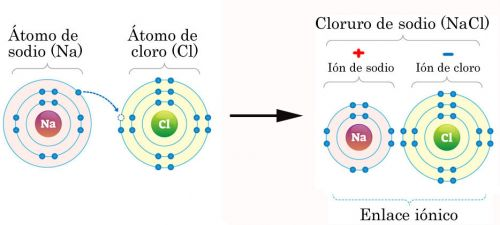
ENLACE IONICO
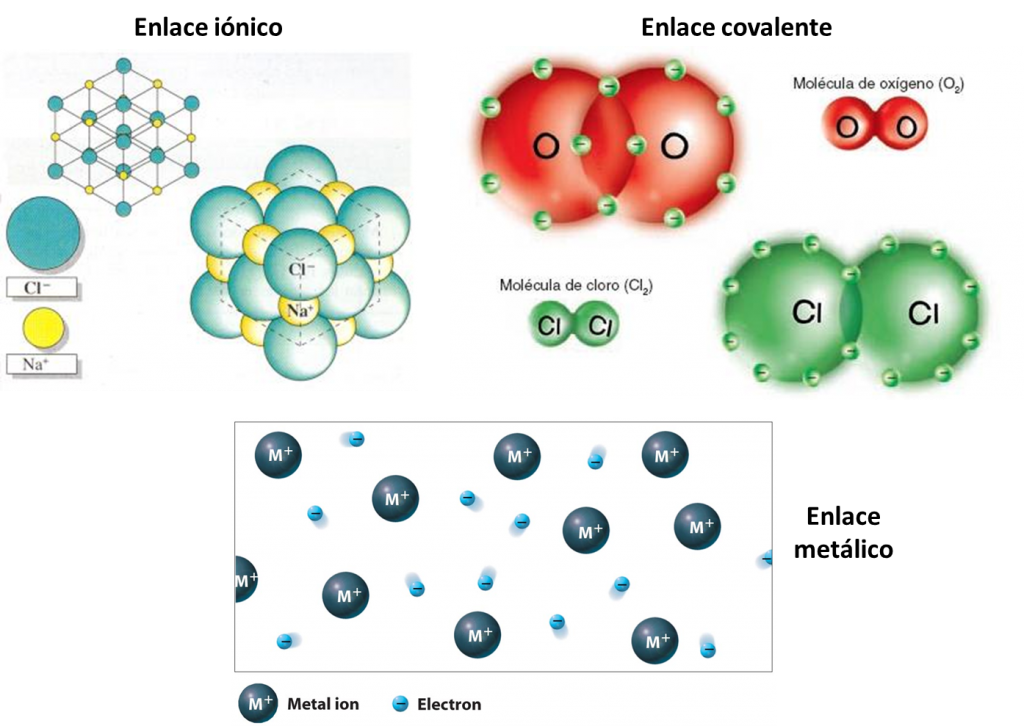
El enlace iónico es la unión resultante de la presencia de fuerzas electrostáticas entre iones positivos y negativos para dar lugar a la formación de un compuesto constituido por una red cristalina iónica.
ENLACE IONICO
TICAS
ENLACE COVALENTE
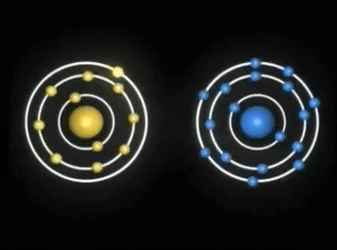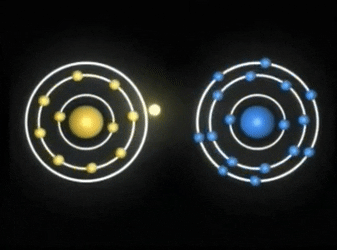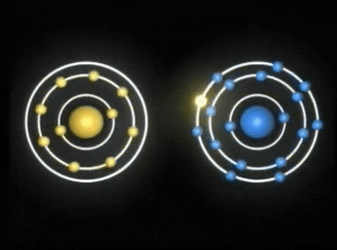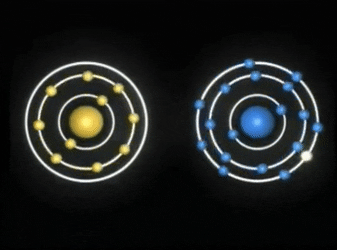
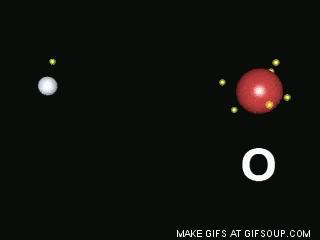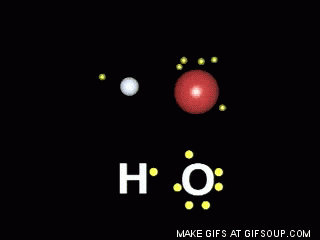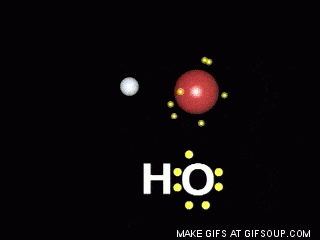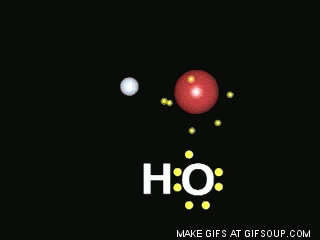
Enlaces covalentes: Consisten en la unión de dos átomos que comparten uno o más pares de electrones. Es el caso, entre otros muchos, de la molécula de flúor, F2
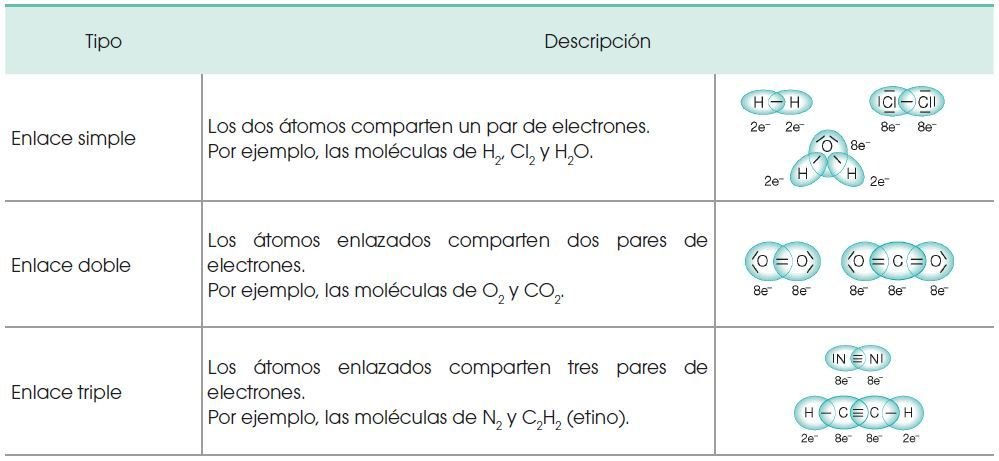


ENLACE COVALENTE

Propiedades de las sustancias covalentes:
Moleculares
• A temperatura ambiente son líquidos o gases de bajo punto de fusión.
• Existen moléculas solubles en agua y otras solubles en disolventes orgánicos.
• No conducen corriente eléctrica y tampoco el calor.
Cristalinas
• A temperatura ambiente son sólidos con un punto de fusión muy elevado.
• Son insolubles en casi todos los disolventes.
• No conducen corriente eléctrica.
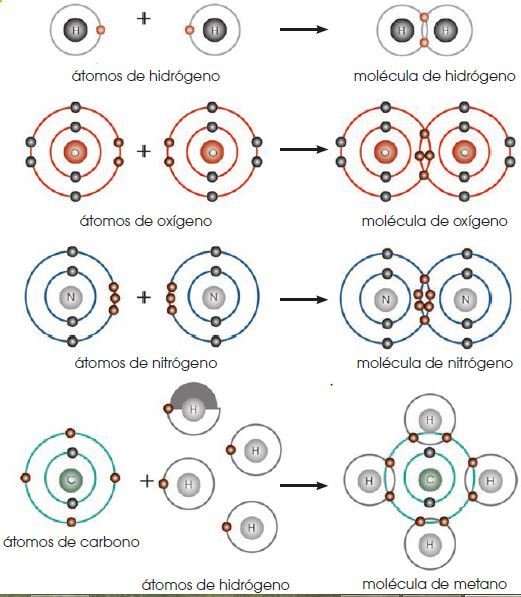
ENLACE COVALENTE

Propiedades de las sustancias covalentes:
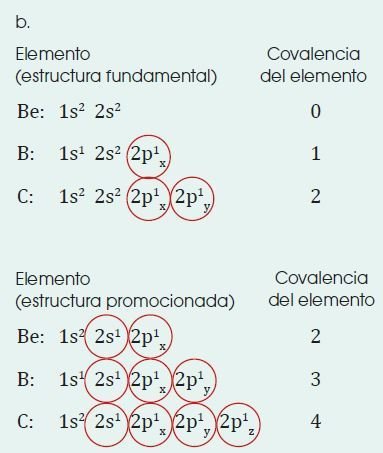
Covalencia
Llamamos covalencia, o valencia covalente de un elemento al número de enlaces covalentes que es capaz de formar.
Enlace coordinado
En esta teoría se considera que el enlace covalente coordinado se forma cuando un átomo aporta un orbital de valencia desocupado, mientras otro átomo contribuye con un orbital de valencia ocupado por dos electrones.

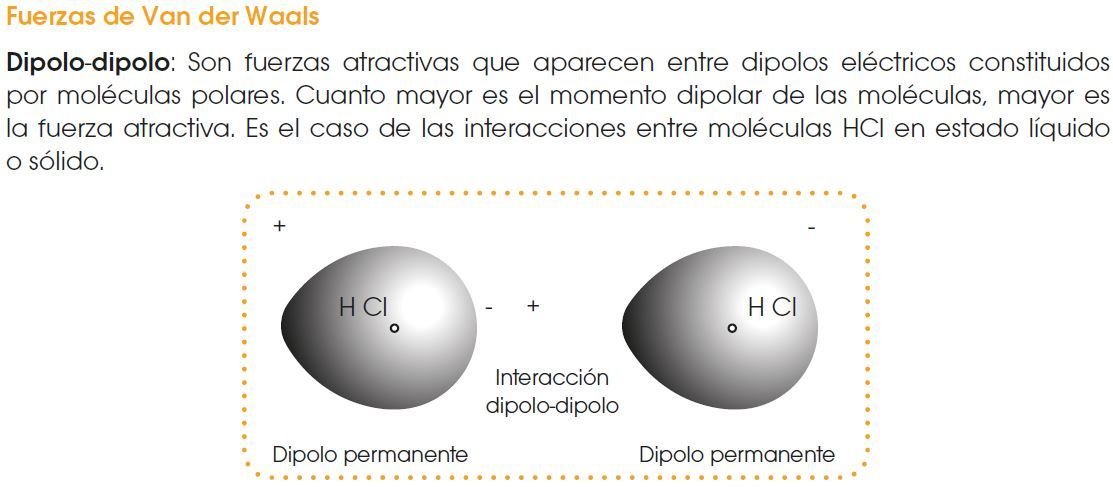
Fuerzas de atracción intermolecular

Las fuerzas intermoleculares son las fuerzas de atracción que existen entre las moléculas de las sustancias covalentes.
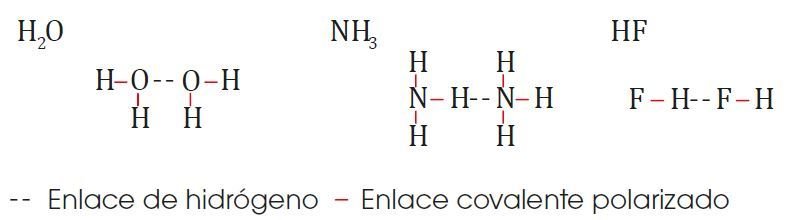
Puente de hidrógeno
Es un tipo especial de interacción electrostática; es decir, es un enlace intermolecular más intenso que las fuerzas de Vander Waals, lo que hace que las sustancias que lo presentan tengan puntos de fusión y de ebullición más elevados. Se da entre el hidrógeno y átomos pequeños y muy electronegativos
Fuerzas de atracción intermolecular

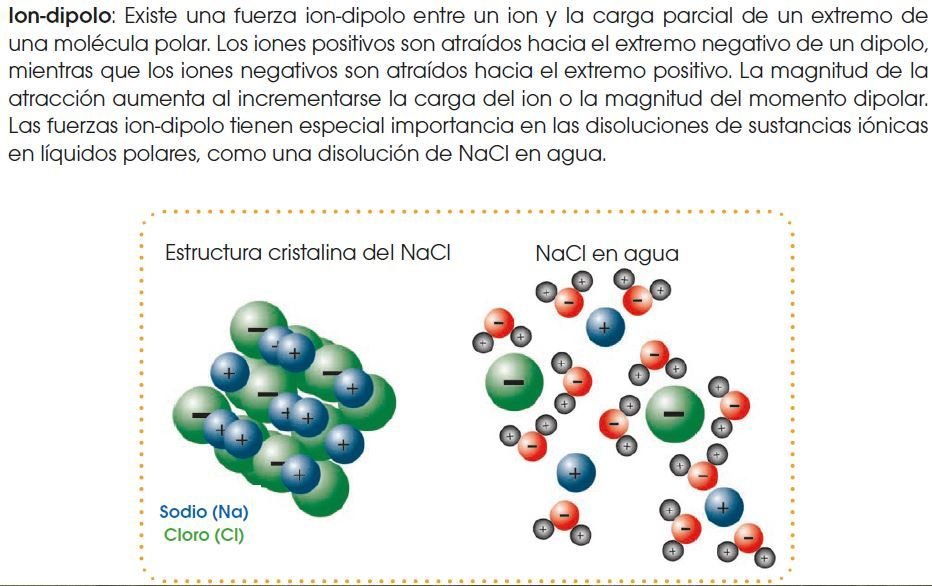
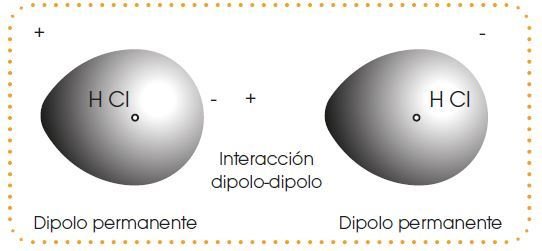
Fuerzas de atracción intermolecular




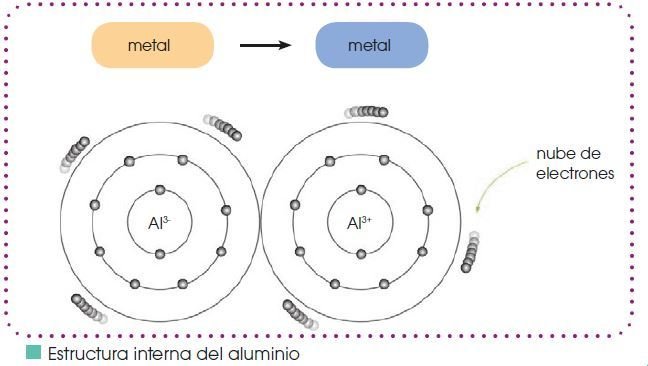
Enlace Metálico

El enlace metálico es la fuerza atractiva que existe en los metales entre los iones positivos y los electrones móviles de valencia que los rodean.
Los metales son los elementos más numerosos de la tabla periódica y están situados a la izquierda y en el centro de esta. Así, son metales el sodio, el magnesio, el titanio, el hierro o la plata.
Estructura interna de los metales
•Los átomos de los metales no forman moléculas sino que se colocan ordenadamente y constituyen una estructura cristalina lo más compacta posible.
• Cada átomo se desprende de sus electrones de valencia convirtiéndose en ion positivo.
• Los electrones de valencia de todos los átomos forman una nube electrónica capaz de desplazarse entre los huecos de la estructura.
• La interacción entre la nube de electrones y los iones positivos asegura la estabilidad del metal. Esta unión constituye el enlace metálico.