Soluções
Definição
A água que bebemos, os refrigerantes, os combustíveis (álcool hidratado, gasolina), diversos produtos de limpeza (como sabonetes líquidos) são exemplos de soluções.
Tipos de soluções: solução líquida (ex.: refrigerantes),
solução sólida (ex.: bronze = cobre +estanho) e solução gasosa (ex.: ar atmosférico).

Componentes de uma solução
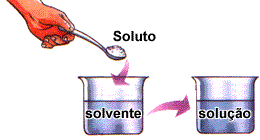
- Soluto é a substância dissolvida no solvente. Em geral, está em menor quantidade na solução.
- Solvente é a substância que dissolve o soluto.
Classificação das soluções
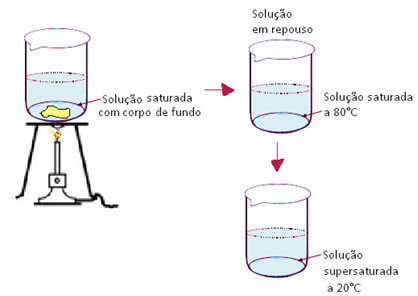
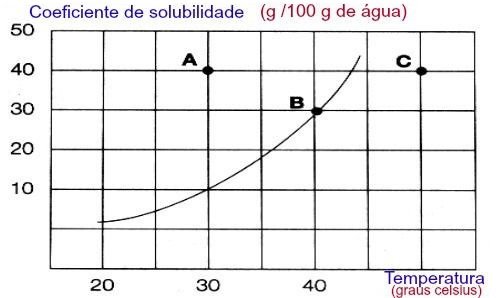
- Soluções saturadas contêm uma quantidade de soluto dissolvido igual à sua solubilidade naquela temperatura, isto é, excesso de soluto, em relação ao valor do coeficiente de solubilidade (Cs), não se dissolve, e constituirá o corpo de fundo.
- Soluções insaturadas contêm uma quantidade de soluto dissolvido menor que a sua solubilidade naquela temperatura.
- Soluções supersaturadas contêm uma quantidade de soluto dissolvido maior que a sua solubilidade naquela temperatura.
Gráfico do coeficiente de solubilidade
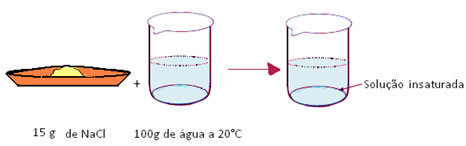
- Soluções insaturadas ou não saturadas: são aquelas em que a quantidade de soluto dissolvido ainda não atingiu o coeficiente de solubilidade. Isso significa que se quisermos dissolver mais soluto, isso será possível.
Por exemplo, se dissolvermos apenas 15 g de sal em 100 g de água a 20ºC, teremos uma solução insaturada, pois ainda faltam 21 g para atingir a quantidade máxima de soluto a ser dissolvido nessas condições.
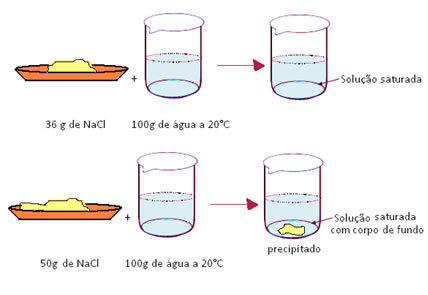
- Soluções saturadas: são aquelas que atingiram exatamente o coeficiente de solubilidade.
Se misturarmos 50g de sal em 100 g de água a 20ºC, veremos que os 36g irão se dissolver e o restante (14g) irá precipitar, formando corpo de fundo. Nesse caso teremos então uma solução saturada com corpo de fundo. Porém, se quisermos apenas a solução saturada, basta realizar uma filtração simples para separar o precipitado da solução saturada.
- Soluções supersaturadas: possuem mais soluto dissolvido do que seria possível em condições normais.
Por exemplo, se pegarmos a solução saturada com corpo de fundo, citada anteriormente, que possui 36g de sal dissolvidos e 14 g no corpo de fundo, e a aquecermos, notaremos que os 14 g que estavam precipitados irão se dissolver. Isso acontece porque com o aumento da temperatura o coeficiente de solubilidade, nesse e na maioria dos casos, também aumenta. Posteriormente, deixamos essa solução em repouso para que volte à temperatura inicial, que era de 20°C. Ao fazermos isso, os 50g continuam dissolvidos na água. Desse modo, haverá mais soluto dissolvido (50g) do que deveria ter (36g) naquela temperatura e pressão. É, portanto, um caso de solução supersaturada