Átomos y periodicidad
Y la palabra periodicidad

Antigüedad: Nueve elementos:
Edad Media: Cuatro elementos más:
Siglo

Siglo XIX:
- Davy: Alcalinos y alcalinotérreos: nueve
- Gay – Lussac y Thénard: B
- Wollaston: Pd, Rh
- Berzelius: Ce, Se, Si, Zr, Th
- S. Thennand: Os, Ir

Siglo XIX:
- C. Hatchett. Colombio = Nb
- A. Ekeberg: Ta
- L. Vauquelin: Be
- A. Balard: Br
- B. Courtois: I

1830: se conocían 55 elementos
•
¿Cuantos elementos quedan por descubrir?
¿Hay algún límite?
¿Existe alguna relación entre ellos?



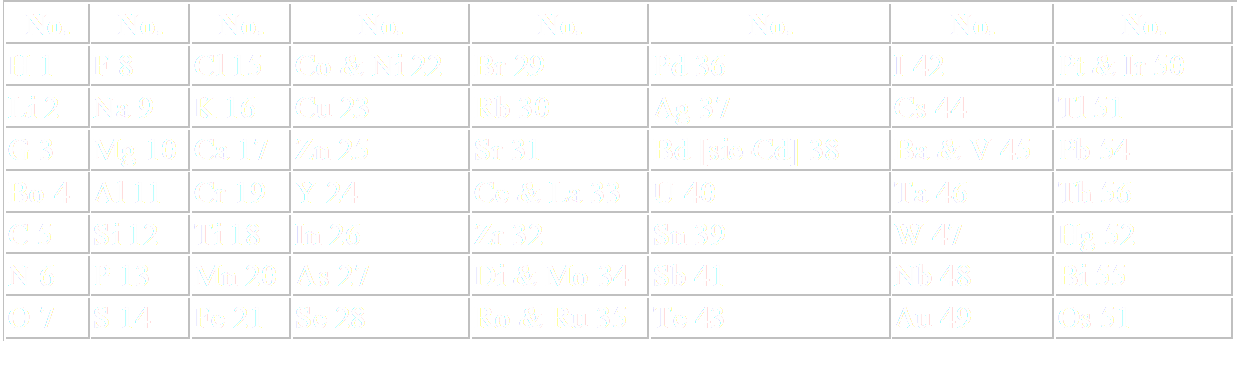
John A. Newlands
(1837 – 1898)

1864 – John A. Newlands (1837 – 1898)
•Ordena los elementos conocidos según sus pesos atómicos crecientes, tal que al disponer los elementos en columnas verticales de siete, los que poseían propiedades semejantes tendían a quedar en la misma fila horizontal



Dimitri I. Mendeleiev
(1834 – 1907)

1869 – Dimitri I. Mendeleiev (1834 – 1907)
- Toma como base el concepto de valencia
- Toma como referencia el peso atómico
Observa
- Los primeros elementos presentan una valencia progresiva
- Y esta valencia subía y bajaba estableciendo los periodos

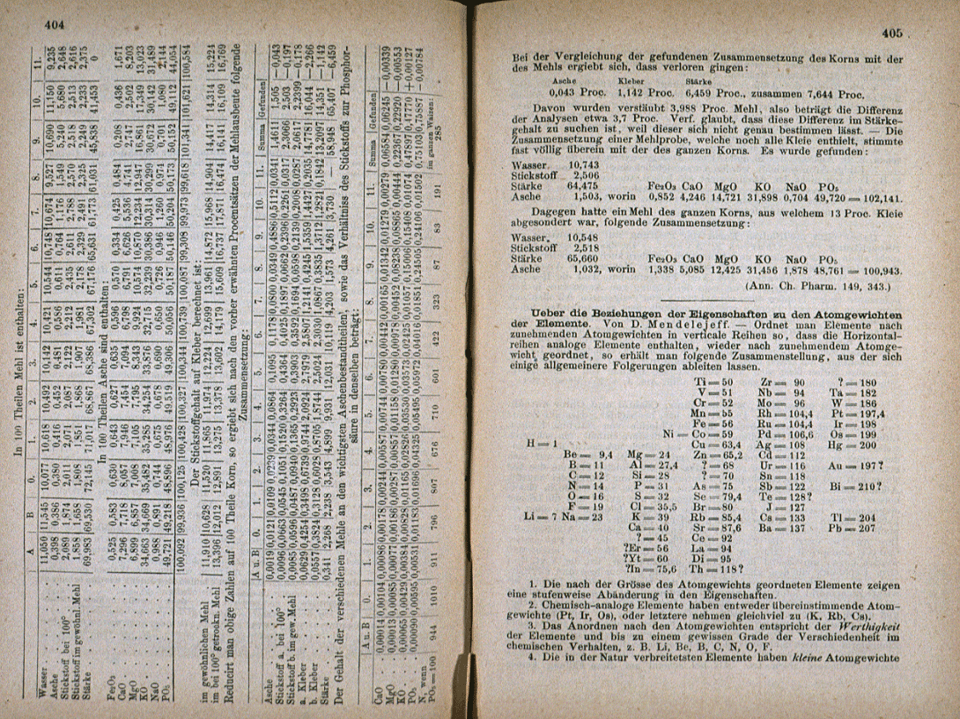



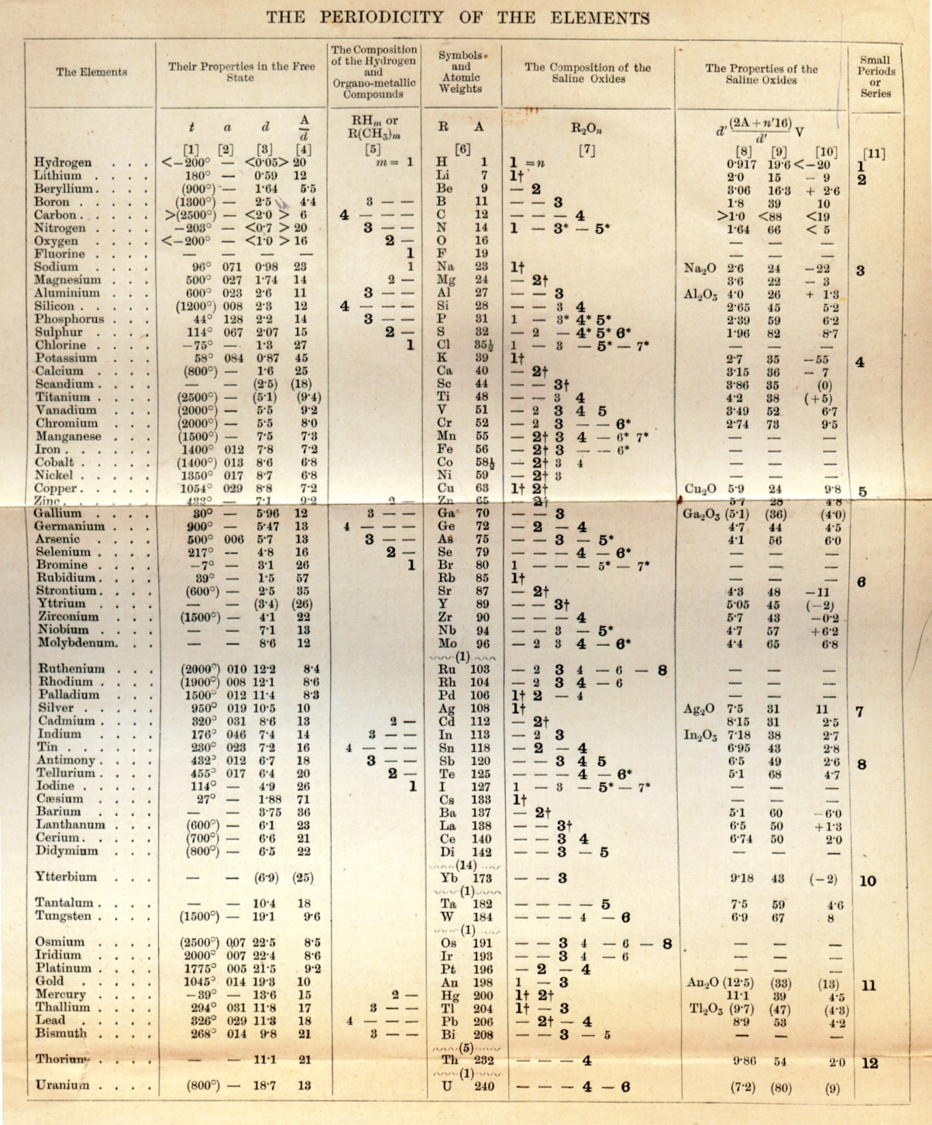

¿Qué caracterizó y le dio supremacía a la tabla de Mendeleiev?
- Deja huecos, en los cuales predice se deben encontrar elementos aún por descubrir:
- eka – aluminio: Galio (Ga) - 1875
- eka – silicio: Germanio (Ge) - 1886
- eka – boro: Escandio (Sc) - 1871

DESCUBRIMIENTO DE LOS ELEMENTOS


Joseph von Fraunhofer

G. R. Kirchhoff


R. W. Bunsen

DESCUBRIMIENTO DE LOS ELEMNENTOS
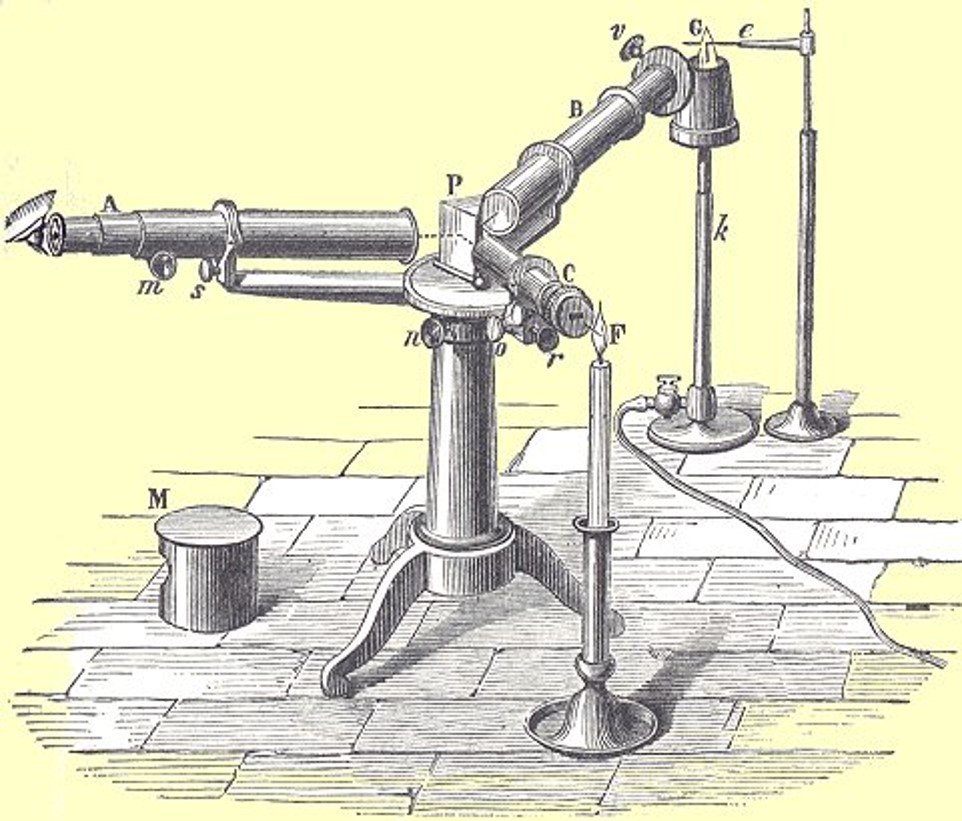
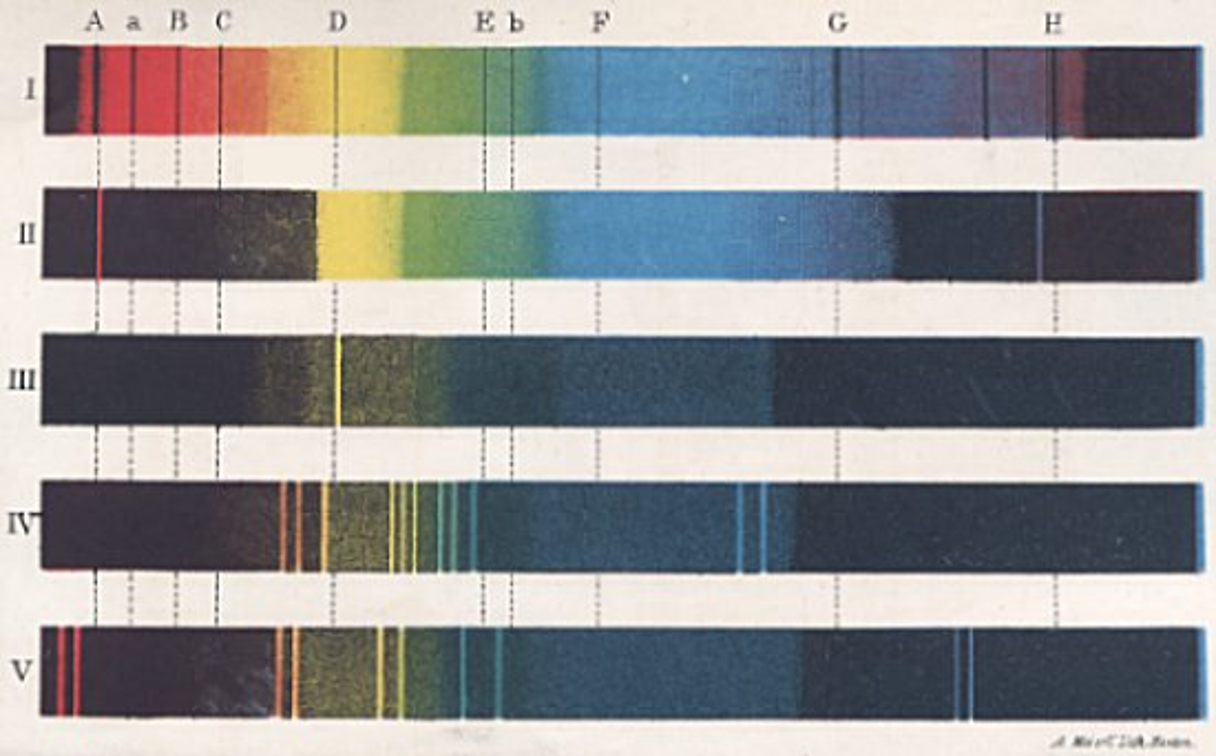
- 1814, Joseph von Fraunhofer: Experimentando con prismas encuentra que al hacerles pasar luz se formaba un espectro de colores cruzado por una serie de líneas oscuras.
- 1850, G. R. Kirchhoff y R. W. Bunsen: Usan como fuente el mechero de Bunsen para calentar diversos minerales los cuales presentaban un patrón de líneas característico

Espectroscopio







LOS GASES NOBLES

1894, W. Ramsay: Repite los experimentos de Cavendish, encontrando un gas que no reaccionaba y en el espectroscopio presentaba líneas que no correspondían a ningún elemento conocido el cual constituía el 1% del volumen de la atmósfera: descubre el argón
1895, Se estudia el espectro del sol y se descubre un elemento nuevo el Helio, el cual era el mismo encontrado a partir de minerales de uranio
1898, Ramsay: hierve aire líquido y encuentra el neón, criptón y xenón


LA LEY DE MOSELEY
1911



http://www.scitechantiques.com/Mosley_atomic_number/

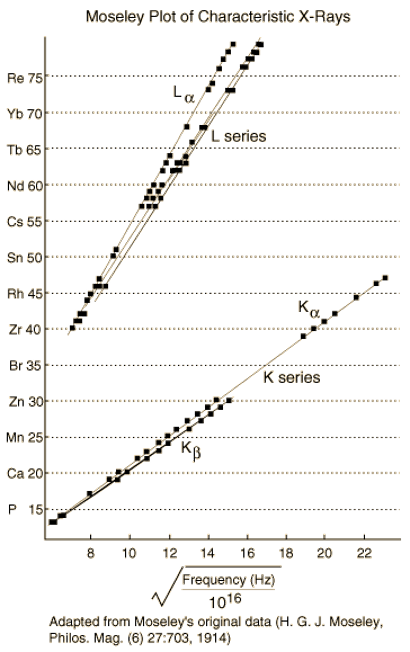
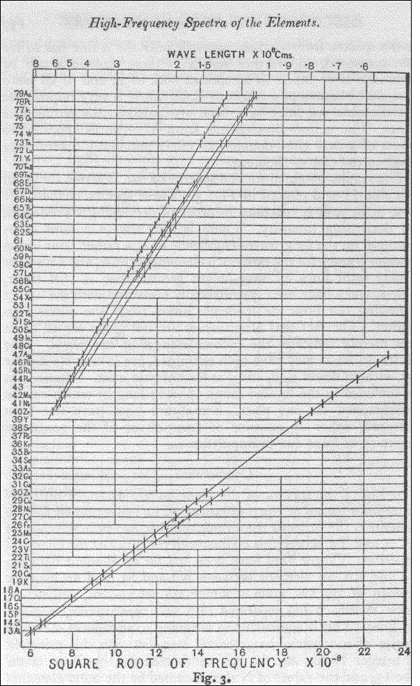

“Es evidente que Q [una función espectroscópica de la frecuencia] aumenta en una cantidad constante a medida que pasamos de un elemento al siguiente, siguiendo para ello el orden químico de los elementos de la tabla periódica […] Sin embargo en tanto que Q aumenta uniformemente, los pesos atómicos varian de una manera aparentemente tan arbitraria, por lo que una excepción en su orden parece no tener nada de sorprendente. Tenemos aquí una prueba de que en el átomo hay una cantidad fundamental que va aumentando regularmente a medida que vamos pasando de un elemento al siguiente. Dicha cantidad sólo puede ser la carga ene l núcleo positivo central, de cuya existencia tenemos ya una prueba definitiva…”
Moseley