La medida
Hacia el triunfo de la medida
“La primacía de la experimentación sobre las especulaciones imaginativas junto con la aplicación de las técnicas matemáticas se abre la esperanza al progreso”
Bacon (1214 – 1292)

“Nadie podrá entender el gran libro del universo si ignora su lenguaje, que es el lenguaje matemático”
Galileo (1564 – 1642)

Galileo Galilei, (1564 – 1642)
-
Estudia el comportamiento de los cuerpos durante su caída
“ Protagoniza espectacularmente la aplicación de las matemáticas y las mediciones cuidadosas a la física”
Asimov
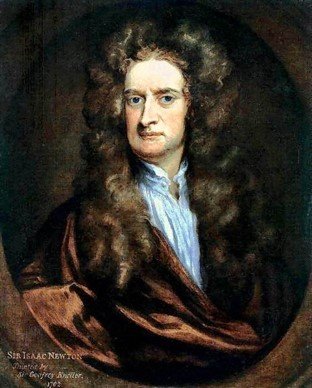
Isaac Newton
(1642 – 1727)

-
Introduce las tres leyes del movimiento.
-
Teoría de la gravitación.
-
Utiliza el cálculo infinitesimal
“Con Newton, la revolución científica alcanzó su clímax. Ya no quedaba ningún problema pendiente, ni de los griegos ni de la antigüedad en general. Europa occidental los había superado ampliamente, y nunca más volvería a mirar hacia atrás”
Asimov
¿Y LOS QUÍMICOS?
La experimentación


Jean Baptista Van Helmont
(1577 – 1644)

-
El más prominente discípulo de Paracelso.
-
Representa la transición de la alquimia a la química.
-
Rechaza los elementos y principios de Paracelso y las doctrinas de Aristóteles. El creía que los verdaderos elementos eran agua y aire.
-
Basa su teoría en el “experimento del sauce”

- Defendía la existencia de un “alcahesto” o disolvente universal.
-
Es el primero en estudiar los aires y vapores que el mismo producía.
-
Aplica a los vapores la palabra “chaos”, que pronunciado en lengua flamenca se convierte en gas

Cita:
-
“gas carbonum”: el obtenido quemando carbón vegetal.
-
“gas sylvester”: El obtenido de la fermentación del mosto o de la reacción del ácido acético sobre un carbonato.
-
“gas pingüe”: Inflamable, formado por una destilación seca de la madera.


Es el primero que presta atención a las técnicas de medición precisa.
Condena la astrología porque no nos conviene profanar los secretos de Dios, declara formalmente que sólo son capaces de conocer la verdad aquellos que a los ojos de nuestro señor merecen conocerla, y que no debe admitirse como verdadero ningún resultado que no sea conforma a las enseñanzas de la Biblia.



~ 1643, E. Torricelli
~ 1648, Blaise Pascal

~ 1638, Galileo: Es el primero en intentar medir la densidad del aire
~ 1643, E. Torricelli, (1608-1647): Inventa el barómetro. Así al nivel del mar el aire puede soportar una columna una columna de mercurio de 760 mm de altura
~ 1648, Blaise Pascal (1623-1662). Confirma que la presión del aire en las montañas es menos que la presión a nivel del mar.




¿Por qué la columna de mercurio no se cae?


Otto von Guericke (1602 – 1686): en 1654 inventa la primera bomba de vacío
- Durante este año él conduce una de las grandes demostraciones científicas de todos los tiempos.
Daniel Sennert, (1572-1637): Declara explícitamente que todas las sustancias corruptibles deben componerse de cuerpos simples “de los que provienen y en los que se resuelven”




ROBERT BOYLE
(1627 – 1691)
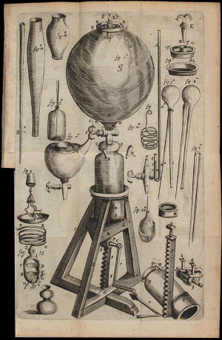

~ 1662: “New Experiment physico-mechanical Touching Air”
- Presenta la relación entre la presión y el volumen de un gas.
- Mejora la bomba de vacío.
~ 1680, Edme Mariotte (1630-1684): Especifica que la temperatura debe mantenerse constante.
Ley de Boyle - Mariotte


http://www.westga.edu/~chem/courses/xids/lectures/Ind&ChemRev/img016.GIF




http://dspace.dial.pipex.com/spelman/highlights/turret.jpg

~ 1661: “The Sceptical Chymist”
- Suprime la primera silaba del término “alchemist”
- Elemento: Un elemento es lo que no se puede descomponer
¿Qué implicaciones tiene esta definición?


“En una mezcla los cuerpos que la componen conservan cada uno sus propiedades características y se pueden separar fácilmente los unos de los otros. En una combinación las partes constituyentes pierden sus propiedades primitivas y son inseparables.”

-
Introduce el uso del nitrato de plata para identificar cloruros.
-
Gas de amoniaco para localizar el gas clorhídrico.
-
Sulfuro amónico o licor de Boyle.
-
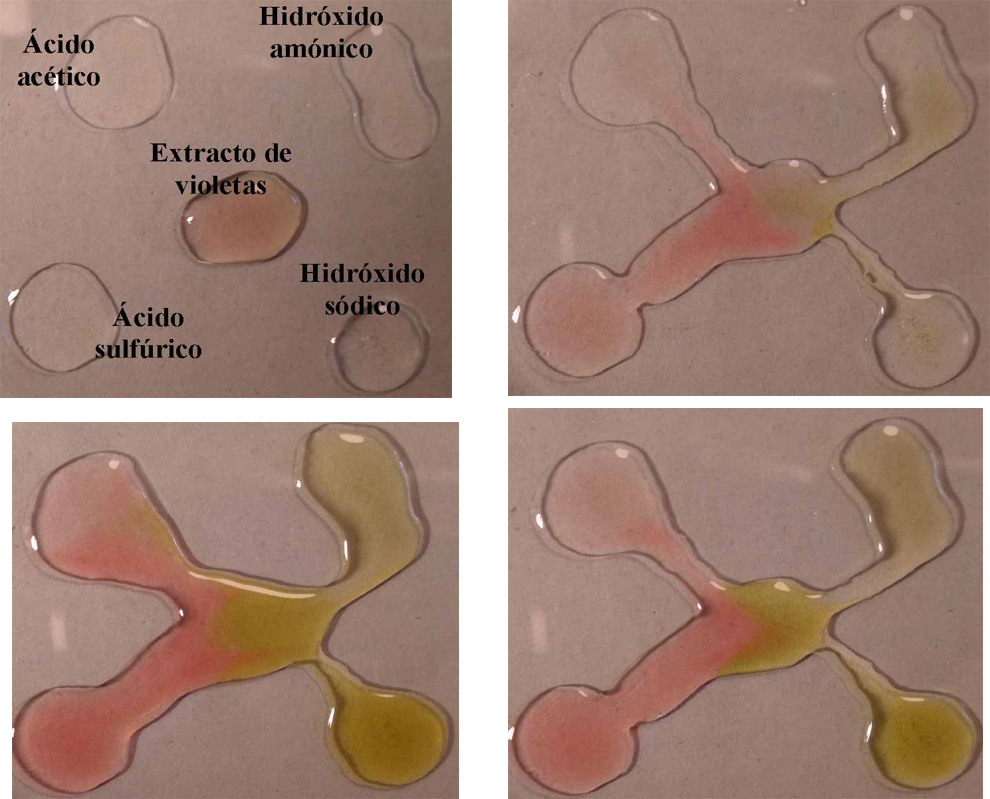
Jarabe de violetas.

Jarabe de violetas: primer indicador ácido - base

- Estaba convencido de que los metales no eran elementos y que un metal podía convertirse en oro.
- 1689, Pidió al gobierno británico que aboliese la ley contra la fabricación alquimista del oro.
- 1680, Preparó fósforo, embargo cinco o diez año antes Hening Brand lo había conseguido. vídeo


¿A partir de que sustancia obtuvieron el fósforo?

- Descubre un espíritu nitroso ácido que ataca al hierro.
- Calienta nitrato de potasio en presencia de azufre en una campana a la que la había hecho vacío.
- Enciende un vela en una campana volcada sobre un recipiente de agua…
- Calienta limadura de hierro al aire húmedo…
John Mayow (1641-1679)

“el aire es absolutamente necesario para que mantenga la llama, sino su parte más activa, la más móvil, ya que cuando la llama se apaga en un espacio cerrado, todavía queda mucho aire que no ha sido destruido por la combustión”
1674:

1675, publica “Cours de Chymie”
- Contenía una gran multitud de instrucciones prácticas sobre la manera de preparar medicamentos, tintas simpáticas, barnices e incluso venenos. Así mismo la preparación de productos de belleza.
- Entrevé las diferencias entre metales y metaloides.
- Sigue sin embargo vinculado a las viejas concepciones alquimistas.
Nicolás Lémery (1645-1715).

La teoría del Flogisto

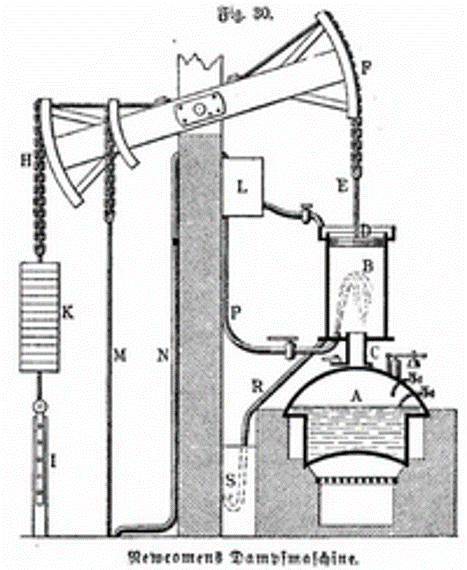
- 1700: Thomas Savery (1670 -1715): Construye la primera máquina de vapor.
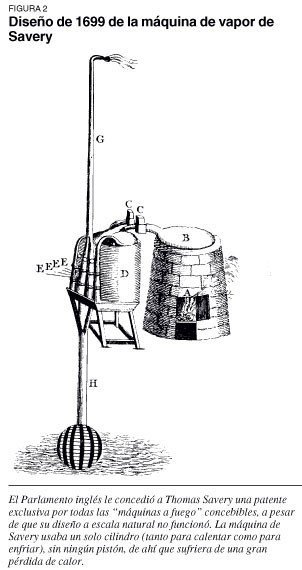
- Thomas Newcomen (1663-1729): Junto con Savery, construyen una máquina de vapor capaz de trabajar a baja presión.
- Finales del S. XVIII, James Watt (1736-1819): Mejora la máquina de vapor y la transforma en algo realmente práctico.


https://sobrehistoria.com/todo-sobre-la-revolucion-industrial/

“Por primera vez la humanidad ya no tendría que depender más de sus propios músculos ni de la fuerza animal. Nunca más habría de estar a expensas de la fuerza favorable o desfavorable del viento, ni de la energía localizada en algunos puntos del agua corriente”
Asimov

Comienzo de la Revolución Industrial

https://sobrehistoria.com/todo-sobre-la-revolucion-industrial/

http://peoplescharter.org/pit-closures-were-a-labour-policy-wilson-shut-twice-as-many-as-thatcher/

¿ Por qué algunas cosas arden y otras no?
¿ Cuál es la naturaleza de la combustión?

1669: Johann J. Becher, (1635-1682):
- Suponía que los cuerpos estaban constituidos por aire, agua y tres tierras.
Terra Pinguis, terra mercurialis y terra lapidia
- Imagina que las sustancia inflamables están constituidas por el tipo especial de tierra, “terra pinguis”

1697, Georg E. Stahl, (1660 – 1734)
-
Acepta la doctrina que las sustancias combustibles contienen el principio de inflamabilidad o terra pinguis de Becher.
-
Stahl le da el nombre de flogisto (hacer arder) a este tipo de tierra

~1630: Jean Rey, Calcina 2 libras y 6 onzas de estaño y obtenía 2 libras y 13 onzas de residuos.
-
¿ Cómo explicar esto?
“ los metales transformándose en cal aumentan su peso”
“Como el flogisto es más ligero que el aire, tiende a levantar el cuerpo del que no se ha desprendido aún y disminuye su peso”
En consecuencia el cuerpo que ha perdido flogisto se hace más pesado

Los metales eran compuestos que contenían flogisto en combinación con óxidos metálicos (cales)
Cuando el óxido es calentado con una sustancia rica en flogisto, tal como carbón vegetal, la cal toma nuevamente flogisto y regenera el metal

¿ Cómo explicar la presencia de la llama?
¿ Qué sucede con la combustión de la madera?
¿ Qué naturaleza tenía entonces el flogisto?


Los gases y el triunfo de la medida

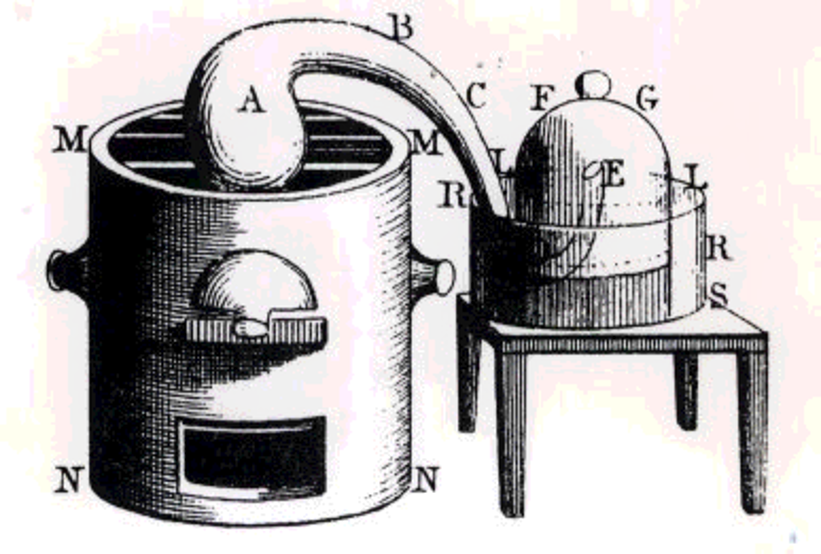
Stephen Hales (1667 – 1761)
Inventa una forma sencilla de recoger gases, “aires”
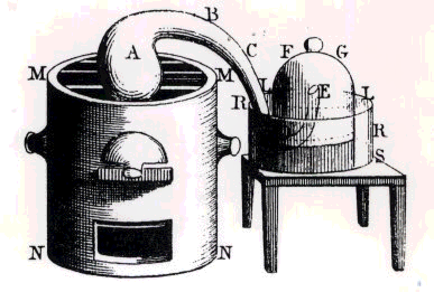

La Química Pneumática




La Química Pneumática

Joseph Black
(1728 – 1799)

Daniel Rutherford
(1749 – 1819)

Joseph Black (1728 – 1799)
- Estudia el calentamiento de la magnesia alba, carbonato de magnesio.
- Al calentarlo se liberaba un gas y dejaba un residuo, cal (óxido de magnesio).
- Sin embargo, este gas liberado podía recombinarse con la cal para formar de nuevo la magnesia alba.

-
Al aire que se liberaba lo llamo “aire fijado”.
-
Encuentra que ese “aire fijado” era el mismo “gas sylvester” de van Helmont.
-
En su tesis estudia la acidez del estomago y el valor de la magnesia como antiácido.
-
Observa que una vela no puede arder en presencia de este aire fijado

1772, Daniel Rutherford (1749 – 1819)
- Metió un ratón en un volumen cerrado hasta que murió.
- Encendió luego una vela en el gas que quedaba hasta que se apagó.
- Pasó luego el gas a través de cal, óxido de calcio o de magnesio

Rutherford y Black trataron de explicar este fenómeno de acuerdo a la teoría del flogisto
Rutherford llama al gas que había aislado. “gas flogisticado”

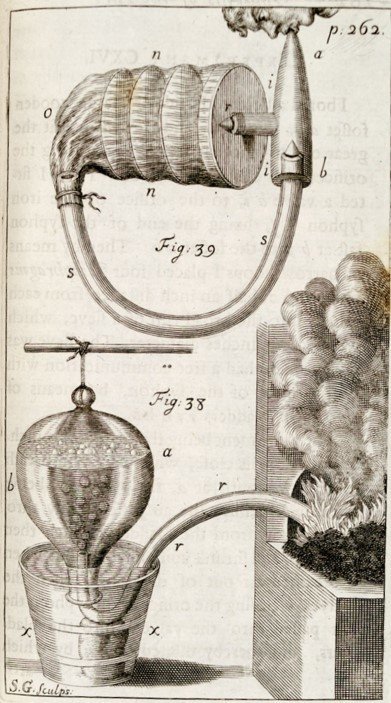
Henry Cavendish
(1731 – 1810)

“El más rico de los sabios y el más sabio de los ricos”
Biot
1766 – primera publicación en Philosophical Transactions of the Royal Society

- Aísla el gas producido por la adición de ácidos a metales como el cinc y el estaño.
- Llega a la conclusión que la cantidad de gas producido no dependía de la naturaleza del ácido (clorhídrico o sulfúrico) o su cantidad, sino de la cantidad de metal.
- El suponía entonces que los metales estaban perdiendo flogisto y se lo cedían al aire.

- Este gas que además era inflamable y que parecía escaparse del metal, lo llama “Aire inflamable”.
- Es el primero en medir el peso de volúmenes determinados de diferentes gases: densidad de los gases.
- Encuentra que la densidad del “aire inflamable” es 10 8/10 más ligero que el aire común.
- Así mismo que la densidad del aire es 850 veces menor que la del agua. Vídeo
- Cavendish creyó en la posibilidad de haber aislado el flogisto.

-
1784, Publica sus trabajo sobre la composición del agua basado en sus experimentos de ignición del aire inflamable.
-
El informa que cuando se extrae del aire por reacción química, el aire desflogisticado y el aire flogisticado, queda una cantidad pequeña pero reproducible de un gas no reactivo.
-
Cavendish se anticipa al descubrimiento 110 años después de los fases inertes, gracias a Rayleigh y Ramsay

Joseph Priestley
(1733 – 1804)



Joseph Priestley (1733 – 1804)
- Investiga las propiedades del “aire fijado” gracias a su cercanía con una cervecería.
- Se da cuenta que una parte de “aire fijado” se disolvía en agua y le confería a esta un agradable sabor ácido.
- Se le puede considerar como el padre de las bebidas gaseosas.
- El hecho de que el “aire fijado” sea soluble en agua, hace que Prestley inicie a recoger gases sobre mercurio.
- 1772, logra estudiar: “Aire inflamable”, “aire ácido”, “aire nitroso”.



1774, Calentando mercurius calcinatus obtiene mercurio y un gas.
Este gas tenía las siguientes propiedades:
- Los combustibles ardían con mayor fuerza y brillo que con el aire común.
- Un rescoldo que fuera introducido en un recipiente con dicho gas ardía con llama.

- Un ratón era particularmente activo y juguetón en este gas.
- El mismo Priestley se sintió “ligero y cómodo” al respirar este gas.
- A este gas lo llamo “aire desflogisticado”.
- Estudió otros gases como “aire alcalino”, “aire del ácido vitriólico”

La Química en Suecia

- Estudia un mineral azul semejante a los minerales de cobre que al ser tratado de forma habitual no daba cobre.
- Brandt logra demostrar que el mineral no contenía cobre, sino un nuevo metal
- Lo llamo cobalto en honor a kobolds, gnomos o espíritus de la tierra.
George Brandt (1694 – 1730)

1775, Tobern Olof Bergman (1735 – 1784)
- Es el primero en reconocer el efecto del calor sobre la afinidad.
- Indica que algunas reacciones necesitan un exceso de reactivo para que la reacción se complete.
- Preparó varias tablas donde se registraban las diferentes afinidades.


Carl Wilhelm Scheele
(1742 – 1786)



CARL WILHELM SCHEELE, (1742 – 1786)
“Pocos , si no ninguno, han descubierto tantas sustancia nuevas como Scheele”
Leicester and Klickstein
- Se inició como aprendiz de boticario y luego fue protegido de Bergman en 1770.
- Cree en la teoría del flogisto

- Descubre ácidos como: ácido tartárico, cítrico, benzoico, málico, oxálico y gálico del reino vegetal.
- Descubre los ácidos láctico y úrico del reino animal y el ácido molíbdico y arsenioso del reino mineral.
- Preparó e investigó tres gases: Fluoruro de hidrogeno, sulfuro de hidrogeno y cianuro de hidrogeno.

Scheele razonaba lo siguiente:
- Cuando una sustancia arde pierde flogisto, el cual se combina con el aire incrementándole su masa y disminuyendo su volumen. De esta forma el encuentra que el aire que queda, “aire mefítico”, era menos denso que le aire común.
- Hay un componente del aire “aire fuego” que combinado con el flogisto produce “calor”, una clase de fluido etéreo.
- De esta forma Scheele decide obtener el “aire fuego”

1771 – 1772, Scheele obtiene “aire fuego” a partir de:
- Calentamiento del dióxido de manganeso, Magnesia nigra.
- Calentamiento del óxido de mercurio, Mercurius calcinatus.
- Calentamiento del nitrato de magnesio, salpetréa.
- Calentamiento de aqua fortis.

- 1775, Scheele trabaja en su libro “Chemical Observations and Experiments on Air and Fire”.
- 1777, el libro es publicado. La demora se debió a que el editor esperaba la introducción Bergman al libro.
- 1772, Rutherford informa a Black sobre la obtención de “aire flogisticado”.
- 1774, Priestley publica en su libro “Experiments and Observations on Different Kinds of Air”, la preparación de oxígeno.
- 1774, Scheele publica un artículo anunciando la obtención de cloro, el cual lo concibió como un compuesto. Sería Davy en 1810 quien afirmaría que era un elemento.

El triunfo de la medida

ANTOINE LAVOISIER



- 1774, Opuscules Chimiques et Physiques
- 1787, Méthode de Nomenclature chimique
- 1789, Traité Élémentaire de Chimie
Antoine Laurent Lavoisier (1746 – 1794)


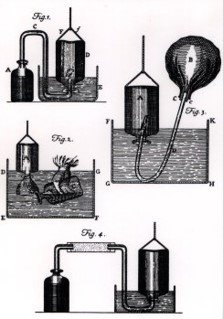
1770, Hierve durante 101 días agua en un aparato que condensaba el vapor y lo devolvía al matraz.
1772, Demuestra que los diamantes se pueden descomponer con calor fuerte y que el aire era necesario para llevar a cabo el proceso. La formación de “aire fijado”” lleva Lavoisier a concluir que el diamante estaba estrechamente ligado al carbón.





- 1772, Calienta estaño en un recipiente lleno de aire y herméticamente cerrado.
- 1777, Analiza el aire mediante mercurio caliente.
- 1784, Lavoisier junto con su colega Meusnier, realiza la descomposición del agua por reducción del vapor en presencia de hierro calentado al rojo.





http://dewey.library.upenn.edu/sceti/smith/

PRINCIPO DE CONSERVACION DE LA MASA

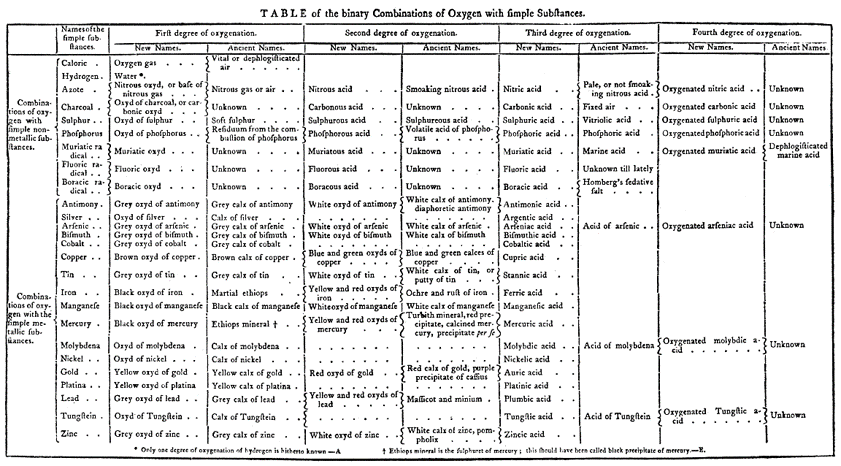
- 1788, publica con ayuda de Claude Berthollet, Guyton de Morveau y Antoine Fourcroy: Méthode de Nomenclature chimique , el cual fue completado en 1789 con el libro: Traité Élémentaire de Chimie.
- Traité Élémentaire de Chimie es una obra que señala “ una etapa inmortal en la historia de la civilación ”
Le Chatelier



http://www.ul.ie/~childsp/CinA/Issue43/cianct6.jpg

http://www.ul.ie/~childsp/CinA/Issue43/cianct6.jpg

- Propone que el aire no es una sustancia simple sino una mezcla de dos gases en una proporción 1 a 4, un quinto del aire era el aire desflogisticado.
- Esta era la porción del aire que se combinaba con los materiales en la combustión o en el proceso de enmohecimiento
- Esta era la sustancia que se transfería desde el mineral al carbón.



- Da al gas desflogisticado el nombre de Oxígeno, productor de ácidos. Pues Lavoisier creía que el oxígeno era el elemento esencial en todos los ácidos
- Al aire flogisticado de Rutherford, las restantes cuatro quintas partes del aire, lo llamo Azoe, sin vida. Más tarde lo llamaría nitrógeno o formador de salitre

-
Lavoisier junto con su colaborador Pierre Simon de Laplace, intentan medir el oxígeno tomado y el dióxido de carbono liberado por los animales. Los resultados fueron desconcertantes pues parte del oxígeno inhalado no aparecía en el dióxido de carbono exhalado.
-
Lavoisier llama al aire inflamable de Cavendish, Hidrogeno, formador de agua.

Considera de esta forma que la sustancia de los alimentos y de los tejidos vivos contenían una combinación de carbono e hidrogeno, de manera que cuando se inhalaba aire, el oxígeno se consumía en la producción de dióxido de carbono y también en la producción de agua.

“Bastó un instante para cercenar esa cabeza y quizá un siglo no baste para producir otra igual”
J. Lagrange
video
