Átomos
Las leyes y el atomismo
INICIOS DEL ATOMISMO
- Leucipo, ~ 440 a.C.
- Demócrito, 470 – 380 a.C.
- Epicuro, 342 – 270 a.C.
- Tito Lucrecio Caro, 95 – 55 a. C.
- Robert Boyle, 1627 - 1691
ESTEQUIOMETRIA
Jeremías Benjamín Richter
(1762 – 1807)

Jeremías Benjamín Richter, (1762 – 1807)
1792 – 1794: Publica sus investigaciones.
- Inventa el término estequiometria: Ciencia de medir las proporciones cuantitativas o las proporciones de las masas en la que los elementos químicos están relacionados entre sí.
- Cualquier partícula infinitamente pequeña de masa de un elemento tiene una parte infinitamente pequeña de fuerza química de atracción de afinidad…
- …sí dos partes de limo requiere cinco partes de ácido muriático, seis partes de limo van a requerir 15 partes del mismo ácido.
- Cuando dos soluciones neutras se mezclan y luego tiene lugar una descomposición, los nuevos productos resultantes casi sin excepción serán neutros, pero si las soluciones de uno o ambos no son neutras antes de la mezcla, los productos después de la mezcla no serán neutros.
- Deduce que la neutralidad implica que cuando un compuesto AB se adiciona a otro CD en tal proporción que A se combina exactamente con C, B y D deben también combinarse exactamente.
- Richter extiende este concepto a la determinación de las cantidades de ácido que pueden neutralizar una cantidad dada de base y viceversa.
- Es de esta forma que Richter determina por primera vez los “pesos equivalentes”.
Por cada 1000 partes de ácido sulfúrico:
¿ LA PROPORCIÓN DE LOS ELEMENTOS EN UN COMPUESTO ES FIJA O DEPENDE DEL MÉTODO DE PREPARACIÓN ?
Essai de Statique Chimique
“ Los químicos impresionados por las proporciones determinadas que encontraban en diferentes compuestos, han considerado frecuentemente como una propiedad general de los compuestos la de constituirse en proporciones constantes ”
Claude Louis Berthollet
(1748 – 1822)
- Berthollet expone que la afinidad no es una fuerza absoluta sino que es relativa y que factores como solubilidad y volatilidad juegan un papel importante en el curso de las reacciones químicas.
- De sus resultados encuentra que la composición de ciertos compuestos puede variar entre pequeños límites.
Joseph Louis Proust
(1754 – 1826)
- 1799, demuestra que compuesto como el carbonato de cobre, contenía cobre, carbono y oxígeno en proporciones definidas en peso, independientemente de cómo se hubiera preparado o como fuera sido aislado de las fuentes naturales. La proporción era siempre

-
1808, Proust logra demostrar que lo observado con el carbonato de cobre se cumplía con otros compuestos.
-
Proust, demuestra que Berthollet, al presentar la evidencia de que ciertos compuestos variaban en su composición de acuerdo al método de preparación, se equivocó por culpa de los análisis poco precisos y por el uso de productos que habían sido purificados insuficientemente.
Ley de las Proporciones Definidas o Ley de Proust
El renacer del Atomismo

John Dalton
(1766 – 1844)
¿cuál es la razón para que al soplar una bebida caliente esta se enfrié?

1789 – 1801: Define la presión de vapor del agua y se da cuenta que cuando al agua se adiciona aire seco, la presión total es la suma de la presión del aire seco y la presión de vapor del agua, es decir los gases actúan de forma independiente.
1789 – 1801: Define la presión de vapor del agua y se da cuenta que cuando al agua se adiciona aire seco, la presión total es la suma de la presión del aire seco y la presión de vapor del agua, es decir los gases actúan de forma independiente.
Ley de las Presiones Parciales de Dalton
- Muestra que los gases expanden su volumen linealmente cuando se calientan, conclusión a la que llego Charles en 1783.
- Dalton entonces aplica la Ley de Conservación de la Masa de Lavoisier y la Ley de las composiciones definidas de Proust a lo que se conoce como su teoría atómica.
- ~ 1804, A System of Chemistry, editado por Thomas Thomson, incluye la teoría atómica de Dalton.
TEORÍA ATÓMICA DE DALTON, 1803.
- Toda la materia esta compuesta de partículas diminutas, indivisibles e indestructibles , átomos.
- Existen varias clases de átomos, característicos de los diferentes elementos.
- Los átomos de un elemento dado tienen todos el mismo peso.
- Los átomos de diferentes elementos tienen diferentes pesos.
-
Los átomos se combinan en varias relaciones de pequeños números enteros para formar compuestos
-
Cuando dos elementos se unen para formar una sustancia, se presume que un átomo del uno se une con un átomo del otro a menos que alguna razón pueda ser asignada para suponer lo contrario.
-
De esta forma el agua está formada por la combinación de un átomo de oxígeno con un átomo de hidrógeno . El amoniaco está formado por la combinación de un átomo de hidrógeno con un átomo de azoe.
-
A partir de saber que el agua estaba compuesta de 85 2/3 de oxígeno y 14 1/3 de hidrógeno establece que la relación oxígeno – hidrógeno es 6 a 1.
-
Le asigna al hidrógeno el peso de 1 y en consecuencia el peso del oxígeno será 6.
-
Del análisis de amoniaco se encontró que consistía de 80 partes de azote y 20 partes de hidrógeno. Por tanto el peso del azote será 4.

http://www.meta-synthesis.com/webbook/35_pt/jdsymbols.jpg
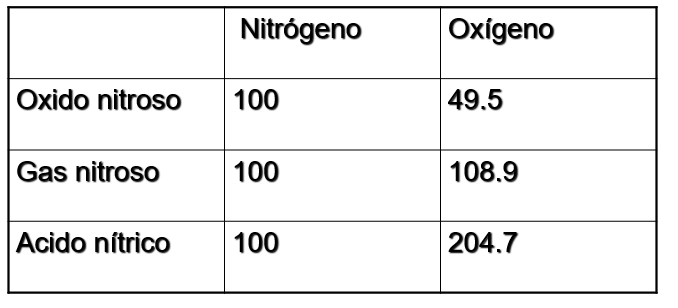
1801 – 1804, Dalton realiza experimentos haciendo reaccionar oxígeno y gas nitroso.
- El encontraba que cierta cantidad de oxígeno se combinaba con diferentes proporciones de gas nitroso, dependiendo de cómo se llevara a cabo el experimento.
De esta manera supone:
- El gas nitroso debe estar compuesto por un átomo de oxígeno y un átomo de azote.
- El óxido nitroso debe formarse por la adición de un átomo de gas nitroso y un átomo de azote.
- Ácido nítrico consistirá de gas nitroso y oxígeno
LEY DE LAS PROPORCIONES MÚLTIPLES

https://reich-chemistry.wikispaces.com/file/view/Daltons_symbols.gif
- En 1808 Dalton modifica sus valores y reporta nuevamente su tabla de pesos atómicos
- 1808 – 1810: A New System of Chemical Philosophy: Asigna símbolos para representar los elementos y los compuestos.
- Parte de su tabla de pesos atómicos fue confeccionada gracias a los trabajos de Davy, quien estaba trabajando con óxidos metálicos.
La magia de la electricidad

William Gilbert
1540 – 1603
-
William Gilbert, 1540 – 1603: Demuestra que además del ámbar existen sustancias que al ser frotadas adquieren la propiedad de atraer objetos ligeros.
- 1600: Sugiere que las sustancias de este tipo se llamen eléctricas del griego ámbar
- Es decir una sustancia que adquiere el poder de atraer objetos se dice que lleva carga eléctrica o que contiene electricidad.

De Magnete
Tratado sobre el Magneto
Charles F. de Cisternay du Fay
1698 – 1739
- 1733: Descubre que hay dos tipos de carga eléctrica :
- Electricidad vítrea: surgía del vidrio
- Electricidad resinosa: surgía del ámbar
- Las sustancias de tipo contrario se atraían mientras las sustancias de tipo distinto se repelían.


Benjamín Franklin
1706 – 1790
- 1740: Sugiere la existencia de un solo fluido eléctrico de tal forma:
- Si poseía una cantidad de fluido eléctrico mayor al normal: Carga positiva, se la asigna al vidrio.
- Si poseía una cantidad de fluido eléctrico menor al normal: Carga negativa, se la asigna al ámbar.

Liugi Galvani (1737 – 1798):
- Electricidad animal
- Fuerza vital
- Naturaleza del impulso nervioso es eléctrica

Alessandro Volta
1745 – 1827



Text
Creía que la electricidad se originaba por la unión de dos metales
Considera luego que la cantidad de “fluido eléctrico” puede aumentarse poniendo en contacto varios metales.
Sin embargo el descubre que lo anterior se lograba solo si se humedecían las uniones.
Descubre la pila voltaica
- Volta destina sus experimentos con sus aparatos a cuestiones de naturaleza fisiológica
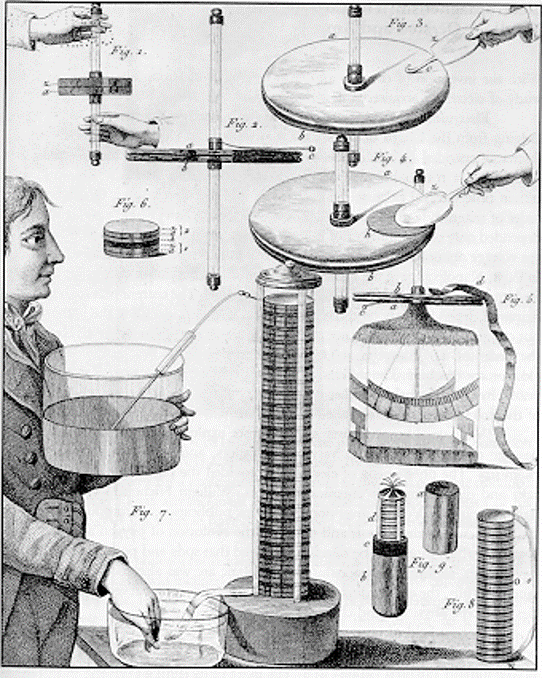
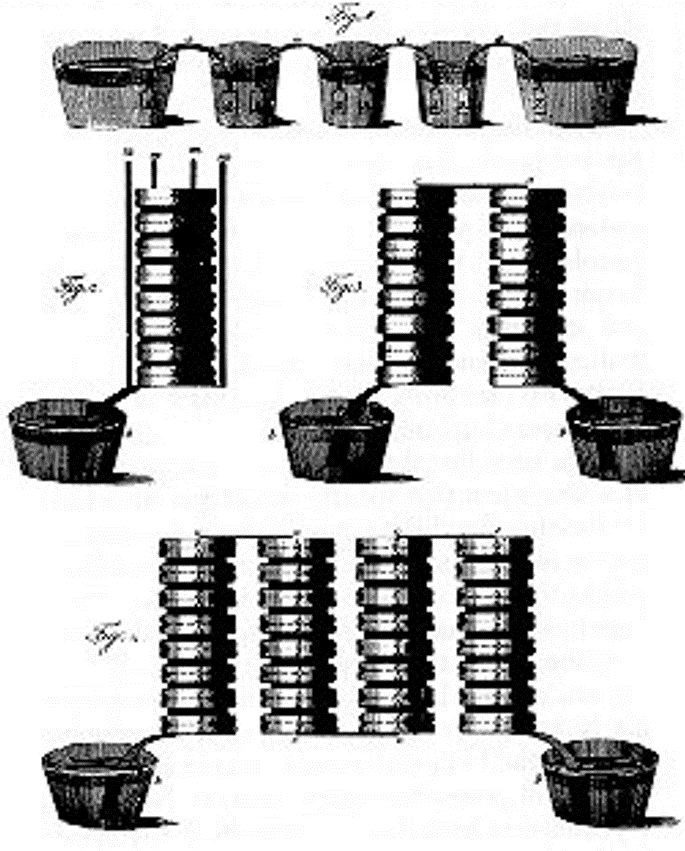
http://dibinst.mit.edu/BURNDY/OnlinePubs/Volta/chapter8.html

Videos: 1
Energía química se puede convertir en energía eléctrica: Batería eléctrica


W. Nicholson
A. Carlisle
- 1800 – W. Nicholson y A. Carlisle: Realizan la primera electrolísis por medio de una pila: Obtienen hidrogeno y oxígeno a partir de agua
Energía eléctrica se puede convertir en energía química

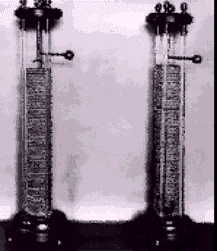
Demuestran que una corriente eléctrica
puede provocar una reacción química
El volumen del hidrógeno producido el
doble del de oxigeno
Tomando como referencia el hidrógeno ¿cuál debería ser el peso del oxígeno?

Humphry Davy
(1778 – 1819)
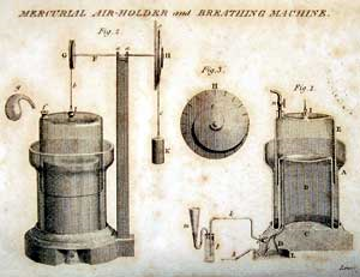
1799: Calienta nitrato de amonio y obtiene óxido nitroso puro, sus resultados son publicados en:
Researches, Chemical and Philosophical, Chiefly Concerning Nitrous Oxide, Or Dephlogisticated Nitrous Air and Its respiration. (1800)

1806: “On some Chemical Agencies of Electricity”
- Reconoce que en la electricidad se tiene un agente capaz de descomponer las combinaciones más estables.
1807:
- Al fundir potasa (carbonato de potasio) y pasar una corriente, obtuvo un metal al que llamo Potasio
- Al fundir carbonato de sodio y pasarle una corriente obtuvo otro metal al que llamo sodio.
1806: “On some Chemical Agencies of Electricity”
- Reconoce que en la electricidad se tiene un agente capaz de descomponer las combinaciones más estables.
1807:
- Al fundir potasa (carbonato de potasio) y pasar una corriente, obtuvo un metal al que llamo Potasio
- Al fundir carbonato de sodio y pasarle una corriente obtuvo otro metal al que llamo sodio.
1808:
- Por medio de electrólisis prepara por primera vez bario de la baritina, magnesio de la magnesia, calcio de la cal y estroncio de la estroncita.
- Utilizando el fuerte poder reductor de potasio, Davy prepara Boro.
1811:
- Davy demuestra que el gas ácido oximuriático, descubierto por Scheele, en realidad es un elemento, el cloro
1806:
- “On some Chemical Agencies of Electricity”
- Reconoce que en la electricidad se tiene un agente capaz de descomponer las combinaciones más estables.
1807:
- Potasio
- Sodio
- Bario
- Magnesio
- Estroncio
- Bario*

Humphry Davy (1778 – 1819)

Michael Faraday, (1791 – 1867)
- 1812: Davy lo recibe como asistente de laboratorio.
- 1815: Inicia a presentar conferencias y se hace miembro de la Royal Institution of Great Britain
- 1820: Escribe su primera publicación, la cual es editada por el propio Davy.
-
1825: Descubre el benceno, butileno, hexacloroetano, tetracloroetileno, y dos isómeros de los ácidos naftalensulfónicos.
-
Estudia la licuefacción de los gases mediante enfriamiento y presión, obteniendo por primera vez cloro en estado líquido.
-
1833: Faraday descubre la rotación de la luz polarizada en presencia de campos magnéticos
-
1831 – 1835; Publica una serie de artículos llamados “ Experimental Researches in Electricity” en “Philosophical Transactions of the Royal Society”
-
1833 – 1840: Aparecen sus estudios más importantes acerca de electrólisis y celdas galvanicas
Equivalente electroquímico:
“ El poder químico, al igual que la fuerza magnética, esta en proporción directa a la cantidad absoluta de la electricidad que pasa”
“Grado de electricidad”
“Cantidad de electricidad necesaria para liberara 0.01 pulgada cúbica de gas seco, corregido a temperatura y presión determinados”
- Al aparato utilizado para determinar la cantidad de electricidad: Volta – electrometro, llamado más tarde voltámetro y desde 1902 conocido como coulómetro
- Faraday descubre que el hielo es un aislante eléctrico y que las sales también lo son, mientras que fundidas son buenos conductores de la electricidad.
-
Faraday: encuentra que la masa equivalente del Sn en (cloruro de estaño II) era 57.9, valor que coincide con el actual, 118.7 / 2 = 59.35.
-
En colaboración con W. Whewell, Faraday establece los términos: electrodo, ánodo, cátodo, ion, anión, catión, electrolito y electrólisis.
-
Se considera el inventor del tubo de ensayo
Las leyes de la Electrólisis
- La masa de sustancia liberada en un electrodo durante la electrólisis es proporcional a la cantidad de electricidad que se hace pasar a través de la solución
- El peso de sustancia liberada por una cantidad dada de electricidad es proporcional al peso equivalente del metal
1832: leyes de la electrólisis:
Tomando cloruro de estaño y realizando la electrólisis correspondiente Faraday obtiene:
- Peso del electrodo negativo: 20 granos
- Peso de la aleación: 23.2 granos
- Peso de estaño producido en el cátodo debido a la corriente eléctrica: 3.2 granos.
- Cantidad de oxígeno e hidrogeno obtenidos en voltámetro: 3.85 pulgadas cúbicas.
1832: leyes de la electrólisis:
Faraday previamente ha establecido:
- 100 pulgadas cúbicas de oxígeno e hidrógeno, en las proporciones para formar agua, pesan 12.92 granos.
¿ Cuál es el equivalente químico del estaño ?
Las ideas electroquímicas y los pesos atómicos

JÖNS JACOB BERZELIUS
1779 - 1848
1819: Enuncia su teoría electroquímica o teoría dualística:
- Basado en los trabajos de Davy y de sus propias experiencias propone:
“En todas las combinaciones químicas hay neutralización de electricidades opuestas y esta neutralización produce fuego en la misma forma en que esta se produce en la jarra eléctrica, la pila eléctrica, y el trueno…”
Divide los cuerpos en electropositivos y electronegativos.
“Los cuerpos simples, los cuales pertenecen a la primera clase, al igual que sus óxidos, siempre tendrán electricidad positiva cuando ellos se encuentren con cuerpos simples que pertenezcan a la segunda clase…”
Por ejemplo: “El azufre y el arsénico son positivos respecto al oxígeno y negativo respecto a los metales”
-
Berzelius considera al oxígeno como el elemento más electronegativo de tal forma que su variación eléctrica es invariable.
-
Los demás cuerpos varían ya que pueden ser negativos con respecto a un cuerpo o positivos respecto a otros.
Los Símbolos Químicos
Propuesta de Berzelius:
El signo químico se toma de la primera letra del nombre latino de la sustancia elemental. Si tienen la misma letra se procede de la siguiente manera:
- Para los metaloides se empleará únicamente la letra inicial.
- Para los metales se emplearan las dos primeras letras de la palabra.
- Si las dos primeras letras son comunes a los dos metales, se adiciona a la letra inicial la primera consonante que no sea común
Ejemplos:
S = sulphur; Si = Silicium; St = Stibium; Sn = Stannum,
C = carbonicum; Co = Cobaltum; Cu = Cuprum. Etc.
¿ Y los compuestos ?
“El símbolo químico representa siempre un volumen de sustancia. Cuando sea necesario indicar varios volúmenes, se realizará adicionando el número de volumenes. Ejemplo:
Oxidum cuprosum: Cu + O
Oxidum cupricum: Cu + 2O
Acido sulfúrico: S + 3O
Acido carbónico: C + 2O
- Sulfato de cobre:
- Persulfato de cobre:
¿Cómo sería el caso de una sal?
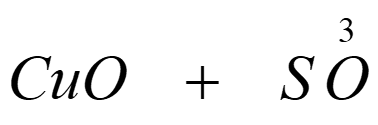
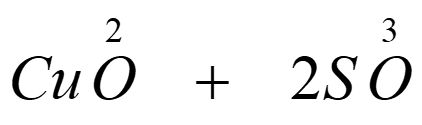
- Mejora las técnicas para análisis químico, determinando la composición de un gran número de compuestos.
- Verifica la ley de las proporciones definidas y la ley de las proporciones múltiples.
- 1826: Mediante sus métodos determina la composición correcta de las sustancias más comunes logrando construir una tabla de pesos atómicos.
LOS PESOS ATÓMICOS
Pierre Louis Dulong
(1785 – 1838)

http://vlp.mpiwg-berlin.mpg.de/technology/search?-format=search&-op_img.exportCaption=grep&img.exportCaption=%5Bc%7Ck%5Dalorimeter
Pierre Louis Dulong, (1785 – 1838)
- Descubre el tricloruro de nitrógeno.
- Pierde un ojo y dos dedos en su investigaciones peligrosas.
- Estudia los óxidos de nitrógeno y el ácido hipofosforoso
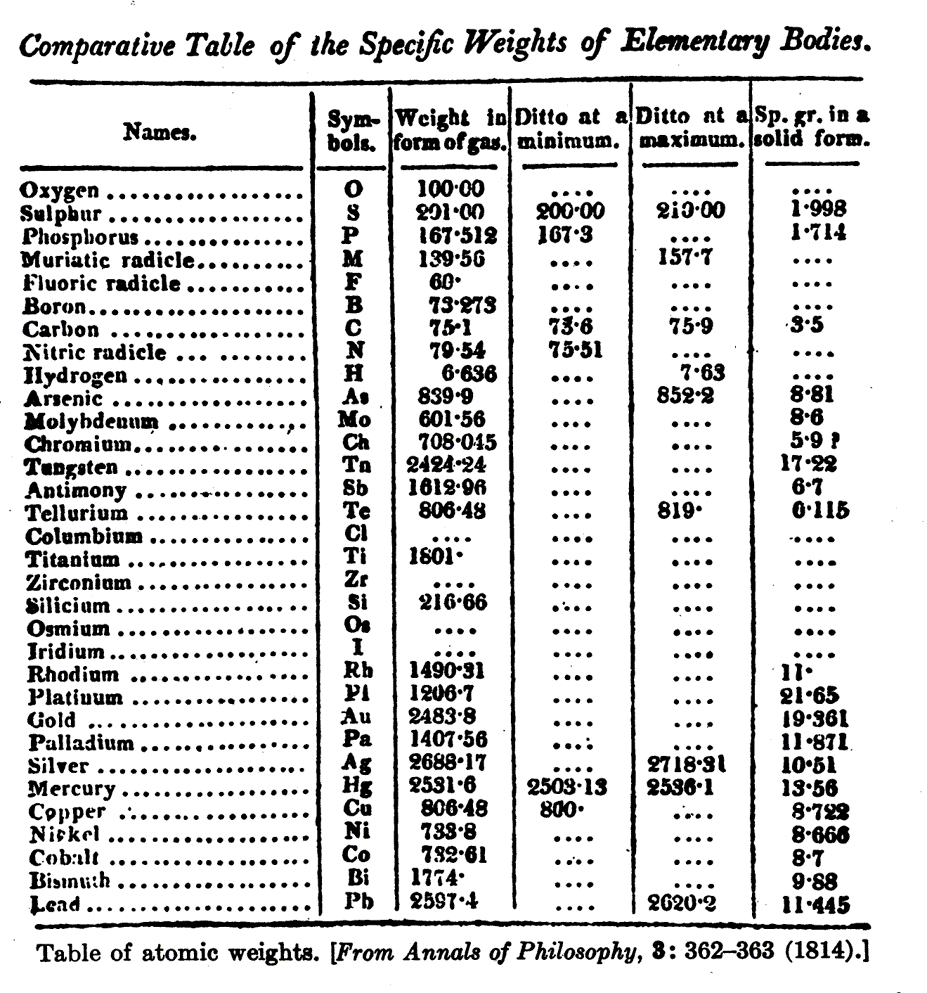
- Muchas de sus trabajos estuvieron enfocados a la medida de cantidades físicas: índices de refracción, calor específico de gases, calores de combustión.
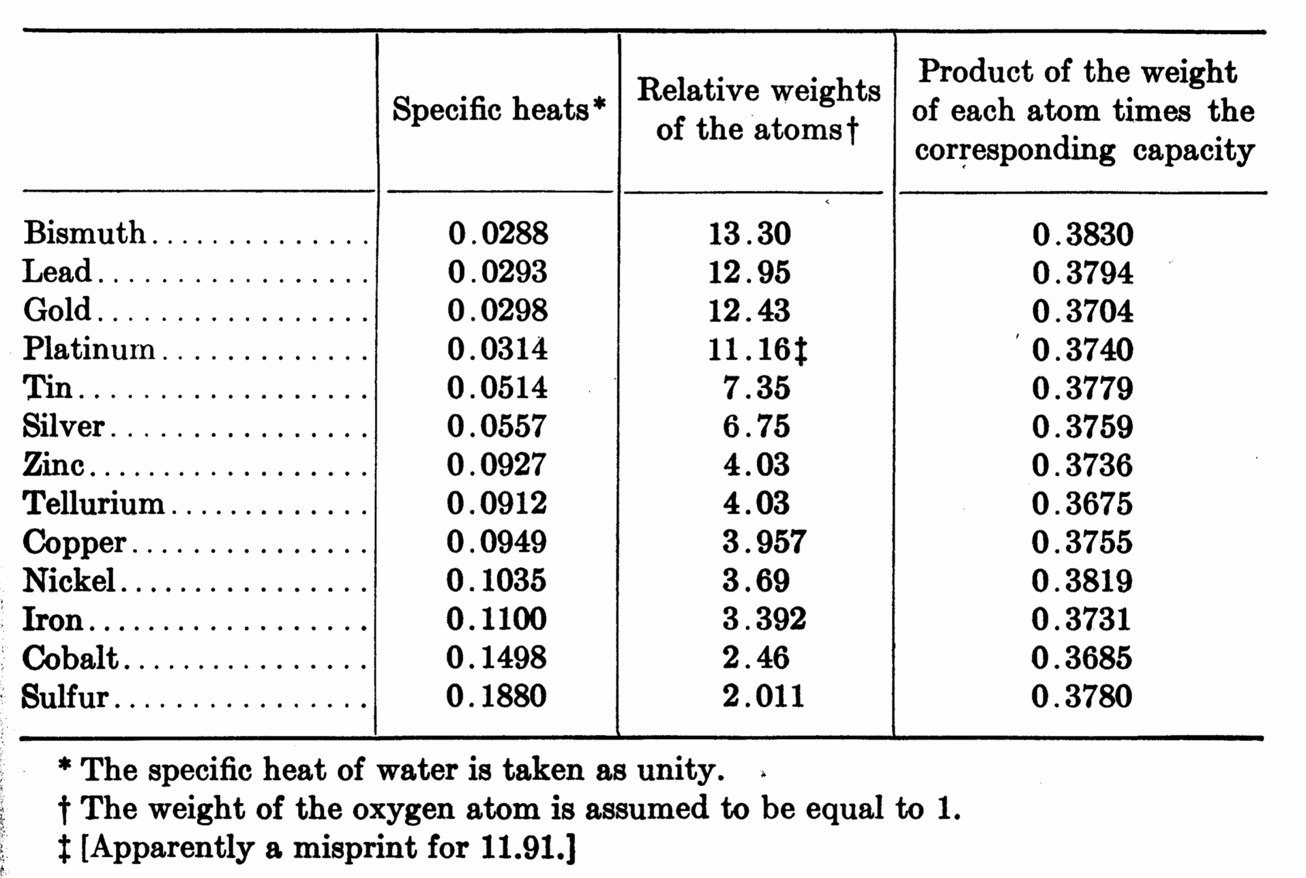
En colaboración con Alexis T. Petit, (1791 – 1820):
Encuentran que el producto del peso atómico y el calor específico es una constante.
LEY DE DULONG Y PETIT
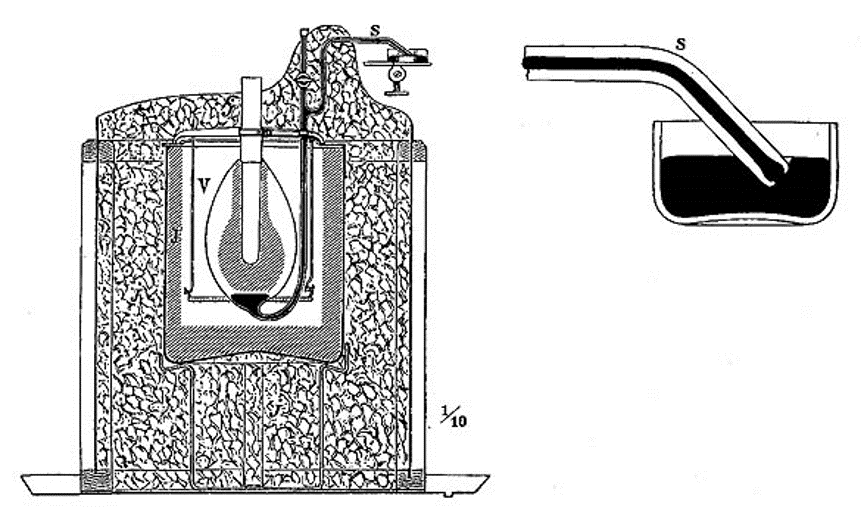
http://vlp.mpiwg-berlin.mpg.de/vlpimages/images/img10407.jpg


JOSEPH L. GAY – LUSSAC
(1778 – 1850)

Joseph L. Gay – Lussac, (1778 – 1850)
- La mayor parte de sus investigaciones fueron sobre los gases
- 1802, enuncia independientemente de Dalton la ley que gobierna la expansión de los gases por el calor.
- 1805, Con Alexander von Humboldt observan un hecho ya conocido: el oxígeno y el hidrógeno se combinan en proporción 2 a 1 en volumen
Basándose en los trabajos de Davy:
- Encuentra que 100 partes de gas sulfuroso se combina con 50 partes de oxígeno.
-
100 partes de oxido carbónico se combinan con 50 partes de oxígeno para formar ácido carbónico
-
1808, anuncia la ley de combinación de los volúmenes: Ley de Gay – Lussac
“…parece evidente para mi que los gases siempre se combinan en las proporciones más simples cuando una de ellas actua con otra, y hemos visto en realidad que en todos los ejemplos anteriores que la razon de combinación es 1 a 1, 1 a 2 o 1 a 3…
-
100 partes de ácido muriático se saturan completamente con 100 partes de gas amonio, formando una sal completamente neutra.
-100 partes de nitrógeno se combinan con 300 partes de hidrógeno
- 1 volumen de hidrógeno se combina con un volumen de cloro para formar ácido muriático
“ … estas relaciones no se observan con sustancias sólidas o liquídas, no cuando consideramos pesos, y ellas forman una nueva prueba de que solo en el estado gaseoso las sustancias bajo las mismas condiciones obedecen leyes regulares…
- 1815, Anuncia el descubrimiento del cianógeno y el clorocianógeno y la composición del ácido cianhídrico, ácido prúsico.
- Encuentra que el radical ciano, puede actuar de forma análoga al cloro, pasando sin alterarse a través de varias reacciones. Primer radical orgánico claramente reconocido.
- Estudió los metales alcalinos, descubrió el yodo, el boro, el cianógeno y los compuestos oxigenados del cloro.
- 1804, Subió en globo hasta 7000 m para estudiar la composición del aire en la alta atmósfera.
- Perfecciono la forma de preparar ácido sulfúrico de forma masiva, torre de Gay - Lussac

JOSEPH L. GAY – LUSSAC, (1778 – 1850)
Si dos volúmenes de hidrógeno reaccionan con un volumen de oxígeno:
¿Es consistente este resultado con lo formulado por Dalton para el agua, HO?
100 volúmenes de nitrogeno + 300 volúmenes de hidrogeno = 200 volúmenes de amoniaco
2 volúmenes de hidrógeno + 1 volumen de oxigeno = 2 volúmenes de agua
100 volúmenes de hidrógeno + 100 volúmenes de ácido muriático oxigenado = 200 volúmenes de ácido muriático
“…la aparente contracción de volumen sufrida por los gases al combinarse esta también relacionado de forma simple simples con el volumen de cualquiera de ellos…

Lorenzo Romano
Amadeo Carlo Avogadro
(1776 – 1856)
Lorenzo Romano Amadeo Carlo Avogadro, (1776 – 1856)
1811, publica su hipótesis en Journal of Physique, 73: 58-76 (1811)
Essay on a manner of Determining the Relative masses of the Elementary molecules of Bodies, and the Proportions in wich They enter into the Compounds
HIPOTESIS DE AVOGADRO
- Molécula Integral: molécula de un compuesto
- Molécula Constituyente: Molécula de un elemento
- Molécula elemental: Un átomo
Concepto de molécula para Avogadro:
“La primera hipótesis …el número de moléculas integrales en cualquier gas es siempre el mismo para iguales volúmenes o siempre es proporcional a los volúmenes”
“la relación de las masas de las moléculas es la misma a la relación de las densidades de los diferentes gases a la misma temperatura y presión y el número relativo de moléculas en un compuesto esta dado a su vez por la relación de los volúmenes de los gases que forman este..”
Tomando como referencia la densidad del aire igual a 1: sabían que:
- Densidad del oxígeno = 1.10359
- Densidad del hidrogeno = 0.07321
Relación: 15.074 a 1
Actualmente: De acuerdo a la NIST:
- Densidad del oxígeno = 0.0013088 g cm-3
- Densidad del hidrogeno = 8.2350 x 10-5 g cm-3
relación 15.893 a 1
“…de otra parte, ya que conocemos que la relación de volúmenes de hidrógeno y oxígeno en la formación del agua es de 2:1, síguese que el agua resulta de la unión de una molécula de oxígeno con dos moléculas de hidrógeno.”
“…las moléculas constituyentes de cualquier gas simple, cualquiera que sea, no esta formado de moléculas elementales solitarias, sino que esta hecho de un cierto número de esas moléculas unidas por atracción para formar una molécula única…”
¿Cómo explicar entonces que 2 volúmenes de hidrógeno se combinen con un volumen de oxígeno para formar dos volúmenes de agua?
¿Cómo explicar entonces que 3 volúmenes de hidrógeno se combinen con un volumen de nitrógeno para formar dos volúmenes de amoniaco?
¿Cómo determinar entonces el peso del agua?
¿Cómo determinar el peso del amoniaco sí la densidad del nitrógeno es 0.96913?
“No se supo ver que las ideas propuestas permitían superar las dificultades que encontraba la hipótesis atómica en su interpretación de la ley de las proporciones múltiples y de la ley de Gay – Lussac sobre los volúmenes gaseosos”
Robert Massain
La contribución de Avogadro sería olvidada hasta su resurrección en 1858 gracias a Cannizaro
STANISLAO CANNIZZARO, (1826 – 1910)
El método de Cannizaro
- “ Preparasen en forma pura los gases elementales y tantos como sea posible de sus compuestos, los cuales sean gaseosos o puedan ser vaporizados sin descomposición a elevadas temperaturas.”
- “ Analice cada compuesto de esta forma preparada por porcentaje en peso de sus constituyentes elementales.”
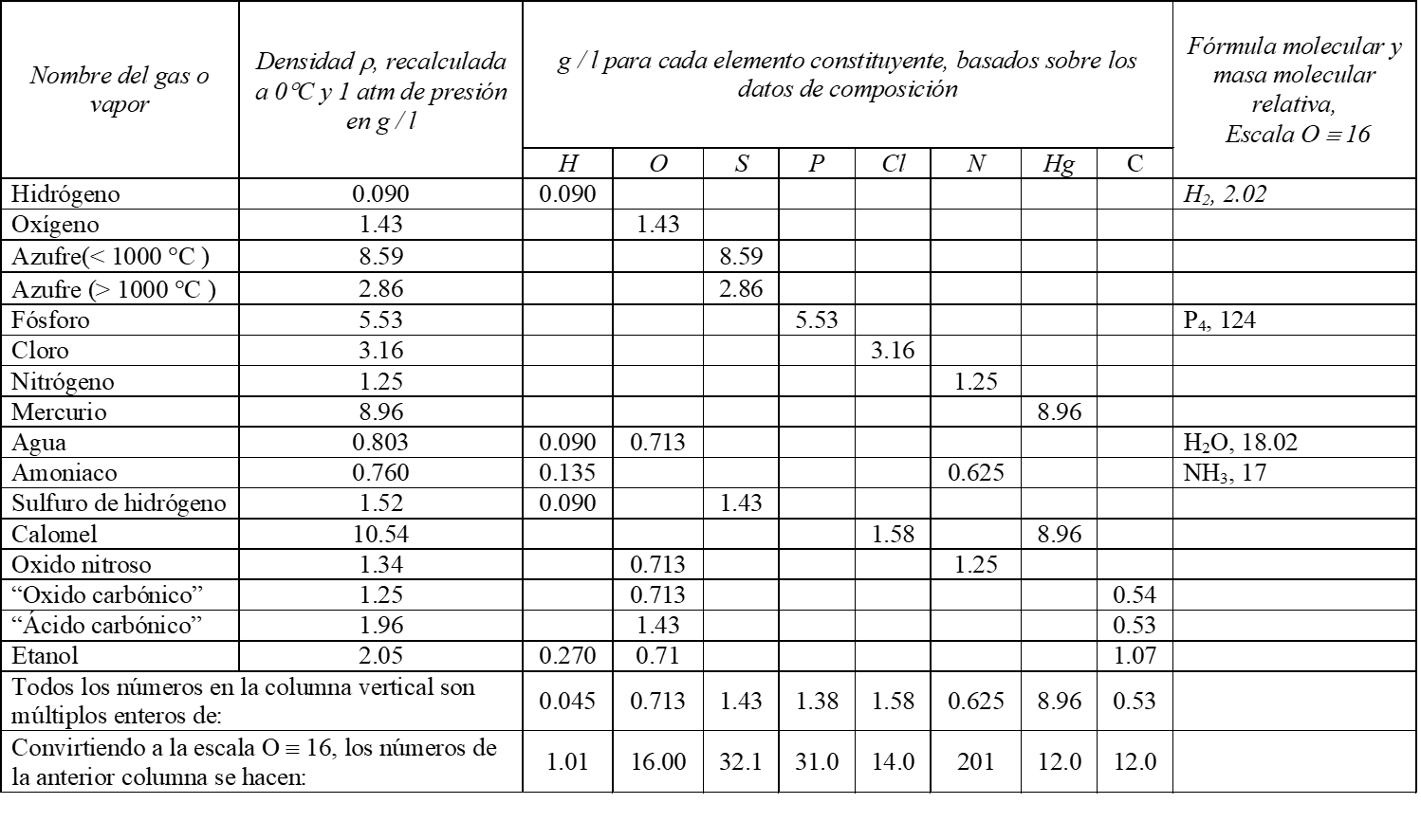
3. “ Encuentre el peso de cada elemento en un volumen fijo arbitrario de las sustancias elementales y de cada uno de los compuestos preparados. Por ejemplo en 1 litro a condiciones estándar (0 °C y 1 atm de presión).”
4. “Todos los pesos de un elemento se relacionarán por números enteros, el número de átomos en las moléculas, ya que el calculo se basa en que volúmenes iguales contienen en mismo número de partículas.”
5. “Para expresar los pesos de las moléculas de debe tomar como referencia el peso de un gas simple el cual debe tomarse como unidad.”