Química estructural
El vitalismo y su crisis


- 1807- Berzelius: Sugiere que las sustancias que provienen de los organismos se llamasen orgánicas y las sustancias que provienen del medio no – vivo se llamasen inorgánicas.
- Hasta comienzos del siglo XIX se conocía que las sustancias orgánicas podían convertirse en inorgánicas, pero no se tenía referencia del proceso contrario.

- Desde la antigüedad se conocía que la mayoría de las sustancias que provenían del reino vegetal y animal contenían el principio de la inflamabilidad
- Por otra parte las sustancias orgánicas se encuentran siempre haciendo parte de la vida.
¿Son las sustancias orgánicas poseedoras de algún carácter vital?

vitalismo

Stahl
(1659 - 1734)

-
Hacia el siglo XIX se encontraban entonces textos de “química vegetal” y “química animal”
¿ Es la química orgánica la química del carbono?
¿Que caracteriza la química del carbono?

“ En mayo 24 de 1999 a las 11:17:11 a.m. Se habían registrado 19.632.211 sustancias de las cuales 68% eran orgánicas, 17% eran biosecuencias, 6% compuestos de coordinación, 4% polímeros, 3% aleaciones y 2% inorgánicos tabulares”
A Chemical History Tour
De acuerdo al CAS, Chemical Abstracts Service:

“Columbus, Ohio (September 8, 2009) - Chemical Abstracts Service (CAS), a division of the American Chemical Society, announced that on September 7 it recorded the 50 millionth substance in CAS REGISTRYSM, the world's most comprehensive and high-quality compendium of publicly disclosed chemical information. The recently registered substance is a novel arylmethylidene heterocycle with analgesic properties. Reaching the 50 million mark so quickly is an indicator of the accelerating pace of scientific knowledge. CAS registered the 40 millionth substance just nine months ago - in contrast, it took 33 years for CAS to register the 10 millionth compound in 1990.”

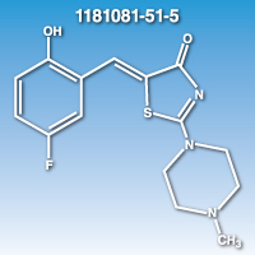
(5Z)-5-[(5-Fluoro-2-hydroxyphenyl)methylene]-2-(4-methyl-1-piperazinyl)-4(5H)-thiazolone

"Achieving a milestone of 50 million small molecules registered, which I congratulate CAS for, has given us two major insights; one is that a novel substance is either isolated or synthesized every 2.6 seconds on the average during the past 12 months, day and night, seven days a week in the world, showing an almost unbelievable rate of progress in science," said Dr. Hideaki Chihara, Ph.D. chemist and former president of Japan Association for International Chemical Information. "The other is that CAS is maintaining its reputation as the world's largest compilation of substance information that every scientist in the world relies on either directly or indirectly."

- Así un promedio de 1.3 millones de nuevas sustancias son adicionadas cada año
¿En verdad tienen las sustancias orgánicas algo de especial?

Justus Liebig
(1803 – 1873)


- 1837: Publica su libro: Handbook of Organic analysis
- Desarrolla el método para análisis de C, H y O, el cuál se sigue usando hoy.

En 1848, encuentra que la formula del ácido cólico era: , tomando como referencia los pesos atómicos C = 6 y O = 8).
-
Hoy se conoce que este ácido tiene la formula: , tomando como referencia C = 12 y O = 16
¿ Eran entonces sus resultados exactos?

Friedrich Wohler
(1800-1882)


-
Hacia 1820: Liebig y Friedrich Wöhler: descubren que dos sustancias muy diferentes, el fulminato de plata y el cianato de plata tienen la misma composición
-
Es Liebig quien en su fuerte carácter ataca los resultados de Wöhler hasta que se encuentran y comparan sus resultados

-
Hoy se sabe que el fulminato de plata y el cianato de plata tienen las formulas: Ag – CNO y Ag – OCN respectivamente.
-
1830: Berzelius asigna a este tipo de compuestos el nombre de isómeros.

-
1828: Wöhler sintetiza el cianato de amonio, , encontrando que este compuesto tiene la misma formula de la urea:
-
Se encontraba entonces que cuando evaporaba las aguas en donde se encontraban los productos el cianato se convertía en urea: isomerización

-
1830 – Liebig y Wöhler sintetizan cianato de amonio sólido mediante reacción directa de amoniaco y ácido ciánico
-
Si los cristales de cianato de amonio se dejan en contacto con el aire se encuentra que en dos días la conversión es completa
-
De esta manera el trabajo de Whöler marca el inicio de la crisis del vitalismo

Hermann Kolbe
(1818 – 1884)


-
1840: Hermann Kolbe: alumno de Wöhler sintetiza el ácido acético, el componente del vinagre, un compuesto orgánico y del todo natural.
-
Kolbe, sintetiza el ácido acético a partir de los componentes esenciales:


-
1861: John Darby, profesor de química y ciencias naturales en East Alabama College al notar que el formiato de etilo es un “cuerpo isomérico” con el acetato de etilo:
“ Una explicación a esos fenómenos que atribuyen a esos compuestos diferentes ordenamientos de átomos, no es satisfactoria, como cuando cuerpos elementales asumen diferentes estados en química inorgánica, lo cual es llamado alotropismo... Nosotros solo podemos referirnos a esto, por el momento, hecho por el creador ”
El concepto de valencia



Edward Frankland
(1825 – 1899)

- Se da cuenta que un átomo metálico se podía unir a un determinado grupo de radicales y que este número variaba para los diferentes metales
Propone lo que luego se conocería como:
TEORÍA DE LA VALENCIA

“Cada átomo tiene un poder de combinación fijo”
¿Cómo ayuda este nuevo concepto a diferenciar entre peso molecular y peso equivalente?
¿ Que implica este concepto en el desarrollo de la elucidación de la estructura atómica?

¿Existirá alguna conexión entre átomos de electricidad y valencia?
¿Actualmente cómo valoran la simplicidad de este concepto?

Fiedrich A. Kekulé
(1829 – 1896)

1857 - Fiedrich A. Kekulé (1829 – 1896)
Inicia en la Universidad de Giessen como estudiante de arquitectura antes de ser influenciado por Liebig
Aplica la noción de valencia a la estructura de la moléculas orgánicas
Sugiere entonces que el carbono tiene una valencia de 4, tetravalente

1858: “ La constitución y la Metamorfosis de Compuestos Químicos y la Naturaleza Química del Carbón”
Annalen der Chemie, 106: 129 – 159 (1858)
“ Si solo se consideran los compuestos más simples del carbono (gas de los pantanos, cloruro de metilo, tetracloruro de carbono, cloroformo, ácido carbónico,..., etc.), es sorprendente que la cantidad de carbón el cuál el químico conoce como el átomo, siempre se combina con cuatro átomos de elemento monoatómico o dos átomos de un elemento diatómico; que generalmente, la suma de las unidades químicas de los elementos que rodean a un átomo de carbono es igual a 4. Esto lleva a la observación que el carbono es tetraatómico (o tetrabásico) ”

- “ Para sustancias que contienen más de un átomo de carbono, se debe asumir que al menos parte de los átomos estarán unidos por la afinidad del carbono y que los átomos de carbono se unirán entre sí...”
- “ De las 2x4 unidades de afinidad de los dos átomos de carbono, dos de estas serán usadas para mantener ambos átomos unidos, las seis afinidades extras podrán ser enlazadas por los átomos de otros elementos. En otras palabras un grupo de dos átomos de carbono... Será hexa-átomico

- “...El número de átomos de hidrogeno (unidades químicas) las cuales se enlazan con n átomos de carbono, unidos entre sí, puede ser expresado por:
n(4 – 2) + 2 = 2n + 2 ”
- “...es igualmente posible pensar que en los elementos poliatómicos (O, N, etc.) solo una parte de sus afinidades, solo una de las dos unidades del oxígeno por ejemplo, o solo una parte de las tres unidades del nitrógeno, están enlazadas al carbono”

¿Y LOS COMPUESTOS AROMATICOS?


1865: Estudios Sobre Compuestos Aromáticos.
Annalen der Chemie, 137: 129-196 (1865)
- Todos los compuestos, aún los más simples, son más ricos en carbón que sus compuestos análogos en la clase de compuestos grasos.
- Al igual que en los compuestos grasos en los compuestos aromáticos existen numerosas sustancias homólogas.

- El más simple de los compuestos aromáticos contiene al menos seis átomos de carbono.
- Todos los productos de sustancias aromáticas muestran cierta similitud, ellos pertenecen colectivamente al grupo de los “compuestos aromáticos”
- “… sí muchos carbonos se pueden unir entre sí, entonces puede suceder que una unidad de afinidad de un átomo pueda unirse a una unidad de afinidad de otro átomo…esto explica la constitución de los cuerpos grasos”

-
“…podemos asumir que muchos átomos de carbono se unirán a través de dos unidades de afinidad, puede asumirse que la unión ocurre alternado primero una y luego dos unidades de afinidad…”
-
“…dos átomos de carbono los cuales finalizan la cadena se unen por una unidad de afinidad, obteniéndose entonces una cadena cerrada…”
-
“…en todas las sustancias aromáticas se puede asumir un núcleo común, una cadena cerrada C6A6 (donde A significa una afinidad insaturada o una unidad de afinidad)



Archibald Scoot Couper
(1831 –1892)


- La historia indica que descubre la tetravalencia del carbono y el enlace carbono – carbono, simultáneamente con Kekúle
- Su publicación fue retrasada por razones técnicas por su director Adolph Wurtz
Archibald Scoot Couper
(1831 –1892)

Así la tetravalencia del carbono establece los fundamentos de la química orgánica estructural

En palabras de Brock:
“ Tal como Picasso transformó el arte permitiendo al observador ver más allá de las cosas, Kekulé ha transformado la química. Las propiedades químicas se originan de la estructura interna de las moléculas, las cuales ahora pueden ser “observadas” y “leídas” a través de la experiencia óptica química analítica y la síntesis química ”
The Norton History of Chemistry, Norton, New York, 1993
Las moléculas son tridimensionales




Jean Baptiste Biot
1774-1862

1815 – Jean Baptiste Biot:
- Encuentra que ciertos minerales rotan el plano de la luz polarizada:
- Dextrógiro
- Levógiro
- Ciertos líquidos como el aceite de turpentina y el alcanfor en solución alcohólica son ópticamente activos

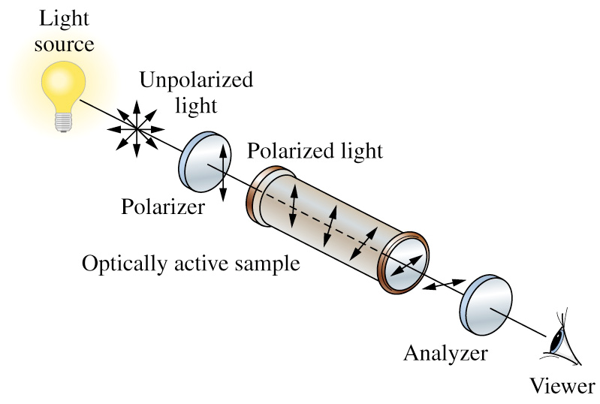
http://cwx.prenhall.com/bookbind/pubbooks/hillchem3/medialib/media_portfolio/22.html


Louis Pasteur
(1822 – 1895)

1848 – Louis Pasteur (1822 – 1895)
- Cristalizando ácido tartárico encuentra que los cristales formados eran asimétricos, un lado del cristal presentaba una cara que no presentaban los otros y en algunos casos la cara se presentaba en un lado y en los otros en el otro lado.

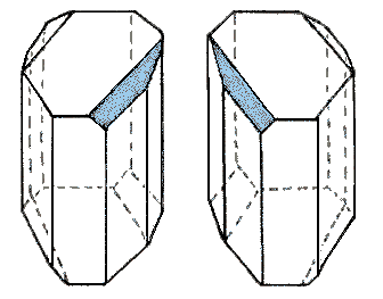

- De tal forma que un cristal era la imagen especular del otro
- Separó y disolvió por aparte los cristales, encontrando que las propiedades de la solución eran iguales exceptuando la actividad óptica: una solución era dextrógira y la otra levógira.

Si es esa asimetría, ¿por que se mantiene en solución?
¿ Es la asimetría de los cristales la causa de la desviación del plano de la luz polarizada?

1874 – Jacobo H. van´t Hoff (1852 – 1911)
Joseph A. Le Bel (1847 – 1930)
- Trabajaban en el laboratorio de Wurtz
- Postulan que los cuatro enlaces del carbono estaban distribuidos en las tres dimensiones del espacio hacia los cuatro vértices de un tetraedro


Jacobo H. Van´t Hoff
(1852 – 1911)


Joseph A. Le Bel
(1847 – 1930)



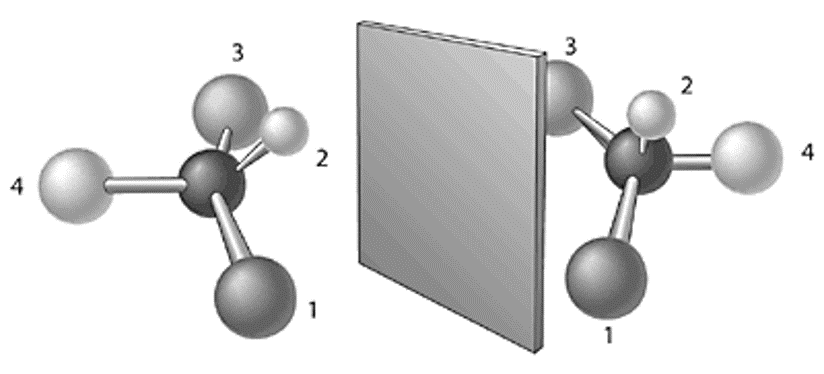
- Cuando el átomo de carbono se une a cuatro átomos o grupos de átomos distintos se encuentra un carbono asimétrico
- Estos cuatro átomos o grupo de átomos se pueden disponer en forma distinta de tal forma que uno sea la imagen especular del otro

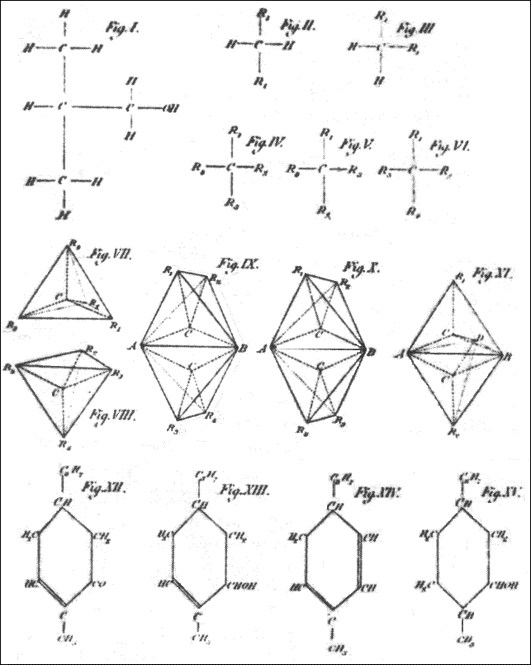

- Este modelo aporta entonces una explicación a la asimetría que Pasteur había encontrado en los cristales
- Hoy conocemos a este tipo de estructuras enantiómeros
- Carbono con cuatro radicales diferentes: carbono quiral
- Isómero: estereoisómero


Emil Fischer
(1852 – 1919)
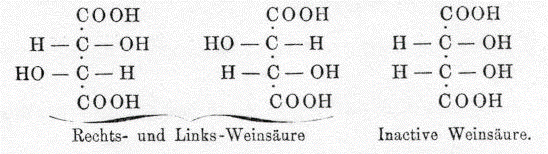

1880 – Emil Fischer (1852 – 1919)
- Encuentra que varios azucares simples comparten la misma formula empírica
- Un aspecto que los diferenciaba era la magnitud de su actividad óptica
- Demuestra que estos azucares tienen cuatro átomos de carbono asimétricos y de acuerdo a van´t Hoff y Le Bel encuentra y demuestra que existen 16 isómeros
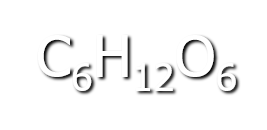

1892 – Alfred Werner (1866 – 1919)
- Extiende el concepto de estereoisomería al cobalto, rodio, cromo y otros metales.
- Desarrolla la “Química de Coordinación”
- En torno a un átomo central se pueden distribuir átomos o grupos de átomos que parecen no seguir la valencia usual