Aula 16
Introdução à Física Clássica II
Prof. Ronai Lisbôa
Não compreendeu algo? Algo está esquisito? Comente!
Objetivos
Ao final dessa aula você deve se capaz de:
Bibliografia
Sears & Zemansky - Vol. 2 - 14a. edição.
Capítulo 17 - Temperatura e Calor
Seções: 17.1, 17.2, 17.3, 17.4
Conceituar temperatura.
Conceituar temperatura.
Associar a temperatura como uma medida do equilíbrio térmico.
Explicar a calibração e construção de diversos termômetros.
Estudar e calcular a dilatação térmica.
Motivação
O estudo formal da termodinâmica. Primeira revolução industrial.
As questões no séc. XVIII eram:
Como obter o movimento a partir do calor?
Qual o equivalente mecânico do calor?
(a relação entre o custo da energia produzida e a economia). Qual o fator de conversão?
As respostas:
As leis físicas foram obtidas empiricamente.
Baseada na natureza macroscópica da matéria, pois não era conhecida a natureza atômica e molecular da matéria.

Motivação
O estudo formal da termodinâmica. Terceira e quarta revoluções industriais.
As questões são:
Como manter o crescimento econômico e reduzir a emissão de gases?
As respostas, hoje:
O uso eficiente da energia e as propriedades da matéria.
Baseada na natureza microscópica da matéria: nanotecnologia, informação quântica e inteligência artificial. Processos rápidos, longo alcance e impacto: sistemas ciberfísicos, que foram possíveis graças à internet das coisas e à computação na nuvem.

As leis da termodinâmica
Conceitua a temperatura e o equilíbrio térmico.
Estabelece a conservação da energia.
Define a entropia como uma medida da disponibilidade de energia.
Estabelece um valor numérico para a entropia e o limite inferior para a temperatura absoluta.
A lei zero:
A primeira lei:
A segunda lei:
A terceira lei:
O que é a termodinâmica?
Teoria fenomenológica da natureza que descreve os estados de equilíbrio de sistemas macroscópicos bem como as trocas de energia e matéria, com suas vizinhanças, necessárias ao trânsito do sistema entre estes estados de equilíbrio.


Fonte: edisciplinas.usp.brFonte: FreepicMatéria
Sistemas termodinâmicos
É conveniente falar sobre a massa molar (\(M\)) de uma substância como o produto da massa (\(m\)) de uma única molécula ou átomos vezes o número de Avogadro (\(N_A\)):
O número de Avogadro equivale a um número
\(N_A = 6,022\times 10^{22}\)
de algo.
1 mol de bananas correspondem a número \(N_A\) de bananas.

Fonte: https://www.branco.casaMacro
Micro
A energia interna
Sistemas termodinâmicos
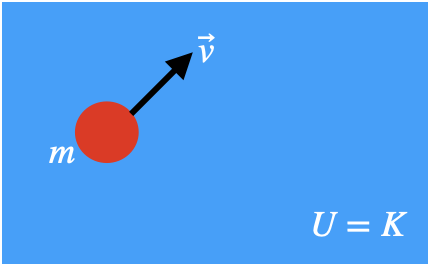
Uma partícula livre pode ter apenas um único tipo de energia:
A energia cinética.
Um caso particular é aquele onde há mais de uma partícula, mas elas colidem elasticamente entre si e/ou com as paredes do recipiente. A energia interna ainda será a energia do movimento, a energia cinética.

É uma energia bem definida de um sistema termodinâmico como uma manifestação macroscópica de uma lei de conservação.
É a energia do movimento.
É uma quantidade macroscópica de matéria ou radiação. O volume (V) e o número de moléculas (N) são parâmetros mecânicos e de composição química relevantes, respectivamente, bem como a energia interna (U).
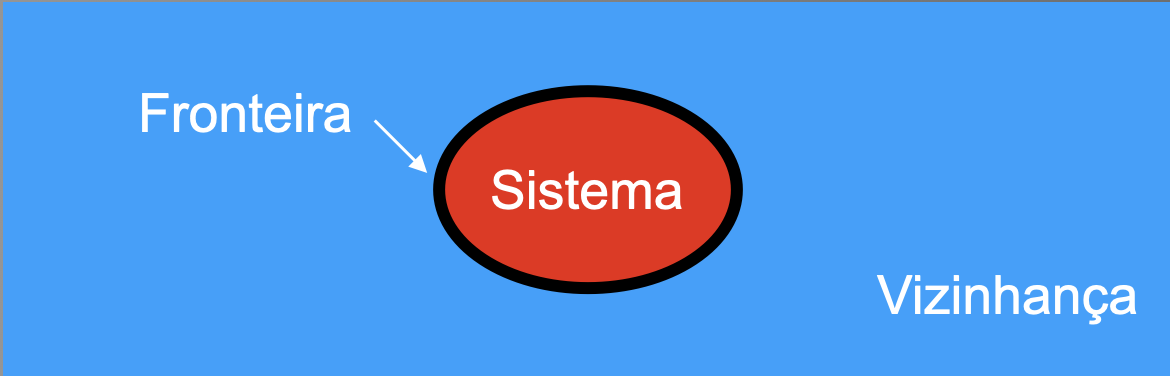

Região do universo delimitada por paredes termodinâmicas (fronteira) que impõem vínculos (restrições) às trocas de energia e matéria com a vizinhança (restante do universo).
Sistemas termodinâmicos
Sistema termodinâmico (macroscópico)
São fronteiras (reais ou imaginárias) que separam o sistema termodinâmico de sua vizinhança. Elas são classificadas segundo as restrições que impõem às trocas de matéria e energia entre o sistema e a vizinhança.
Sistemas termodinâmicos
Paredes termodinâmicas

Fixa ou Movel
Permite ou restringe a troca, na forma de trabalho mecânico, de energia entre o sistema e a vizinhança.

Diatérmica ou Adiabática
Permite ou restringe a troca, na forma de calor, de energia entre o sistema e a vizinhança.
Permeável ou Impermeável

Permite ou restringe a troca de partículas, entre o sistema e a vizinhança.
As paredes demonstram que a energia é macroscopicamente controlável e mensurável via trabalho mecânico, calor e trabalho químico.
Tipos de sistemas:
Aberto:
Fechado:
Isolado:
Há transferência de energia e matéria através da fronteira.
Há transferência de energia através da fronteira, mas não de matéria
Não há transferência de matéria nem energia através da fronteira.
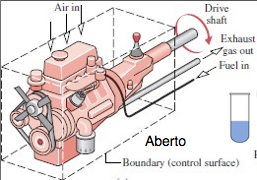
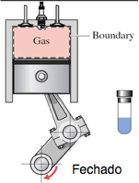
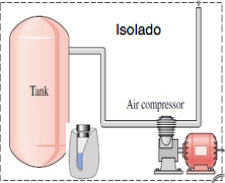
Volume de controle
Massa de controle
Fonte: Moran - Shapiro - Munson - DewittSistemas termodinâmicos
Exemplos de sistemas termodinâmicos, vizinhança e fronteira:
Fios esticados.
Sistemas termodinâmicos
Radiação eletromagnética.
Substâncias magnéticas.
Um copo de água.
Um copo de água e gelo.


Fonte: Carlos Aguiar - MNPEF - UFRJFonte: Carlos Aguiar - MNPEF - UFRJFonte: Carlos Aguiar - MNPEF - UFRJFonte: https://br.freepik.com/A definição de um sistema térmico consiste:
Sistema termodinâmico: Turbina eólica.
A vizinhança: Bateria.
A fronteira: Fluxo de energia.
Sistemas térmicos eficientes são capazes de:
Armazenar energia.
Transferir energia.
Transformar energia.
Fonte: Moran - Shapiro - Munson - DewittTurbina - gerador
Fluxo de ar
Fluxo de corrente elétrica
Calor - interação
Sistema
Vizinhança
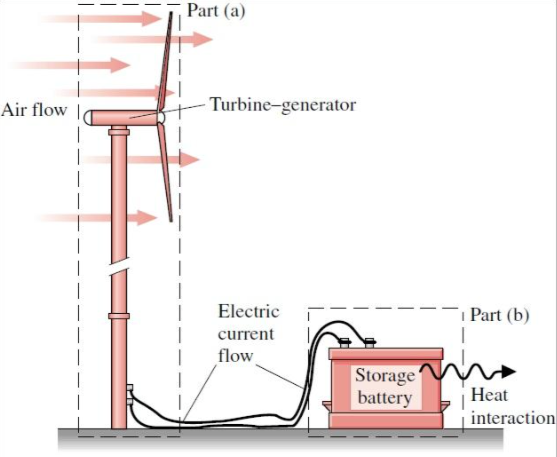
Fronteira
Sistemas termodinâmicos
Postulado I
Existem estados específicos (chamados de estados de equilíbrio) de sistemas simples que, macroscopicamente, são caracterizados pela energia interna U, o volume V, e o número de moles N das componentes químicas.
Sistemas termodinâmicos
O problema fundamental da termodinâmica
Determinar o estado final de equilíbrio, após a remoção de vínculos internos de um sistema composto.
Equilíbrio termodinâmico
Alterações na vizinhança ou em paredes internas geralmente acarretam mudanças no sistema.
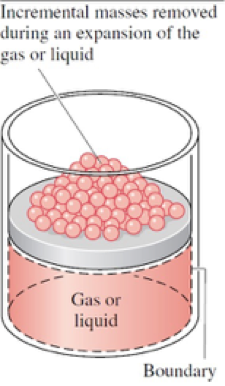
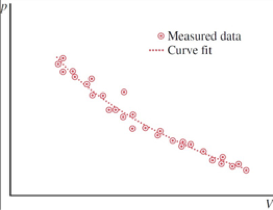
Medidas
Modelo
A cada remoção de uma massa, o sistema retorna ao estado de equilíbrio
Se as alterações cessarem, é um fato empírico que após algum tempo o sistema atingirá um estado estacionário (nenhuma grandeza macroscópica depende do tempo).
Quando o sistema está nesse estado no qual nada muda (macroscopicamente) dizemos que ele está em equilíbrio termodinâmico.
Fonte: Moran - Shapiro - Munson - DewittEquilíbrio termodinâmico
Não se pode notar movimento ou qualquer mudança macroscópica no sistema ou na sua vizinhança.
O estado pode ser caracterizado por um número pequeno de grandezas macroscópicas em comparação ao número de graus de liberdade microscópicos. Essas grandezas são as variáveis termodinâmicas ou variáveis de estado.

Fonte: BauerEquilíbrio termodinâmico
A Lei menos um da termodinâmica
Um sistema isolado em uma região de volume fixo sempre atingirá espontaneamente um único estado de equilíbrio.
Harvey Brown & Jos Uffinf
The origins of Time-Asymmetry in Thermodynamics: The Minus First Law
O equilíbrio pode ser quase-estático:
O desvio do equilíbrio termodinâmico é no máximo infinitesimal.
O sistema retorna rapidamente ao estado de equilíbrio.
Todos os estados intermediários durante o processo são estados de equilíbrio.
É uma idealização do processo real.
Equilíbrio termodinâmico
Os subsistemas de um sistema isolado entram em equilíbrio se uma fronteira interna (parede) for removida. Observa-se experimentalmente:
Equilíbrio mecânico (parede rígida é removida => o sistema tende a uma pressão constante);
Equilíbrio químico (parede impermeável é removida => o sistema tende a um potencial químico constante).
Equilíbrio térmico (parede adiabática é removida => o sistema tende a uma temperatura constante);
Variável, estado e processo termodinâmicos
Variáveis termodinâmicas;
A energia interna U, o volume V, o número de partículas N, a temperatura T, a pressão P, o potencial químico e a entropia S, magnetização (M), etc....
Os conceitos de volume, pressão e temperatura são valores médios de grandezas microscópicas.
Chamamos de variáveis termodinâmicas: V, P, T.
Estado termodinâmico
As demais são obtidas a partir dessas \(N\) coordenadas independentes \(K-N\) relações que podem ser escritas como:
O estado é caracterizado por \(K\) variáveis termodinâmicas: \(X_1, X_2, …, X_K\).
Nem todas essas variáveis são independentes. Geralmente, apenas um pequeno número delas \(N<K\) é suficiente para determinar o estado: \(X_1, X_2, …, X_N\).
Essas relações são chamadas de equações de estado.
Variável, estado e processo termodinâmicos
Quando quaisquer propriedades de um sistema muda, o estado também muda.
O sistema percorreu um processo (transformação).
Um processo é uma transformação de um estado para outro.
Variável, estado e processo termodinâmicos
Processos termodinâmicos
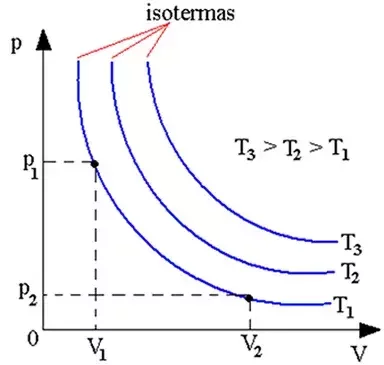
A representação gráfica associada a um sistema de coordenadas termodinâmicas é chamada diagrama indicado. Em um sistema com 2 coordenadas: \(X_1, X_2\), teríamos:
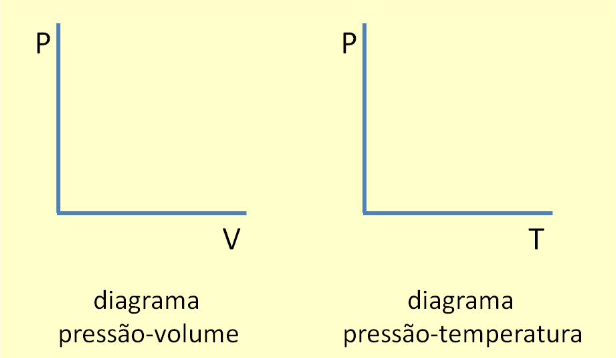
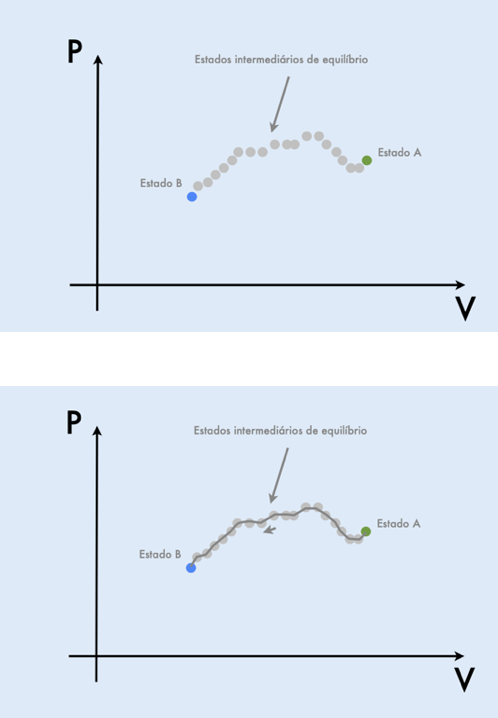
Imagine um sistema termodinâmico que está inicialmente em um estado de equilíbrio A.
Processo quase-estático
Quando o sistema é perturbado (mudança na vizinhança ou numa fronteira), o sistema fica fora do equilíbrio durante o tempo de relaxação.
Após um certo tempo ele atinge um novo estado de equilíbrio. Que vamos supor sentido o estado B.
Dizemos que foi realizado um processo para levar o sistema do estado A para o estado B.
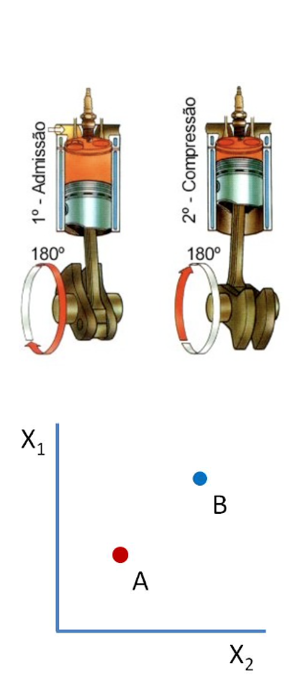
Como representar o processo a que o gás esteve submetido?
Processo quase-estático
Se o processo foi lento suficiente para que o sistema passasse sucessivamente por estados de equilíbrio…
Chamamos esse processo que quase-estático.
Um processo quase-estático pode ser representado por uma linha no diagrama indicador.
Equilíbrio térmico. Temperatura.
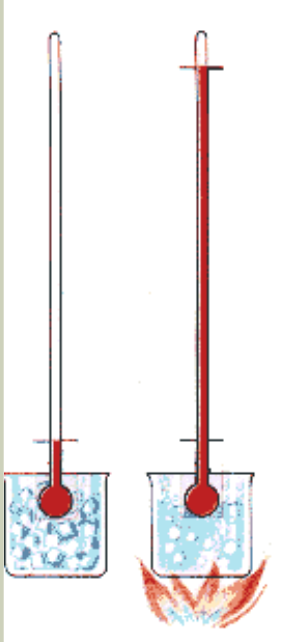
A temperatura é uma quantidade que informa quão quente ou frio é um objeto em relação a algum padrão. Expressamos a temperatura da matéria através de um número que corresponde à quantidade de graus de aquecimento em alguma escala.
O que é temperatura?
Macroscopicamente, a temperatura é uma variável termodinâmica que atribui um valor numérico à variação de alguma propriedade física ou termométrica.
Qual é a ideia de temperatura?




Fonte: FreepikFonte: FreepikEquilíbrio térmico. Temperatura.
Quando se coloca um corpo “quente” em contato com um corpo “frio” e isolados da vizinhança é observado experimentalmente que alguma propriedade física dos corpos varia: volume, pressão, resistência, magnetização, etc.
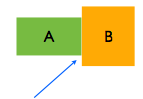
A e B estão emcontato térmico.
Quando as propriedades físicas observáveis cessam dizemos que há um equilíbrio térmico.
Dilatar ou contrair
Magnetizar ou desmagnetizar
Deixar passar ou impedir o fluxo de corrente elétrica
A propriedade física que mede esse estado de equilíbrio térmico é a temperatura.
Macroscopicamente, a temperatura é uma variável termodinâmica que atribui um valor numérico à variação de alguma propriedade física ou termométrica.
A temperatura. A Lei Zero da Termodinâmica.
Se os corpos A e B estão em equilíbrio térmico com um corpo C, então A e B estão em equilíbrio térmico entre si. Diz-se então que A, B e C possuem a mesma temperatura.
A temperatura de um sistema é uma propriedade que determina se o sistema está ou não em equilíbrio térmico com outros sistemas.

Fonte: Tipler
Fonte: Paull G HewittA temperatura. A Lei Zero da Termodinâmica.
Alguma propriedade termométrica varia quando há um contato térmico até o equilíbrio ser alcançado: variação do volume, variação do nível de uma coluna de mercúrio (dilatação), a pressão de um gás confinado, a temperatura, a resistência elétrica, cor da radiação térmica emitida por um corpo, etc.
O termômetro é um Instrumento de medida que atribui uma escala numérica de modo que a leitura tenha algum significado físico, isto é, meça uma propriedade termométrica:

Fonte: Bauer
Fluido - substância termométrica.
Recipiente de vidro - fronteira
Dilatação do fluido - propriedade termodinâmica.
A temperatura. A Lei Zero da Termodinâmica.
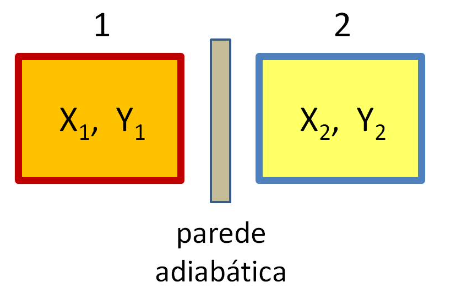
Dois sistemas, 1 e 2, sem contato térmico (separados por uma parede adiabática).
Os sistemas, 1 e 2, podem coexistir em quaisquer estados distintos. As variáveis \(X_1, Y_1, X_2, Y_2\) são independentes.
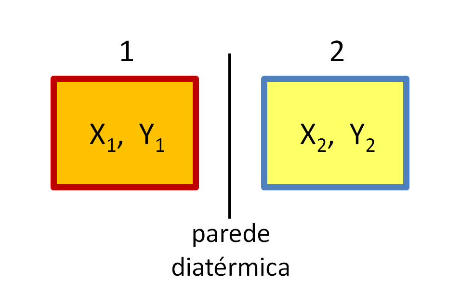
Se trocarmos a parede adiabática por uma diatérmica, após algum tempo o sistema entra em equilíbrio térmico.
As variáveis \(X_1, Y_1, X_2, Y_2\) não são mais independentes.
A temperatura. A Lei Zero da Termodinâmica.
Dois sistemas em equilíbrio térmico com um terceiro estão em equilíbrio térmico entre si.
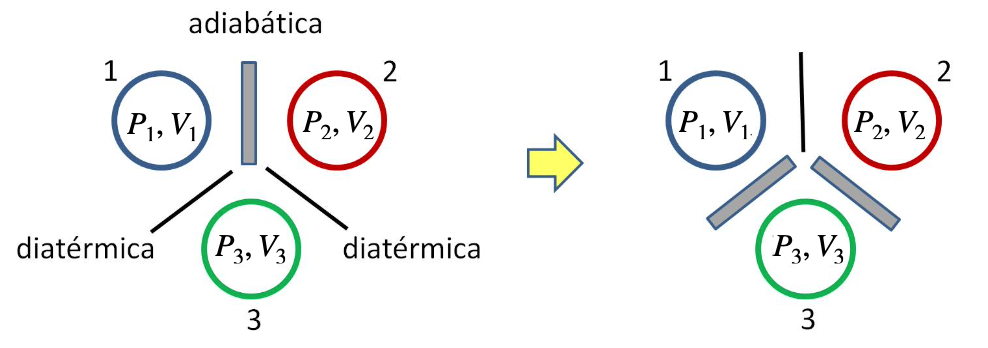
1 e 3
2 e 3
Da igualdade de \(V_3\)
Obtemos uma nova variável de estado que é a temperatura do sistema que define o equilíbrio térmico:
De forma geral, defini-se a temperatura:
A temperatura. A Lei Zero da Termodinâmica.
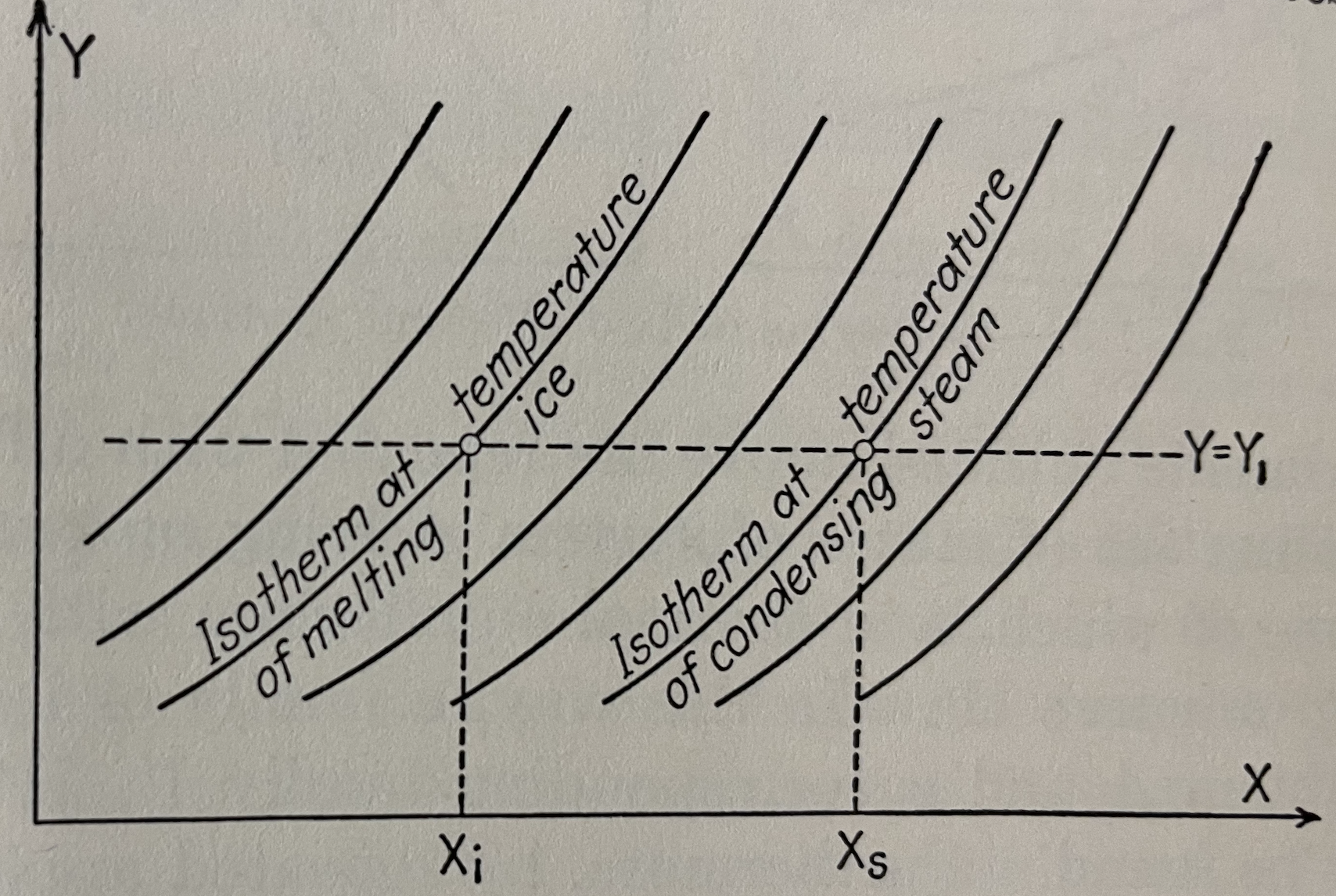
A Lei Zero determina apenas informa a forma das isotermas, mas não o valor da temperatura em cada uma delas.
A atribuição de uma temperatura a cada isoterma corresponde à escolha de uma escala de temperatura.
O termômetro é o corpo C posto em equilíbrio térmico com os sistemas A e B.
O processo de medida é realizado para um mesmo valor de \(p\) e valores diferentes de \(L\); logo \(T\).
A propriedade termodinâmica \(L\) e a forma da função \(T(L)\) determinar a escala de temperaturas.
A temperatura. A Lei Zero da Termodinâmica.
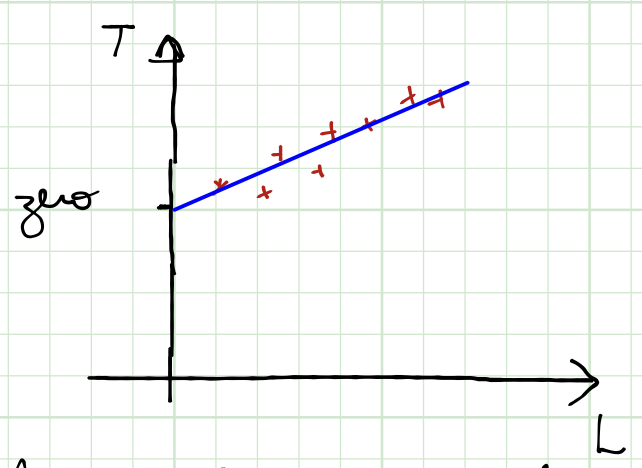
a constantes \(a\) e \(b\) são determinadas a partir de pontos fixos padrão (gelo e vapor) e algumas regras.

Para uma pressão constante e escolhendo-se uma propriedade termométrica que varie linearmente com a temperatura. Isto é,
A escala centígrada os dois pontos fixos correspondentes a pressão de 1 atm são:
Ponto de gelo (gelo e água saturada de ar), atribui-se um valor zero.
Ponto de vapor (vapor de água pura), atribui-se um valor 100.
Ponto de gelo (gelo e água saturada de ar)
Ponto de vapor (vapor de água pura)
A temperatura. A Lei Zero da Termodinâmica.
Sistema constituído de mercurio (substância termométrica) e a dilatação da coluna de mercúrio, o comprimento (propriedade termométrica) e dividida em 100 partes iguais, entre 0 e 100:
Ponto de gelo (gelo e água saturada de ar)
Ponto de vapor (vapor de água pura)
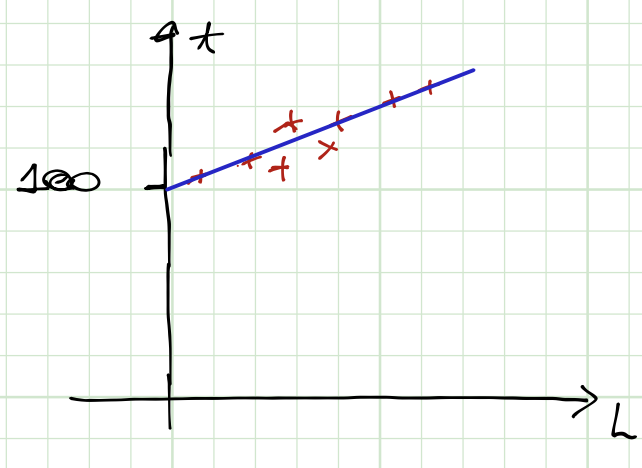
Substituindo \(\{a,b\}\) na relação linear:
A temperatura. A Lei Zero da Termodinâmica.
O raciocínio é análogo para sistemas onde a pressão, volume, resistência, radiação, etc. são as propriedades termométricas e não a dilatação da coluna de um fluido.
Estes termômetros são dependentes da substância termométrica utilizada e concordam razoavelmente bem nos pontos fixos.
| Volume constante (Hidrogênio T(P) |
Volume constante (Ar) T(P) |
Resistência de Platina T(R) |
Termopar T(fem) |
Mercúrio T(L) |
|---|---|---|---|---|
| 0 | 0 | 0 | 0 | 0 |
| 20 | 20,008 | 20,240 | 20,150 | 20,091 |
| 40 | 40,001 | 40,360 | 40,297 | 40,111 |
| 60 | 59,990 | 60,360 | 60,293 | 60,086 |
| 80 | 79,987 | 80,240 | 80,147 | 80,041 |
| 100 | 100 | 100 | 100 | 100 |
Fonte: Sears & ZemanskyPressão
Resistência
Tensão
Comprimento
A temperatura. A Lei Zero da Termodinâmica.
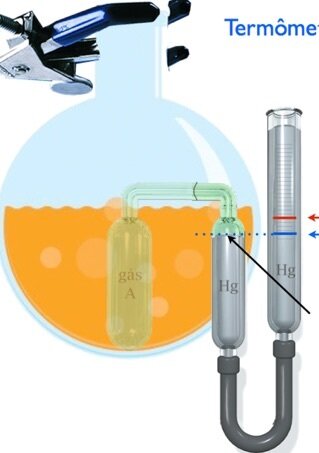
Nos termômetros de gás de volume constante:
O aparelho não depende da substância termométrica.
A leitura da temperatura concorda além pontos fixos.

Fonte: Prof. André BessaA pressão do gás a volume constante é a propriedade termométrica
A temperatura. A Lei Zero da Termodinâmica.
Nos termômetros de gás de volume constante:
Fonte: Prof. André Bessa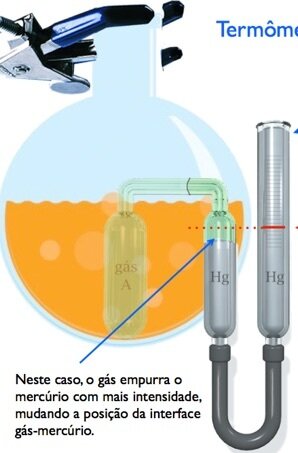


A temperatura. A Lei Zero da Termodinâmica.
Os termômetros que utilizam gás como substância termométrica apresentam melhores resultados experimentais mesmo além dos pontos fixos.
| Gas |
T(P) |
T(V) |
T(P) |
T(V) |
|---|---|---|---|---|
| Hidrogênio | 50,003 | 50,004 | 199,976 | 199,971 |
| Hélio | 50,001 | 50,000 | 199,994 | 199,991 |
| Neônio | 50,001 | 50,002 | 199,997 | 199,992 |
| Nitrogênio | 50,010 | 50,033 | 199,978 | 199,873 |
| Argônio | 50,014 | 50,034 | 199,971 | 199,864 |
| Oxigênio | 50,014 | 50,035 | 199,929 | 199,835 |

Fonte: TiplerO termômetro de gás se baseia no fato de que a pressão de um gás mantido a volume constante aumenta com a elevação da temperatura.
O volume é mantido constante elevando-se ou abaixando-se o tubo \(B_3\), de modo que o mercúrio no tubo \(B_2\) permaneça no marco zero. A temperatura \(T\) é escolhida como proporcional à pressão do gas do tubo \(B_1\), que é indicada pela altura \(h\) da coluna de mercúrio do tubo \(B_3\).
A escala Kelvin de temperatura
Todos os gases reais, no limite de baixas densidades, tendem à pressão zero para uma mesma temperatura. Um gás ideal é um gás real bastante diluído.
Extrapolando esse gráfico, vemos que deve existir uma temperatura hipotética igual a -273,15 \(^o\) C. Usamos essa temperatura extrapolada para uma pressão nula como a base para definir uma escala cujo zero corresponde a essa temperatura.
Fonte: Tipler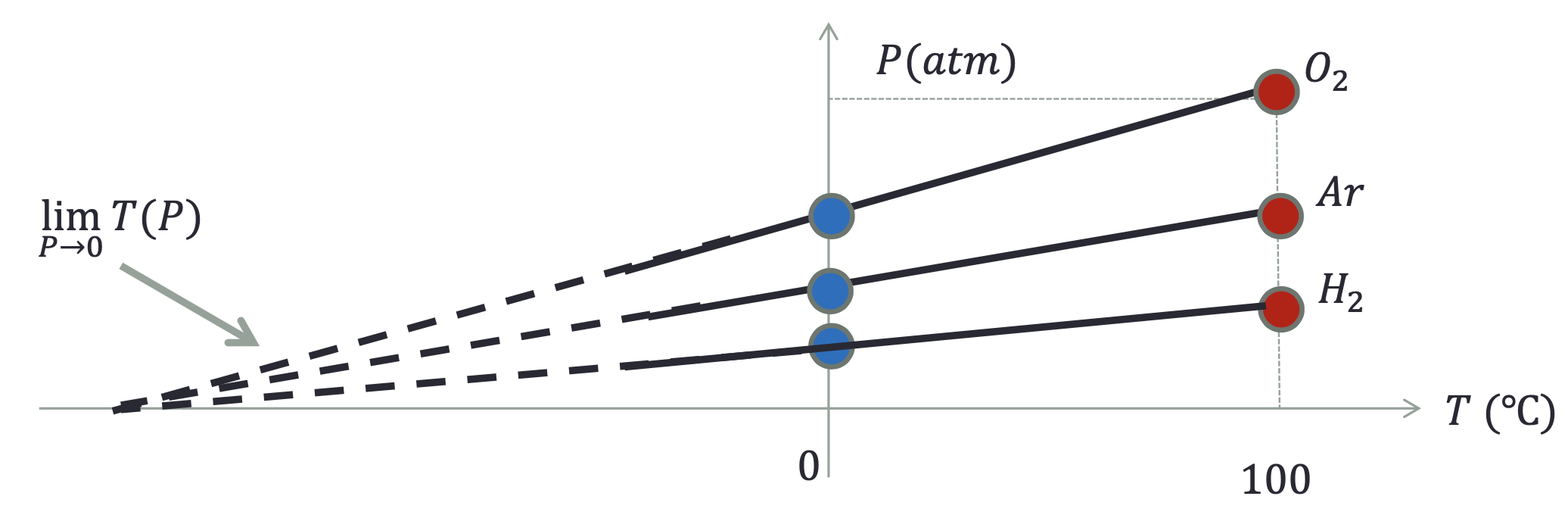
Definimos a temperatura absoluta (Kelvin):
Para qualquer outra pressão,
A escala absoluta de temperatura
A pressão para qualquer temperatura é definida a menos de um fator constante porque a pressão P é diretamente proporcional à temperatura na escala Kelvin,
Para determinar a constante, \(a\) , escolhe-se outro ponto fixo bem determinado. Por exemplo, o ponto triplo da água.
A temperatura absoluta para um termômetro à gás é, então:

Fonte: TiplerNo ponto triplo, \(P_3\) = 4,58 mmHg e \(T_3\) = 273,16 K.
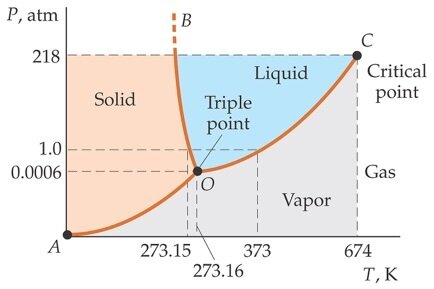
Fonte: https://phet.colorado.edu/
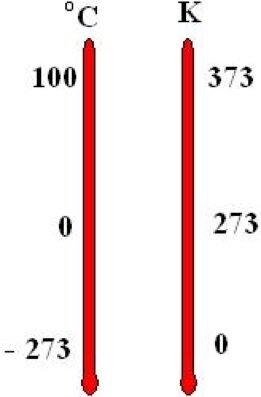
As escalas de temperatura
A escala Kelvin
A escala Kelvin foi obtida em um experimento que mesmo não dependendo do tipo particular de gás ele depende de propriedades globais do gás (baixa densidade e baixa pressão).
A temperatura absoluta T jamais pode assumir valores negativos ou nulos, ou seja, T > 0 sempre. O valor T = 0 é proibido pela Terceira lei da Termodinâmica.
As escalas de temperatura
A escala Celsius
Definem-se dois pontos fixos a pressão de 1 atm e aguarda-se o equilíbrio térmico. As temperaturas são relacionadas as alturas do coluna do líquido nos pontos de:

Vapor: (vapor de água + água pura)
Gelo: (gelo + água saturada de ar)
O comprimento da coluna de mercúrio é a propriedade termométrica,
A altura da coluna seria diferente se a substância termométrica fosse álcool, água ou algum metal?
vapor
gelo
As escalas de temperatura
A escala Fahrenheit
Definem-se dois pontos fixos a pressão de 1 atm e aguarda-se o equilíbrio térmico. As temperaturas são relacionadas as alturas do coluna do líquido nos pontos de:
Vapor: (vapor de água + água pura)
Gelo: (gelo + água saturada de ar)
O comprimento da coluna de mercúrio é a propriedade termométrica,
A relação entre as escalas Celsius e Fahrenheit é,
vapor
gelo
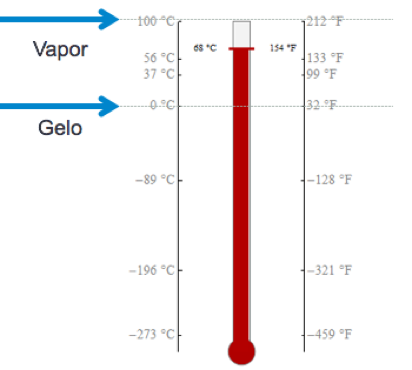
A maioria dos materiais sofre expansão ou dilatação térmica quando suas temperaturas aumentam ou se contraem quando a temperatura diminui.
Fonte: https://youtu.be/byont4iSg08
Fonte: https://youtu.be/YXE9r-gzQ3w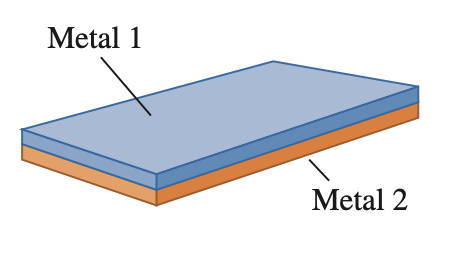
Fonte: Sears & Zemansky

Dilatação linear
Dilatação linear
Para um sólido cujo comprimento (L) é muito maior que a área de seção reta (A):
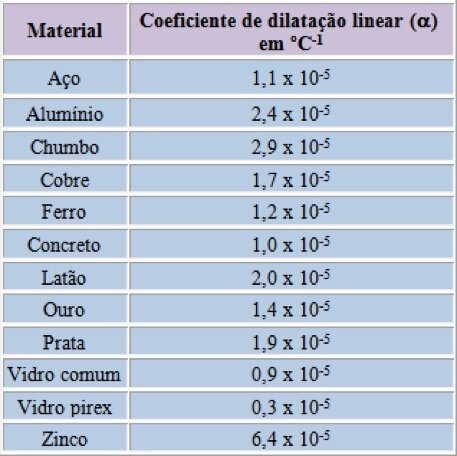
onde o coeficiente de dilatação linear (\(\alpha\)) é característico do sólido.


Fonte: https://youtu.be/ddhzTqsD6p8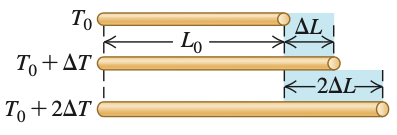
Fonte: Sears & ZemanskyEm um dado material, a varia ligeiramente com a temperatura inicial \(T_0\) e com a amplitude do intervalo de temperatura. Porém, vamos desprezar esse efeito aqui.
Dilatação superficial
Para sólidos com uma área considerável, temos:
onde o coeficiente de dilatação superficial (\(\gamma\)) é característico do sólido e (\(\gamma = 2\alpha\)).
Nas dilatações, as distâncias interatômicas aumentam ou diminuem devido à agitação térmica.
Fonte: https://youtu.be/qgDvtBdwBQ8
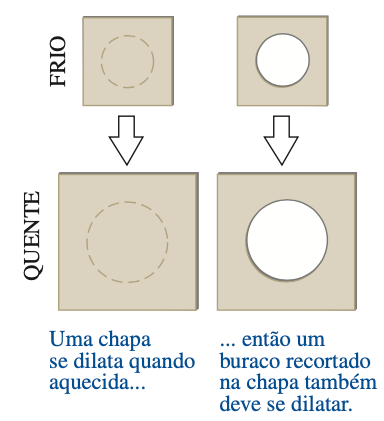
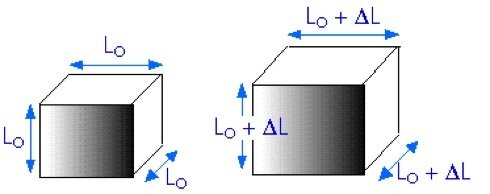
Fonte: Sears & ZemanskyQuando o objeto se dilata, o mesmo ocorre com o buraco; todas as dimensões lineares do objeto se dilatam do mesmo modo quando a temperatura varia.
Dilatação volumétrica
Para sólidos e líquidos, a dilatação volumétrica é:
onde o coeficiente de dilatação volumétrico (\(\beta\)) é característico do sólido e (\(\beta= 3\alpha\)).
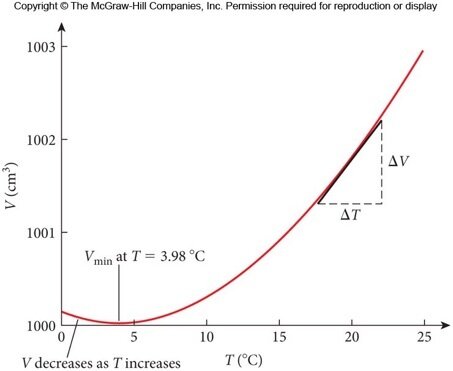
Dilatação anômala da água
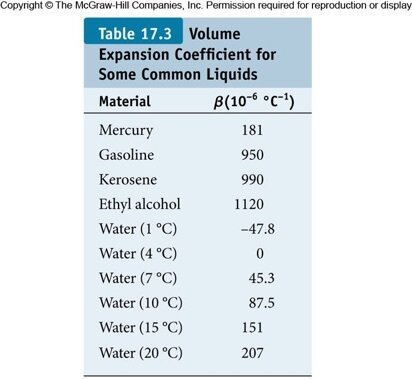
É possível a construção de um termômetro baseado em água, mas a relação entre a dilatação e a temperatura é linear para pequenos intervalos de T e a dilatação será pequena.
Fonte: Bauer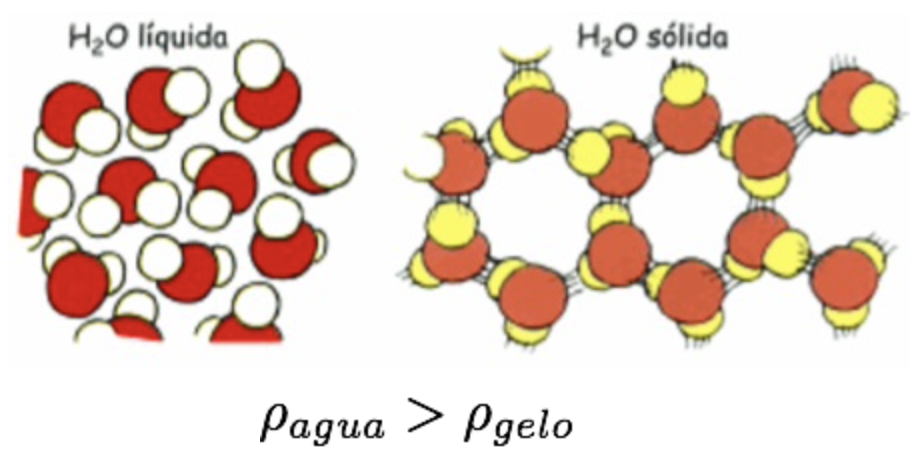
Fonte: BauerFonte: Paul G volume diminui devido ao colapso dos cristais de gelo
volume aumenta devido à maior agitação molecular
Quando a água esfria, ela afunda até que toda a lagoa esteja a 4 \(^o\)C. A água superficial é resfriada um pouco mais, ela se mantém na superfície, onde congela. Uma vez que o gelo é formado temperaturas menores do que 4 \(^o\)C podem ser atingidas nas partes mais funda da lagoa.
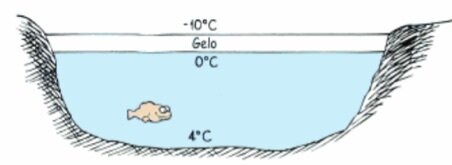
Fonte: Paul G Questão 1
O gráfico da pressão em função da temperatura para um termômetro é mostrado abaixo. Qual a relação entre estas grandezas? Qual a temperatura para uma pressão de 0,100 atm? Qual o valor da pressão para uma temperatura de 444,6 graus Celsius?
Questão 2
A temperatura ambiente geralmente é dada como 72,0 graus F. Qual é a temperatura ambiente nas escalas Celsius e Kelvin?
Questão 3
O principal vão da ponte de Macknac tem comprimento de 1158 m. A ponte é feita de aço. Suponha que a menor temperatura possível na ponte seja de -50 graus C e que a maior temperatura possível seja de 50 graus C. Quanto espaço deve estar disponível para expansão térmica no vão central da ponte?


Fonte: Bauer
Fonte: Bauer
Questão 4
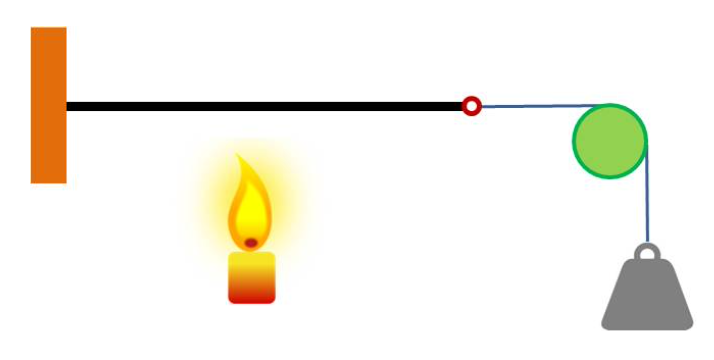
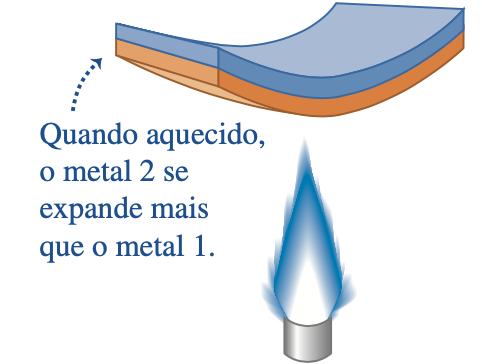
Uma lâmina bimetálica reta consiste em uma lâmina de aço e outra de latão, cada uma com 1,25 cm de largura e 30,5 cm de comprimento, soldadas juntas. Cada lâmina tem t = 0,500 mm de espessura. A lâmina bimetálica é aquecida uniformemente sobre seu comprimento, conforme mostrado na figura. Se a chama estivesse à esquerda, a lâmina se dobraria na mesma direção! A lâmina curva-se de tal forma que o raio de curvatura é R = 36,9 cm.
Qual é a temperatura da lâmina bimetálica depois de ser aquecida?

Fonte: Bauer
Questão 5
Uma placa de latão tem um orifíco com diâmetro d = 2,54 cm. O orifício é pequeno demais para que uma esfera de latão passe por ele. No entanto, quando a placa é aquecida de 20,0 graus C para 220,0 graus C, a esfera de latão passa pelo orifício da placa. Em quanto aumenta a área do orifício na placa de latão como resultado do aquecimento?
Fonte: Bauer

Questão 6
Você leva seu automóvel a um posto de gasolina em um dia quente de verão, quando a temperatura atmosférica é de 40 graus C. Você completa seu tanque vazio de 55 L com gasolina que vem de um tanque de armazenamento subterrâneo, onde a temperatura é de 12 graus C. Depois de pagar pelo combustível, você decide ir até o restaurante ao lado e almoçar. Duas horas depois, você volta a seu carro e descobre que um pouco de gasolina transbordou do tanque. Quanta gasolina transbordou?
Questão 7
O aumento do nível dos oceanos da Terra é motivo de preocupação atual. Os oceanos cobrem 3,6 x 10^8 km^2, pouco mais de 70% da área da superfície terrestre. A profundidade média dos oceanos é de 3 700 m. A temperatura superficial oceânica é muito variável, entre 35 graus C no verão no Golfo Pérsico e -2 graus C nas regiões do Ártico e Antártica. Entretanto, mesmo que uma temperatura superficial oceânica ultrapasse 20 oC, a temperatura da água rapidamente cai como função da profundidade e atinge 4 graus C a uma profunidade de 1 000 m. A temperatura global média de toda a água do mar é aproximadamente 3 graus C. Portanto, pode-se seguramente presumir que o volume da água oceânica muda muito pouco a uma profundidade maior que 1 000 m. Para os 1000 m de água oceânica a partir da superfície, vamos pressupor uma temperatura global média de 10,0 graus C e calcular o efeito da expansão térmica. Qual seria a mudança do nível do mar, unicamente como resultado da expansão térmica da água, se a temperatura da água de todos os oceanos aumentasse em 1,0 graus C?
Questão 8
A 20,0 graus C uma barra de aço e uma barra de latão têm 3,0000 m e 2,9970 m de comprimento, respectivamente. Em que temperatura as duas barras terão o mesmo comprimento?