
Aula 19
Introdução à Física Clássica II
Prof. Ronai Lisbôa
Não compreendeu algo? Algo está esquisito? Comente!
Objetivos
Ao final dessa aula você deve se capaz de:
Bibliografia
Sears & Zemansky - Vol. 2 - 14a. edição.
Capítulo 19 - A primeira lei da termodinâmica
Seções: 19.6, 19.7, 19.8
Verificar que a energia interna de um gás ideal a menos de algumas constantes é função somente da temperatura.
Os calores específicos de um gás ideal a partir da primeira lei da termodinâmica.
Estudar os processos termodinâmicos em um gás ideal:
Isocórico
Isobárico
Isotérmico
Adiabático
Motivação
Expansão adiabática
Compressão adiabática
Reduzindo a troca de calor em processos rápidos o processo é chamado de adiabático.
Quão rápido?
A energia interna
Como alterar o estado termodinâmico inicial de um gás ideal a um estado termodinâmico final?
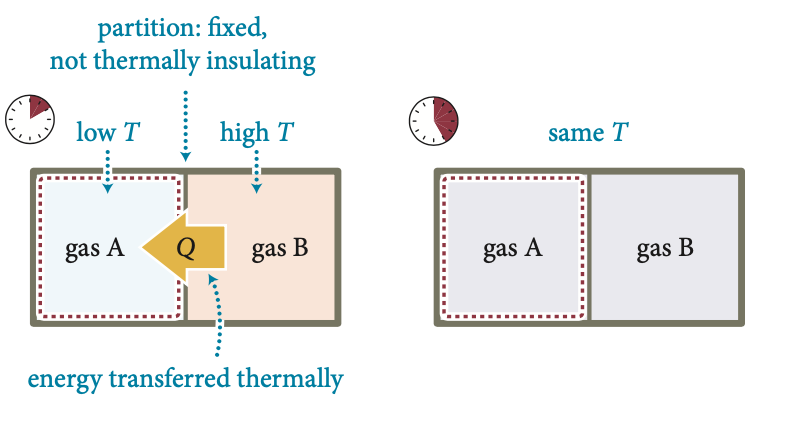
Parede fixa e diatérmica
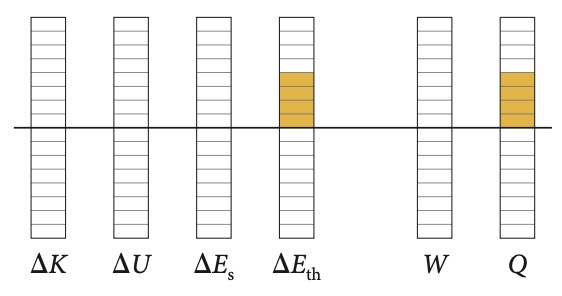
Energia transferida termicamente
Calor
Fonte: Eric MazurTrabalho adiabático
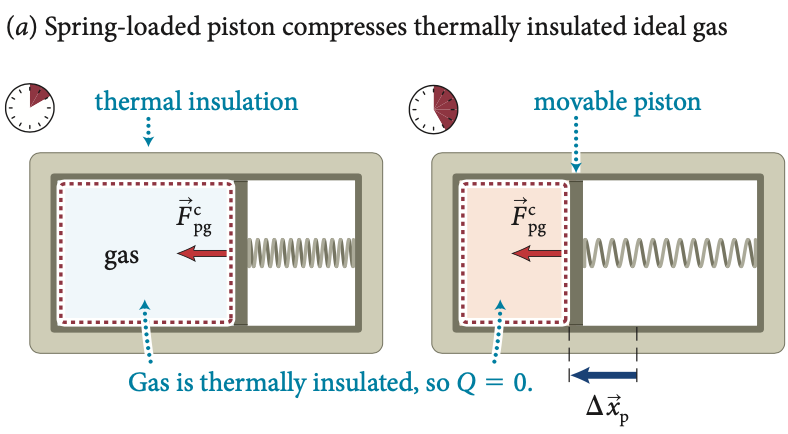
Parede fixa e adiabática
Pistão móvel e adiabático
Fonte: Eric MazurGás termicamente isolado
A energia interna
Para processos envolvendo variações infinitesimais, a primeira lei da termodinâmica é:
Para processos quase-estáticos, as variáveis termodinâmicas são bem definidas e
A primeira lei da termodinâmica fica
A energia interna, em geral, é uma função das variáveis termodinâmicas:
Portanto, é uma função de estado. Mas o calor e o trabalho não são funções de estado.
A energia interna
A energia interna \(U\) de um gás ideal depende somente de sua temperatura \(T\), e não do volume ou da pressão.
Um gás ideal deve satisfazer as equações:
Para uma dada variação de temperatura, a variação da energia interna não depende do processo.
Como é a função \(U(T)\)?
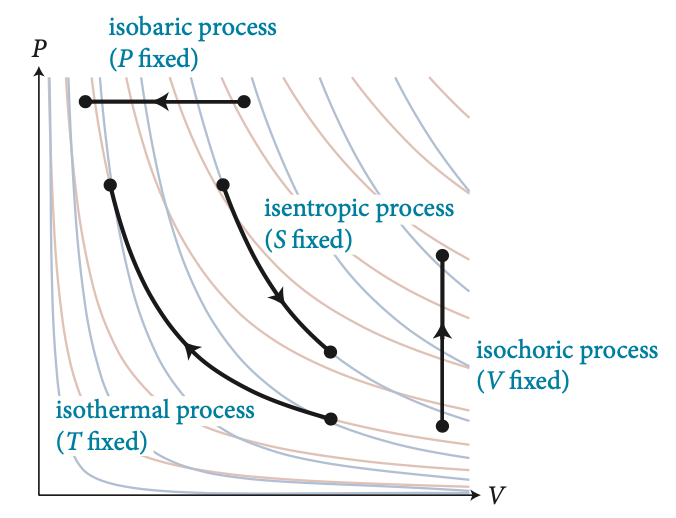
Processos isobáricos
Processos isocóricos
Processos adibáticos
Processos isotérmicos
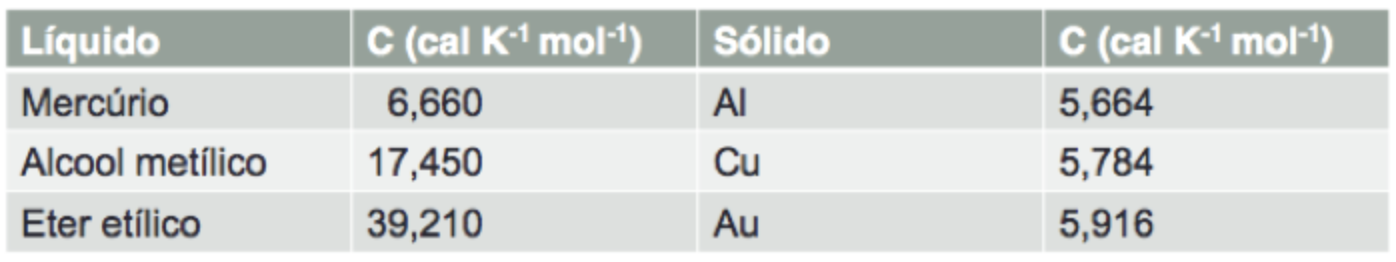
Fonte: MazurRevendo as capacidades térmicas.
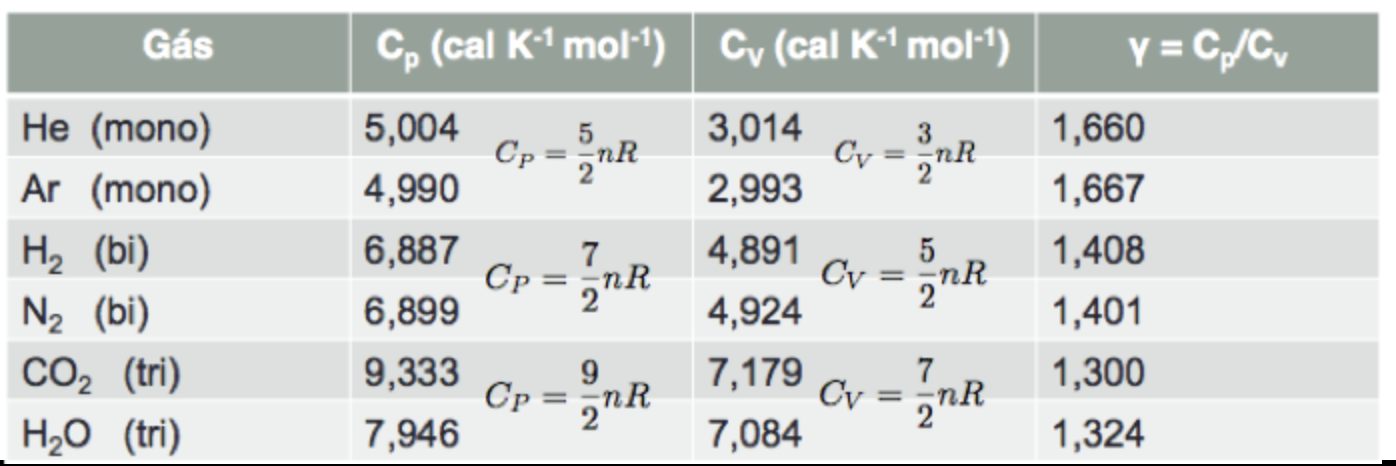
O índice adiabático é definido por:
Para um gás ideal, a capacidade térmica à pressão constante é maior do que a capacidade térmica à volume constante:
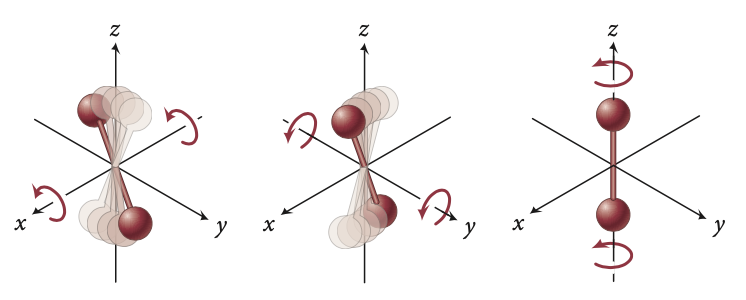
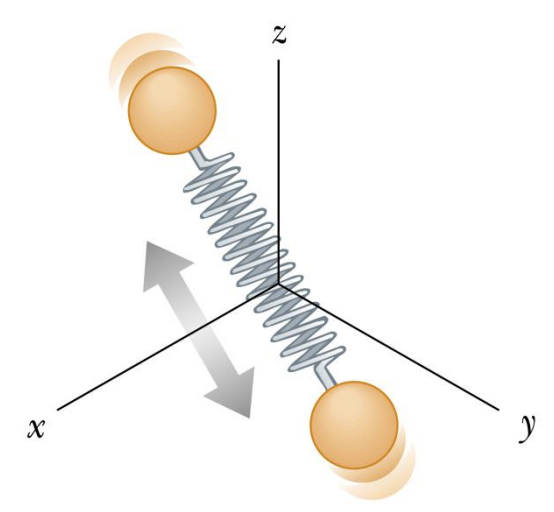

Translada nas três direções do espaço.
Translada e tem mais duas rotações: d = 3+2
Translada, rotaciona e vibra contraindo e expandindo: d = 3 + 2 + 2.
A energia interna nos processos isocóricos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmica:
No processo isocórico \(dV=0\) e não há trabalho, \(PdV=0\):
Capacidade térmica a volume constante
A energia interna nos processos isocóricos
No processo isocórico o volume é constante. O trabalho é nulo.
A primeira lei da termodinâmica:
O processo de transferência de energia se dá via calor. O trabalho realizado pelo gás é nulo porque o volume é constante.
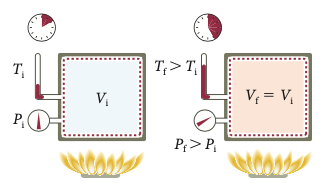
Como o volume é constante a pressão varia de forma direta com a temperatura.
Fonte: MazurA energia interna nos processos isocóricos
A energia interna de um gás ideal é função apenas da temperatura.
e
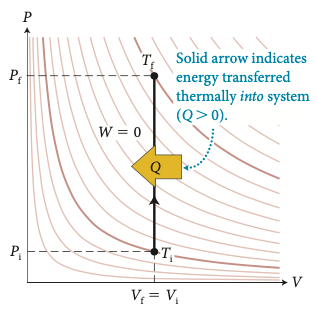
A seta indica energia transferida termicamente na forma de calor:
\(Q>0\)
Para uma variação finita:
Fonte: MazurA quantidade de calor é igual à variação da energia interna:
A quantidade de calor a volume constante aumenta a energia interna do sistema.
A energia interna nos processos isotérmicos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmcia:
No processo isotérmico \(dT=0\) e sabemos que a energia interna depende da temperatura e não depende do volume. Portanto:
Calor trocado as custas de trabalho.
A energia interna nos processos isotérmicos
No processo isotérmico a temperatura é constante. A energia interna é constante.
A primeira lei da termodinâmica:
O processo de transferência de energia se dá via calor e o trabalho realizado pelo gás e a variação da energia interna é nula.
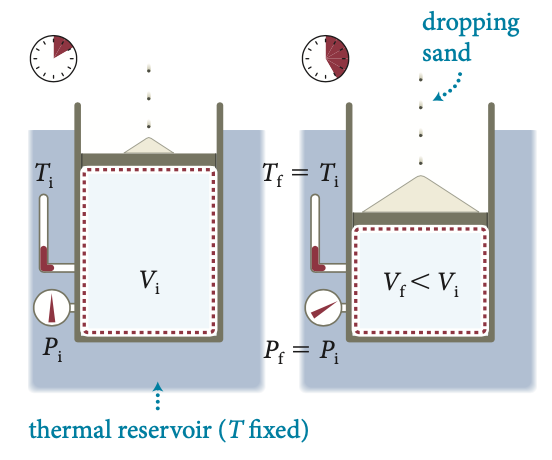
Reservatório térmico (\(T\) é fixo)
derramando areia
Fonte: MazurComo a temperatura é constante, a pressão varia de forma inversa ao volume.
A energia interna nos processos isotérmicos
e
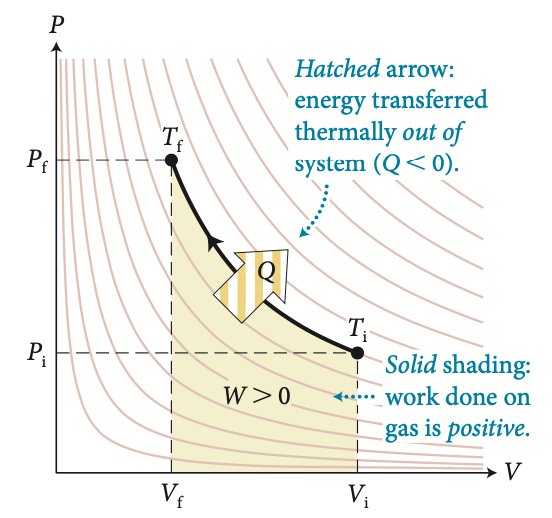
A energia é transferida termicamente na forma de calor
(\(Q<0\)).
O trabalho feito pelo gás é negativo (\(W<0\))
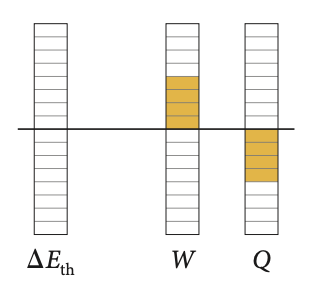

A energia interna de um gás ideal é função apenas da temperatura.
Para uma variação finita:
A quantidade de calor é igual ao trabalho:
Fonte: MazurA energia interna nos processos isobáricos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmica:
Obtemos:
Capacidade térmica à pressão constante
Entalpia: \(H=U+PV\)
A energia interna nos processos isobáricos
No processo isobárico a pressão é constante. Há calor e trabalho.
A primeira lei da termodinâmica:
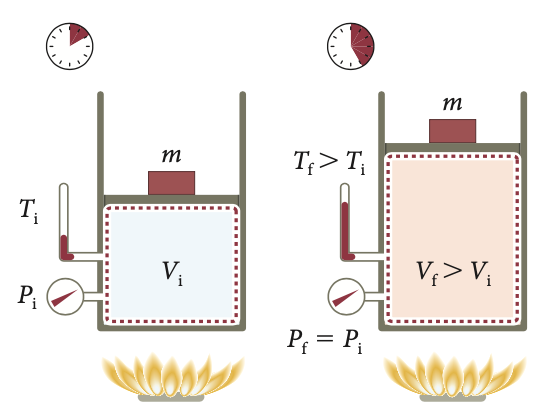
O processo de transferência de energia se dá via trabalho e calor à pressão constante.
Como a pressão é constante o volume varia de forma direta com a temperatura.
Fonte: MazurA energia interna nos processos isobáricos
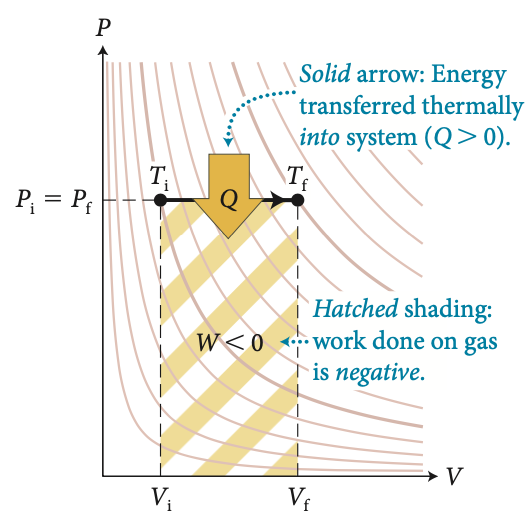
A seta indica energia transferida termicamente na forma de calor:
\(Q>0\)
O trabalho feito pelo gás é positivo
\(W>0\)


e
A energia interna de um gás ideal é função apenas da temperatura.
Para uma variação finita:
A energia interna varia as custas de trabalho e calor:
Fonte: MazurA energia interna nos processos adiabáticos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmcia:
No processo adiabático \(\delta Q=0\) e sabemos que a energia interna depende da temperatura e não depende do volume. Portanto:
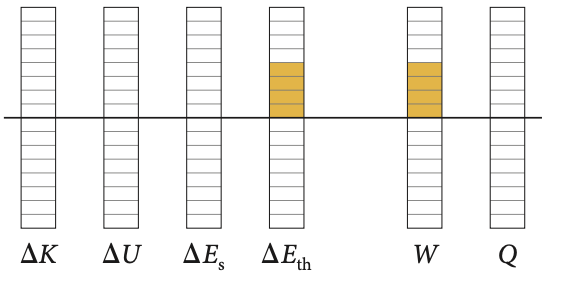
Energia interna varia as custas de trabalho.
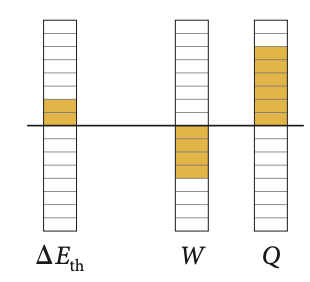
A energia interna nos processos adiabáticos
No processo adiabático não há troca de calor.
A primeira lei da termodinâmica:
e
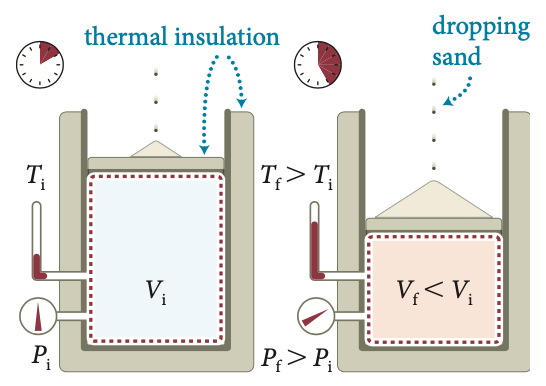
Paredes adiabáticas
Queda de areia
Fonte: MazurPara um processo Entre dois estados inicial e final:
O processo de transferência de energia se dá via trabalho adiabático.
A energia interna nos processos adibáticos
e
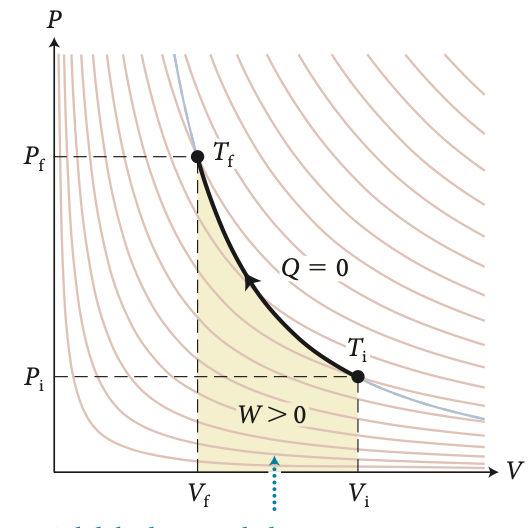
Na compressão adiabática há um aumento da temperatura as custas de trabalho negativo.
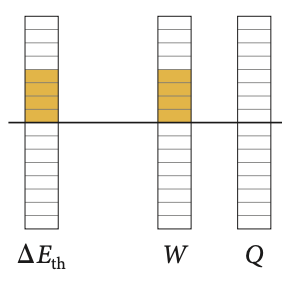

Entre dois estados inicial e final:
A energia interna de um gás ideal é função apenas da temperatura.
O trabalho adiabático é função dos estados inicial e final.
A energia interna nos processos adibáticos
Na expansão, o trabalho realizado pelo gás é positivo e isto diminui a energia interna. Na compressão, o trabalho realizado pelo gás é negativo, mas a energia interna aumenta.
O efeito é uma queda de temperatura na expansão e um aumento da temperatura na compressão.
O trabalho adiabático depende somente dos estados final e inicial.
Para uma mesma variação de volume:
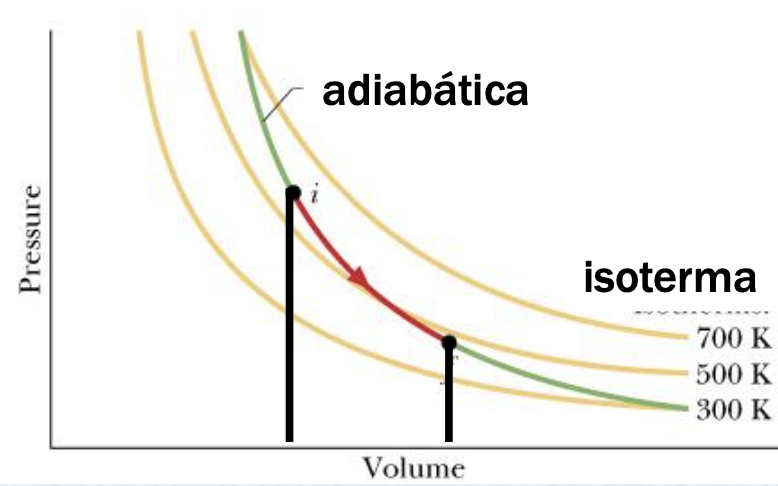
Uma expansão adiabática tem uma pressão final menor do que uma expansão isotérmica.
A temperatura diminui durante a expansão adiabática.
Questão 1
Um gás não-ideal possui uma equação de estado da forma
(P − P_0)V = nRT.
Dois moles deste gás são submetidos a uma expansão isotérmica a T=287,7 K, aumentando o volume do gás de V_i=10, 0 L para V_f=50, 0 L. Qual o trabalho realizado pelo gás no processo?
(Observações: R = 0, 082(atm.L)/(mol.K) e P_0 =0,20 atm).
Questão 2
Um litro de oxigênio à temperatura de 27 oC e a uma pressão de 10 atm se expande adiabaticamente até quintuplicar de volume. Quais são a pressão e a temperatura finais? Calcule o trabalho adiabático e o trabalho isotérmico.
Questão 3
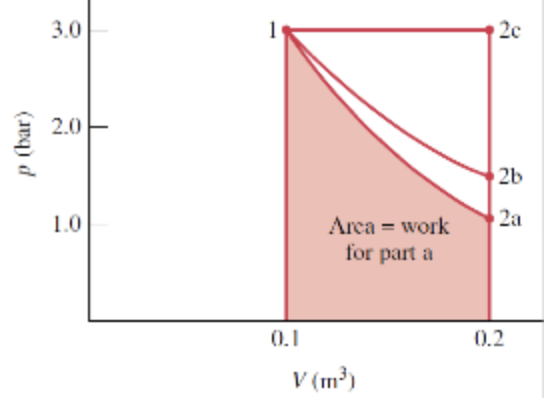
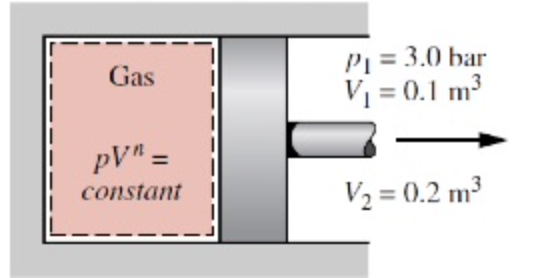
Um gás em uma montagem pistão-cilindro é submetido a um processo de expansão para o qual a relação entre a pressão e o volume é dada por
A pressão inicial é 3 x 10^5 N/m^2, o volume inicial é 0,1 m^3 e o volume final é 0,2 m^3. Determine o trabalho para o processo, em kJ, se:
a) n = 1,5
b) n 1,0
c) n = 0
Questão 4
Uma amostra de 1,00 mol de um gás diatômico ideal se expande. Esta expansão é representada pela linha reta de 1 a 2 no diagrama PV. Depois, o gás é comprimido isotermicamente. Esta compressão é representada pela linha curva de 2 a 1 no mesmo diagrama. Calcule o trabalho total realizado no ciclo.
Dados: P_1 = 2,00 atm; V_1 = 11,5 L; P_2 = 1,00 atm. Use R = 0,082 amt.L/(mol.K).
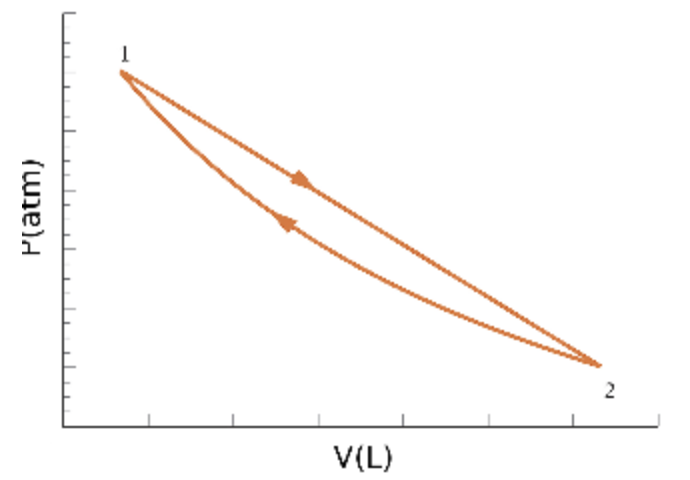
Questão 5
Uma lata de tinta spray, selada e praticamente vazia, ainda contém uma quantidade residual do propelente: 0,020 mol de gás nitrogênio. A etiqueta na lata alerta claramente: “Não incinerar”. (a) Explique este alerta e desenhe um diagrama PV para o gás no caso de a lata ser submetida a uma temperatura alta. (b) Você está encarregado de testar a lata. O fabricante alega que ela pode suportar uma pressão interna de gás de 6,00 atm antes de explodir. A lata está, inicialmente, nas condições normais de temperatura e pressão em seu laboratório. Você inicia o aquecimento da lata uniformemente, usando um aquecedor com uma potência de saída de 200 W. A lada e o aquecedor estão em um forno isolado e você pode supor que 1,0 % do calor liberado pelo aquecedor seja absorvido pelo gás na lata. Quanto tempo você espera que o aquecedor permaneça aceso antes de a lata explodir?
Questão 6
A capacidade térmica a volume constante de certa quantidade de gás monoatômico é 49,8 J/K. (a) Determine o número de moles do gás. (b) Qual é a energia interna do gás a T = 300 K? (c) Qual é a sua capacidade térmica à pressão constante?
Dado: R =8,314 J/(mol.K)
Questão 7
Neste problema, 1,00 mol de um gás ideal diatômico é aquecido, a volume constante, de 300 K a 600 K. (a) Determine o aumento da energia interna do gás, o trabalho realizado pelo gás e o calor por ele absorvido. (b) Determine as mesmas quantidades para quando o gás é aquecido de 300 K a 600 K à pressão constante. Use a primeira lei da termodinâmica e seus resultados da parte (a) para calcular o trabalho realizado pelo gás. (c) Calcule novamente o trabalho na parte (b), agora integrando a equação dW = PdV (trabalho do gás).
Questão 8
Uma amostra de 0,500 mol de um gás monoatômico ideal, a 400 kPa e 300 K, expande-se quase-estaticamente até que sua pressão diminua para 160 kPa. Determine a temperatura e o volume finais do gás, o trabalho realizado por ele e o calor que ele absorve, se a expansão é (a) isotérmica e (b) adiabática.
Questão 9
Uma amostra de 0,500 mol de gás hélio expande-se adiabaticamente e quase-estaticamente, de uma pressão inicial de 5,00 atm e uma temperatura de 500 K para uma pressão final de 1,00 atm. Determine (a) a temperatura final do gás, (b) o volume final do gás, (c) o trabalho realizado pelo gás e (d) a variação da energia interna do gás.
Questão 10
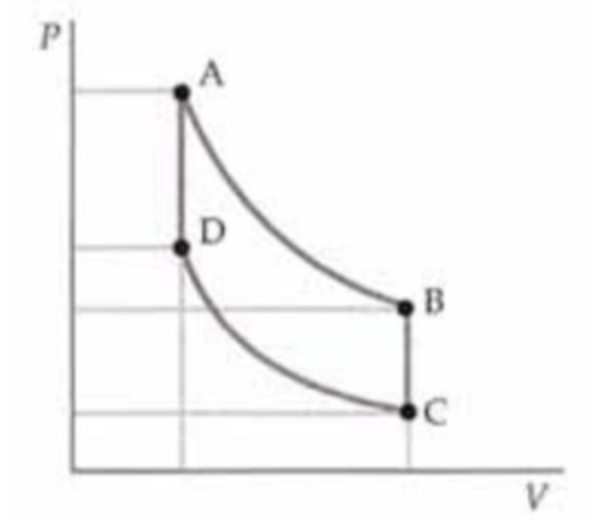
No ponto D da figura, a pressão e a temperatura de 2,00 mols de um gás monoatômico ideal são 2,00 atm e 360 K, respectivamente. O volume do gás no ponto B do diagrama PV é igual a três vezes o volume no ponto D e su a pressão é o dobro da pressão no ponto C. Os caminhos AB e CD representam processos isotérmicos. O gás é conduzido através de um ciclo completo ao longo do caminho DABCD. Determine o trabalho realizado pelo gás e o calor do processo, em cada etapa do ciclo.
A energia interna
Experimentalmente, verifica-se que em um processo de expansão livre, um gás ideal ao expandir:
A pressão e volume do gás variam na expansão livre:
Não transfere energia através da fronteira na forma de trabalho:
Não transfere energia através da fronteira na forma de calor:
Não altera a temperatura da vizinhança:
Logo, a variação da energia interna é nula:
A energia interna
Seja a energia interna como função da temperatura e pressão:
A partir das observações experimentais da expansão livre de um gás ideal:
Para uma variação infinitesimal da temperatura e pressão:
O resultado mostra que a energia interna de um gás ideal não depende da pressão e depende da temperatura.
\(U\) não é função de \(T\).
Para que \(dU=0\), as condições são:
\(U\) não é função de \(P\).
A energia interna
Seja a energia interna como função da temperatura e pressão:
A partir das observações experimentais da expansão livre de um gás ideal:
Para uma variação infinitesimal da temperatura e pressão:

O resultado mostra que a energia interna de um gás ideal não depende do volume e depende da temperatura.
Para que \(dU=0\), as condições são:
\(U\) não é função de \(V\).
\(U\) não é função de \(T\).
A energia interna nos processos isocóricos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmcia:
Obtemos:
No processo isocórico \(dV=0\) e não há trabalho, \(PdV=0\):
Capacidade térmica a volume constante
Energia interna é função apenas de \(T\)
A energia interna nos processos isotérmicos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmcia:
Obtemos:
No processo isotérmico \(dT=0\) e sabemos que a energia interna depende da temperatura e não depende do volume. Portanto:
Calor trocado as custas de trabalho.
A energia interna nos processos isobáricos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmica:
Obtemos:
No processo isobárico \(dP=0\):
Capacidade térmica à pressão constante
Entalpia: \(H=U+PV\)
A energia interna nos processos adiabáticos
Partindo da expressão geral:
E a partir da primeira lei da termodinâmcia:
Obtemos:
No processo adiabático \(\delta Q=0\) e sabemos que a energia interna depende da temperatura e não depende do volume. Portanto:
Energia interna varia as custas de trabalho.
Entalpia. O experimento de Joule-Thomson.
Nos refrigeradores, o gás (substância de trabalho) deve em algum momento diminuir a temperatura para que o gás entre no refrigerador a uma temperatura menor do que a do seu interior.
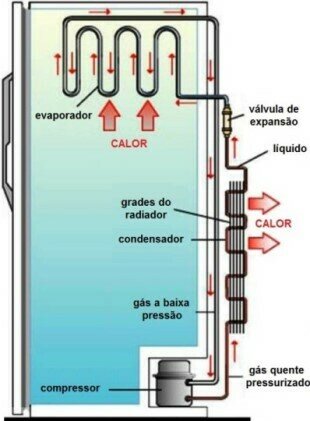
A válvula de expansão controla a entrada do líquido no evaporador, que tem sua pressão diminuída, permitindo assim sua vaporização. Como esse é um processo endotérmico, a temperatura dos arredores diminui para cerca de -19ºC
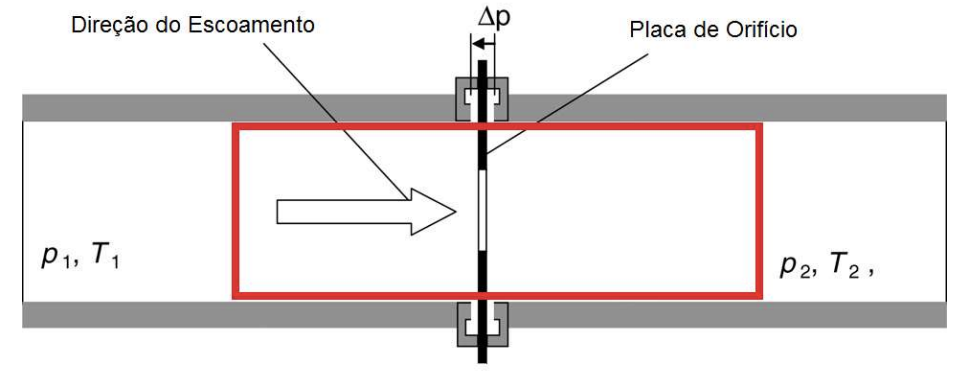
A pressão e temperatura variam. Verifica-se experimentalmente:
Entalpia. O experimento de Joule-Thomson.
Sejam dois gases separados por um tampão poroso. O gás da esquerda ao expandir não transfere energia através da fronteira na forma de calor, \(Q=0\).
A entalpia \(H=U+PV\) é uma quantidade conservada (isoentálpico).

O fluido ao passar por um estrangulamento ou tampão poroso fica sujeito ao processo termodinâmico:
Entalpia. O experimento de Joule-Thomson.
Para processos onde a entalpia seja constante:
A entalpia é função de estado: \(H = H(P,T)\).
O coeficiente de Joule-Thomson:
Para \(\mu_{J-T} = 0 \Rightarrow T_2 = T_1\).
Para \(\mu_{J-T} < 0 \Rightarrow T_2 < T_1\).
Para \(\mu_{J-T} > 0 \Rightarrow T_2 >T_1\).
Qual gás diminui de temperatura em um processo de Joule-Thomson?