Aula 20
Introdução à Física Clássica II
Prof. Ronai Lisbôa
Não compreendeu algo? Algo está esquisito? Comente!
Objetivos
Ao final dessa aula você deve se capaz de:
Bibliografia
Sears & Zemansky - Vol. 2 - 14a. edição.
Capítulo 18 - Propriedades térmicas da matéria.
Seção: 18.1
Analisar como os gases respondem a mudanças de temperatura, pressão e volume.
Obter as leis empíricas dos gases.
Obter a equação de estado do gás ideal.
Motivação
Danos a estruturas devido a diferenças de pressão e temperatura a volume constante.
Volume
Espontaneamente um gás é uma substância que se expande para preencher o recipiente onde é colocado.
O volume de um gás é o volume de seu recipiente.
Temperatura
Pressão
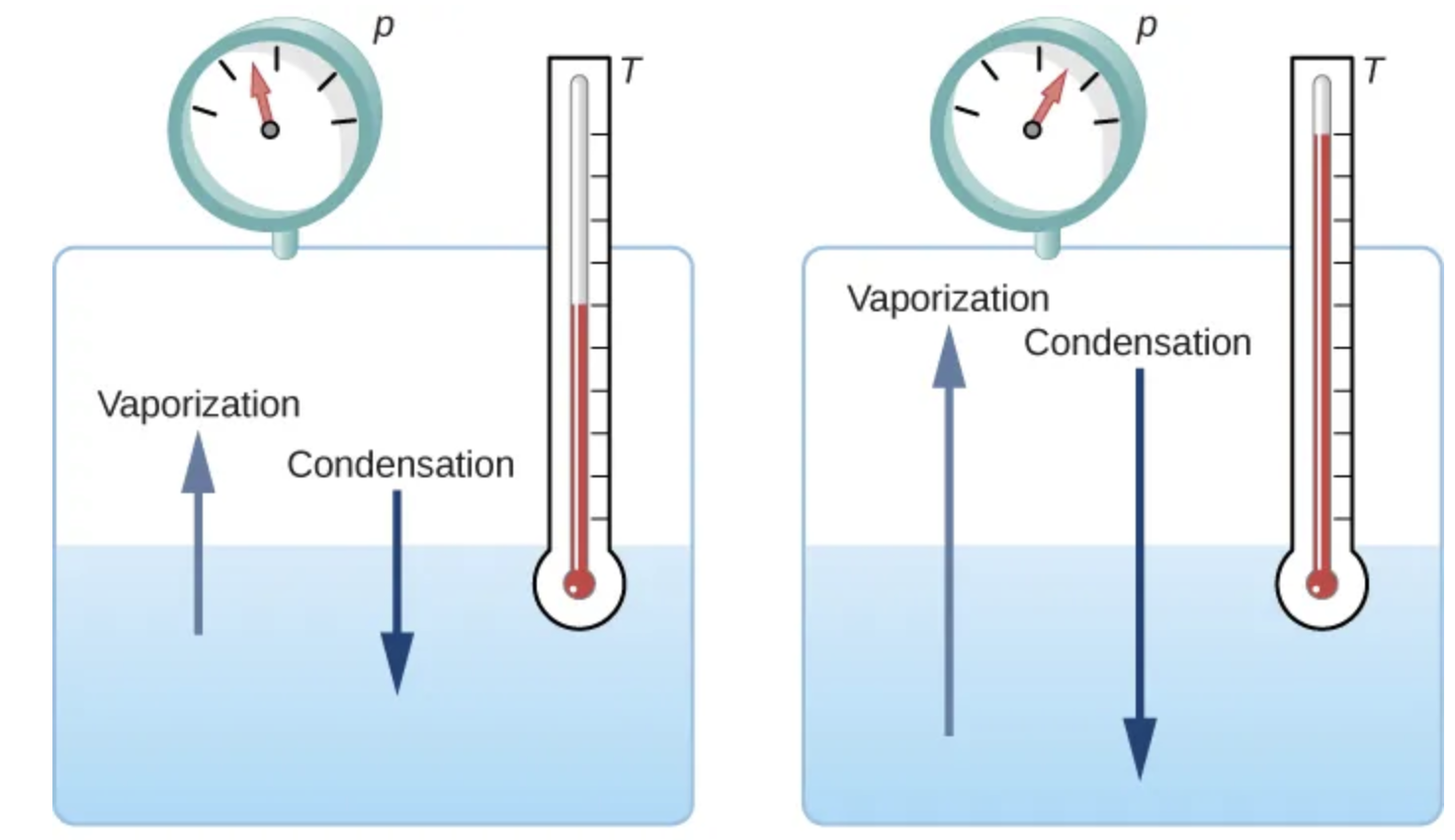
A temperatura é uma grandeza que permite dizer o sentido do fluxo de calor.
A temperatura é uma medida do grau de agitação térmica.
A pressão é a força por unidade de área exercida pelas moléculas de gás sobre as paredes de um recipiente.
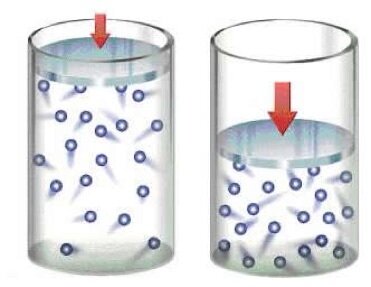
A pressão é uma medida da interação molecular com as paredes do recipiente.
Todas as grandezas (P, V, T) estão associadas de alguma forma ao número de átomos eou moléculas que compõe o gás.
As leis empíricas dos gases
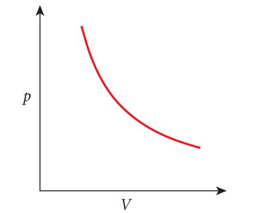
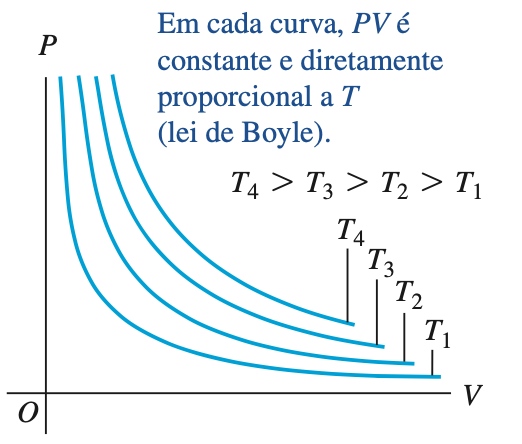
A lei de Boyle (1662) e Mariotte (1676)
O produto da pressão de um gás (P) e seu volume (V), à temperatura constante é uma constante
O produto \(P_1V_1\) de um gás no tempo \(t_1\) é igual ao produto \(P_2V_2\) no tempo \(t_2\) do mesmo gás:
Fonte: BauerFonte: Sears & Zemansky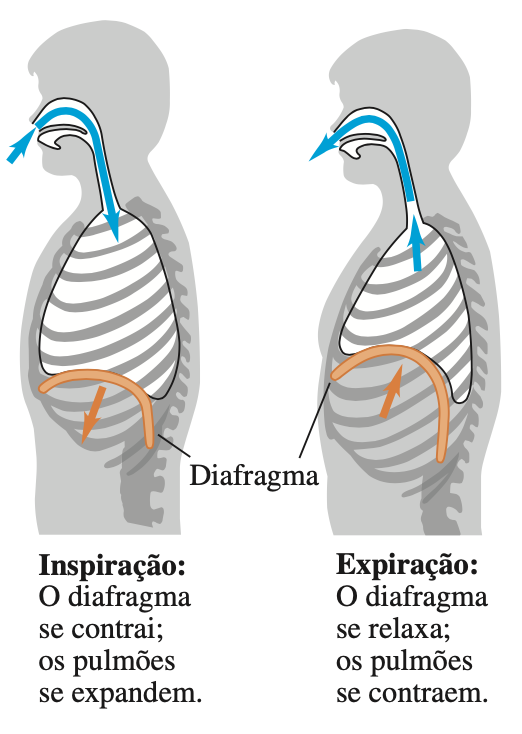
Quando o volume de ar aumenta dentro do pulmão a pressão diminui (o ar entra). Quando o volume diminui dentro do pulmão a pressão aumenta (o ar sai).
Diagrama PV
As leis empíricas dos gases
A lei de Charles (1787)
Para um gás mantido à pressão constante (P), o volume desse gás (V), dividido por sua temperatura (T), é constante.
A razão \(V_1/T_1\) de um gás no tempo \(t_1\) é igual à razão \(V_2/T_2\) no tempo \(t_2\) do mesmo gás e com mesma pressão no tempo \(t_1\):
Fonte: Bauer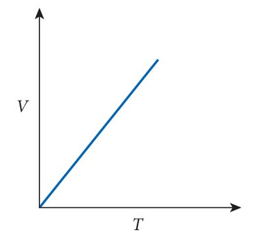

Fonte: BauerQuando a temperatura do ar quente dentro do balão aumenta, o volume do ar e do balão aumentam se a pressão é mantida constante.
Diagrama VT
As leis empíricas dos gases
A lei de Gay-Lussac (1802)
A razão entre a pressão (P) de um gás e sua temperatura (T) com o mesmo volume é constante.
A razão \(P_1/T_1\) de um gás no tempo \(t_1\) é igual à razão \(P_2/T_2\) no tempo \(t_2\) do mesmo gás e com mesmo volume no tempo \(t_1\):
Fonte: BauerFonte: Freepic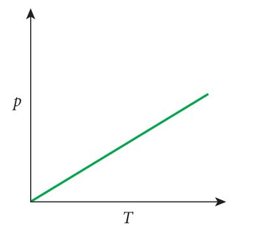

Diagrama PT
Quando a temperatura da panela e do conteúdo dentro dela aumentam, a pressão também aumenta se o volume é mantido constante.
As leis empíricas dos gases
A lei de Avogadro (1811)
A razão entre o volume de um gás (V), e o número de moléculas do gás (N), nesse volume é constante se a pressão e a temperatura forem constantes.
A razão \(V_1/N_1\) de um gás no tempo \(t_1\) é igual à razão \(V_2/N_2\) no tempo \(t_2\) do mesmo gás e com mesma pressão e temperatura no tempo \(t_1\):
Em um volume de 22,4 L, temperatura de 273,15 K e pressão de 100 kPa, existem:
moléculas, o número de Avogadro. Em \(n\) mols de gás existem \(N_A\), assim:
As leis empíricas dos gases
A lei de Bernoit Paul Emile Claperyon (1834) - A equação de estado do gás ideal.
A lei de Boyle-Mariotte
A lei de Charles
Fonte: Moyses NussenveigIsotermas
Adiabáticas
As leis empíricas dos gases
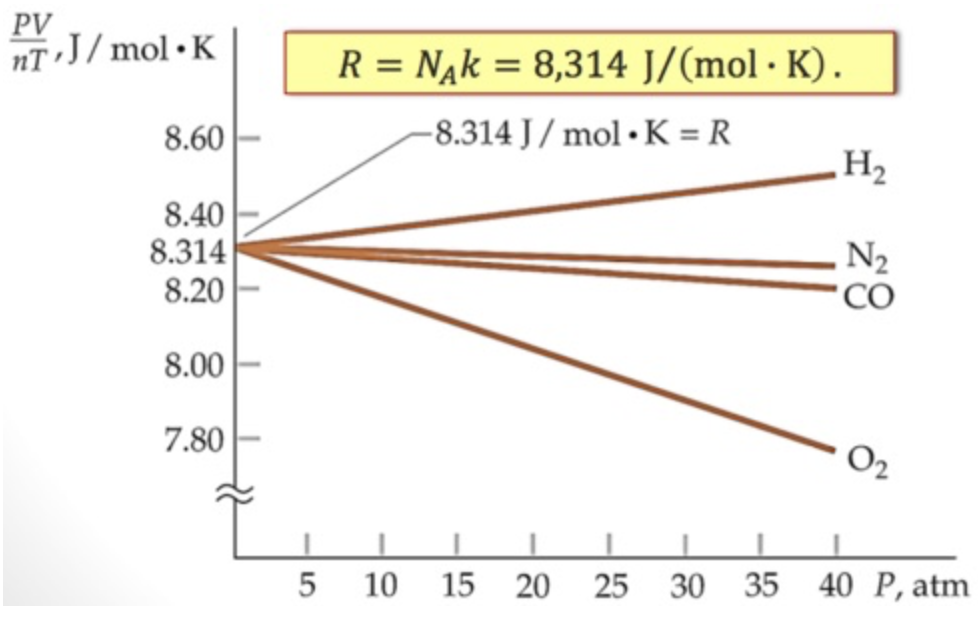
A equação de estado do gás ideal para baixas densidades e pressões.
A constante depende da natureza do gás e de sua quantidade:
A constante \(k_B\) tem o mesmo valor para qualquer tipo de gás. É uma constante universal.
é a constante de Boltzmann e que permite escrever a equação de estado do gás ideal:

As leis empíricas dos gases
Uma vez que \(N=nN_A\), a equação de estado do gas ideal pode ser reescrita como:
Definindo a constante universal dos gases, reescremos a equação de estado dos gases ideais,
a equação de estado do gás ideal:
Tal equação relaciona uma variável termodinâmica a outras duas:
Fonte: BauerAs leis empíricas dos gases
Um gás pode ser aproximado para um gás ideal quando a pressão é baixa e as temperaturas são altas. Assim,
Um gás real para pressões e temperaturas quaisquer algumas correções são necessárias.
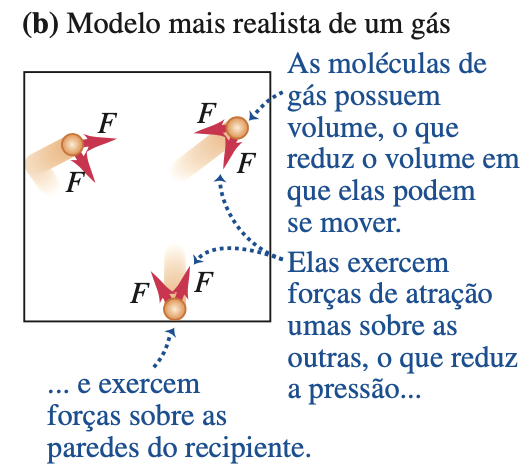
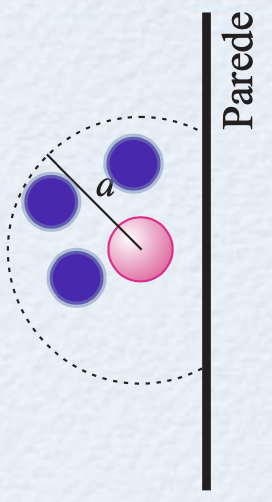
Fonte: Sears & ZemanskyO volume total das moléculas é \(nb\), e o volume resultante disponível para o movimento das moléculas é \(V - nb\):
A constante \(a\) depende da força de atração entre as moléculas, que reduz a pressão do gás puxando as moléculas para perto umas das outras enquanto elas empurram as paredes do recipiente.
As leis empíricas dos gases
Em homenagem ao físico alemão J. D. van der Waals, a equação para gases a pressões temperaturas que não satisfazem aquelas de um gás ideal é:
Para o gás dióxido de carbono (CO2):
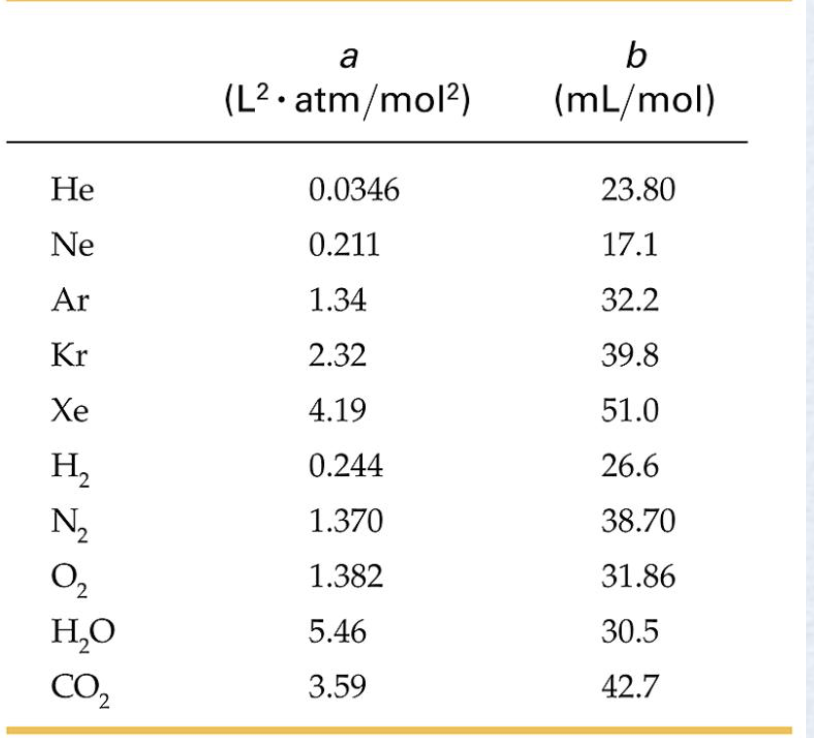
Fonte: Tipler1 mol de CO2 (ideal) quando T = 273,15 K e P = 1 atm ocupa um volume V = 0,0224 m\(^3\).
1 mol de CO2 (real) ocupando esse volume nessa temperatura estaria sob uma pressão de 0,996 atm abaixo de 1 atm, uma diferença de apenas 0,5% em relação ao valor obtido com a equação do gás ideal.
As leis empíricas dos gases
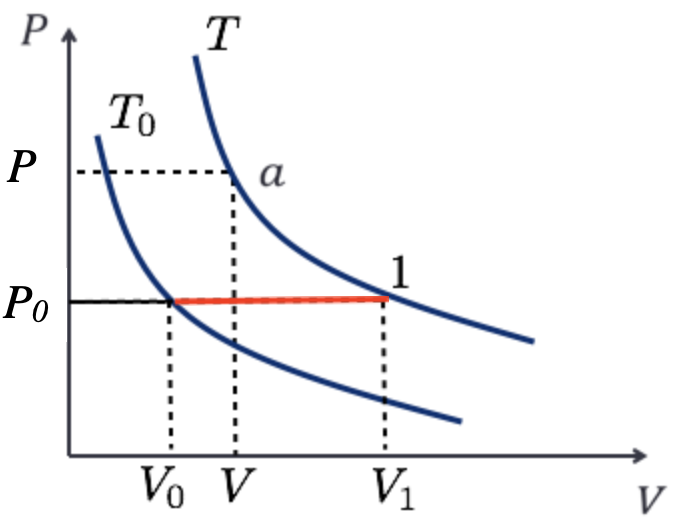
Denomina-se diagrama PV o gráfico em que cada curva representa o comportamento do gás a uma temperatura específica é chamada de isoterma, ou isoterma PV.
Gás ideal
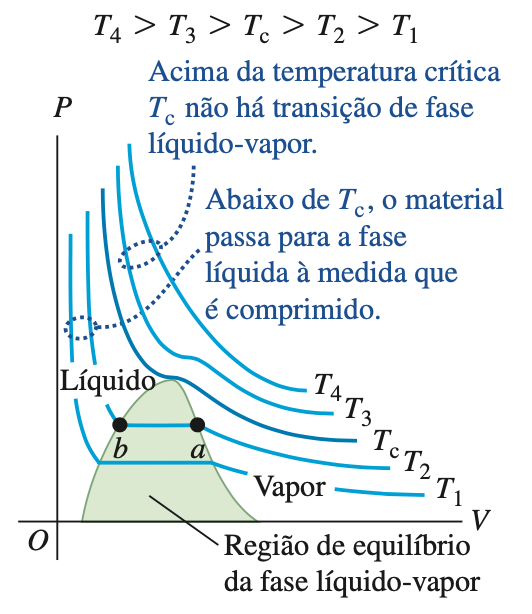
Gás real
Fonte: Sears & ZemanskyFonte: Sears & ZemanskyAs isotermas num diagrama PV são descritas com boa precisão pela equação de van der Waals, exceto na região de coexistência líquido-vapor.
Na região de coexistência, à medida que o volume diminui, uma quantidade cada vez maior do material passa da fase vapor para a fase líquida, porém a pressão permanece constante.
Para temperaturas menores que \(T_c\), as isotermas ficam paralelas ao eixo do volume.
As leis empíricas dos gases
As curvas achatadas das isotermas na parte sombreada da figura representam condições de equilíbrio da fase líquido-vapor.

Gás real
Fonte: Sears & ZemanskyQuando comprimimos um gás, mantendo a temperatura constante \(T_2\), ele permanece na fase vapor até que o ponto \(a\) seja atingido. A seguir, ele começa a se liquefazer; à medida que seu volume diminui, maior quantidade do material se liquefaz, e tanto a temperatura quanto a pressão permanecem constantes.
No ponto \(b\), o material está todo na fase líquida. Depois desse ponto, posterior compressão do material resulta em um elevado aumento da pressão, porque os líquidos geralmente são muito menos compressíveis que os gases.
Nas temperaturas superiores a \(T_c\), nenhuma transição de fase ocorre quando o material é comprimido;
https://learncheme.com/simulations/thermodynamics/thermo-1/pressure-volume-diagram-for-water/
As leis empíricas dos gases
O ponto crítico é a posição limite do vapor e líquido saturados coincidirem para uma mesma pressão e temperatura.
Fonte: Alaor ChavesA inclinação da isoterma no ponto crítico é nula no diagrama PV. Nestas condições, obtemos os pontos críticos:
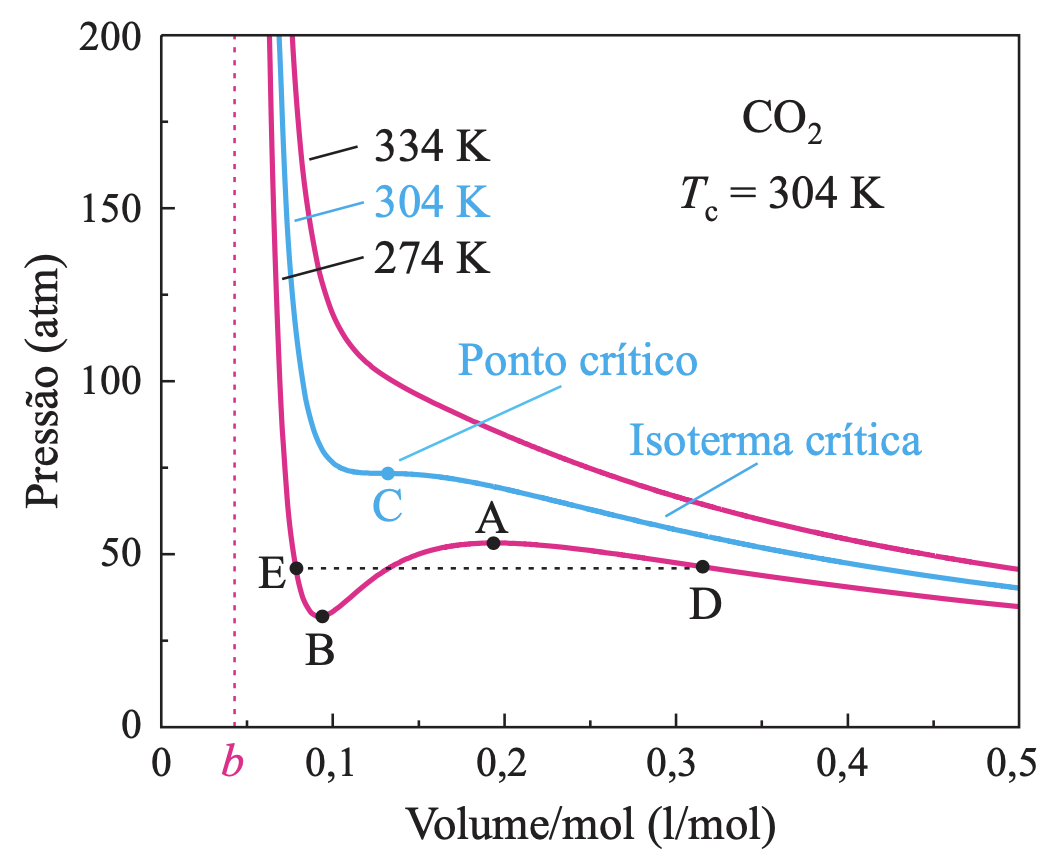
https://learncheme.com/simulations/thermodynamics/thermo-1/pressure-volume-diagram-for-water/
As leis empíricas dos gases
O ponto crítico é a posição limite do vapor e líquido saturados coincidirem para uma mesma pressão e temperatura.
Fonte: Alaor Chaves
A compressibilidade do gás é dada pela equação:
Proibido, pois volume e pressão aumentam!
Vapor supersaturado
Líquido supersaturado
METAESTADOS
As Transições de Fases
Cada fase só é estável em certos intervalos de temperatura e pressão.
A transição de uma fase para outra geralmente ocorre quando existem condições de equilíbrio de fase entre as duas fases, e para uma dada pressão isso ocorre somente em uma temperatura específica.
Podemos representar essas condições em um gráfico de P em função de T, chamado diagrama de fase
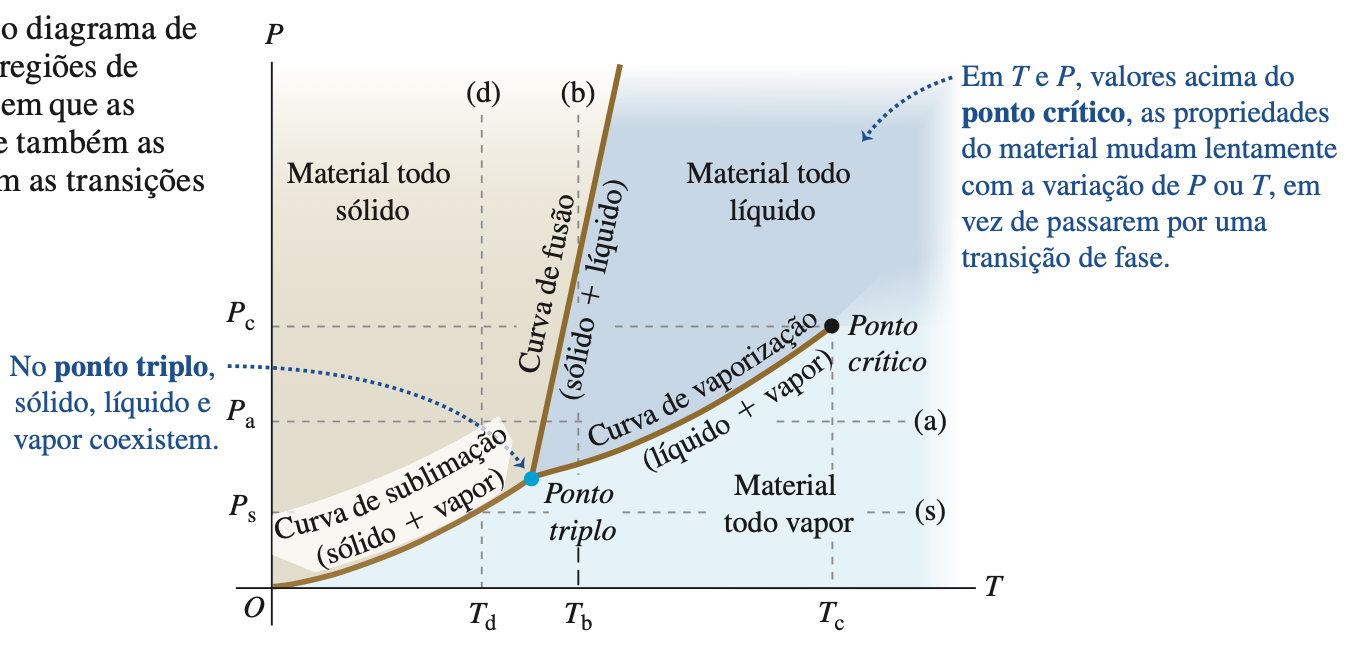
Fonte: Sears & ZemanskyExiste apenas uma única fase em cada ponto, exceto nos pontos sobre linhas contínuas, em que duas fases coexistem em equilíbrio de fase.
As Transições de Fases
Cada fase só é estável em certos intervalos de temperatura e pressão.
As três curvas se encontram em um ponto denominado ponto triplo, o único ponto do diagrama onde as três fases podem coexistir.
Fonte: Tipler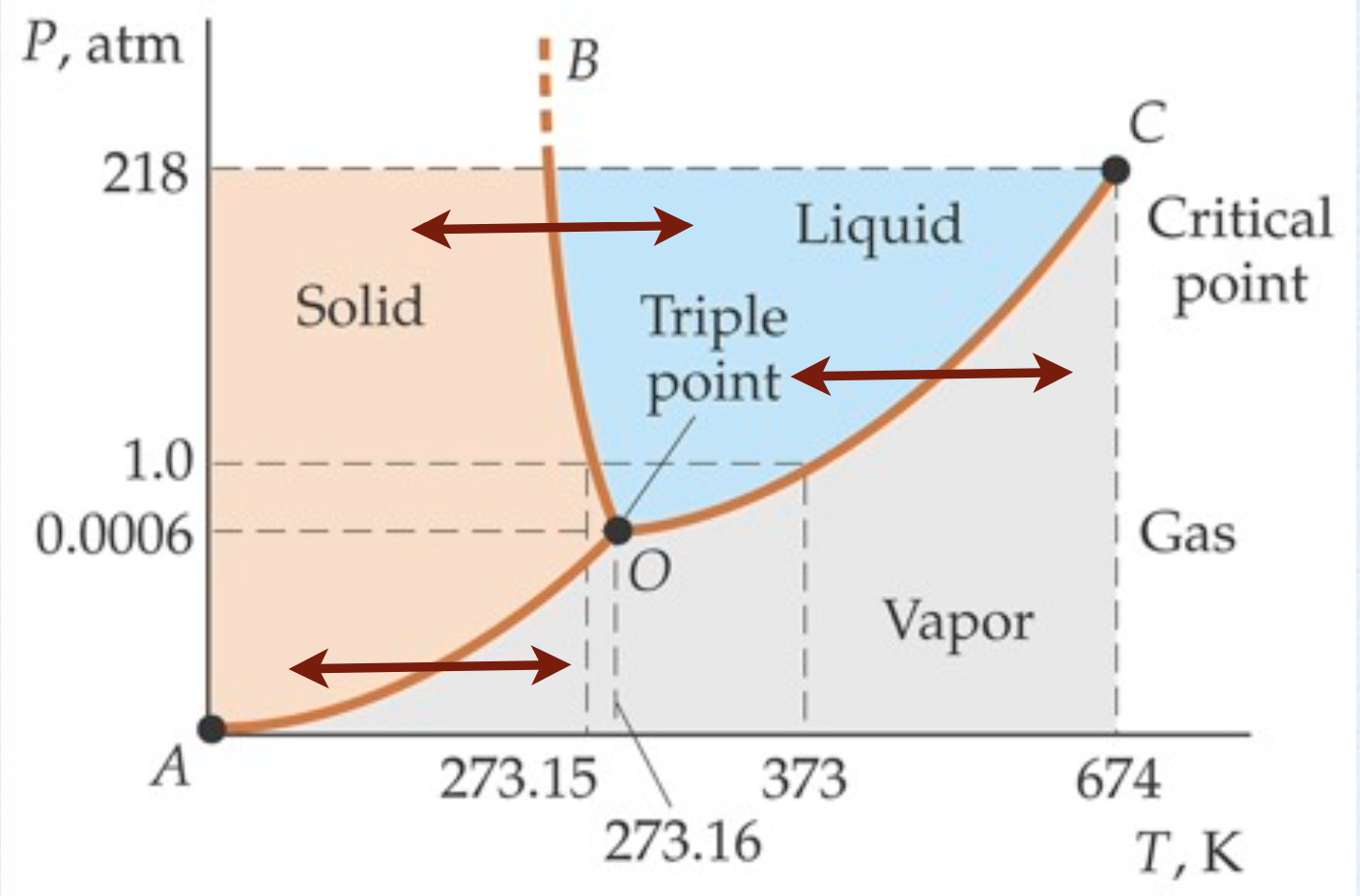
Fonte: https://youtu.be/MP6MVLWuNZQ
OA: Sublimação
OB: Fusão
OC: Pressão de vapor
As Transições de Fases
Cada fase só é estável em certos intervalos de temperatura e pressão.
As três curvas se encontram em um ponto denominado ponto triplo, o único ponto do diagrama onde as três fases podem coexistir.
No ponto crítico, um gás submetido a uma pressão maior que a do ponto crítico não se separa em duas fases quando é resfriado à pressão constante.
Suas propriedades variam continuamente e se afastam do comportamento de um gás ideal até chegar gradual- mente ao comportamento de um líquido sem que ocorra uma transição de fase.
https://learncheme.com/simulations/thermodynamics/thermo-1/pressure-temperature-phase-diagram-for-water/
As Transições de Fases
O ponto triplo de várias substâncias.
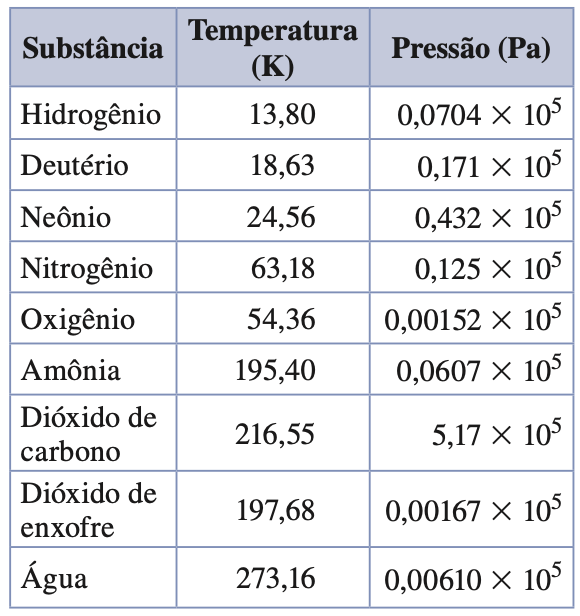
Fonte: Sears & ZemanskyExatamente no ponto crítico, todas as diferenças se anulam e desaparece a distinção entre líquido e vapor.
Em quase todos os materiais conhecidos, as pressões críticas são muito maiores que a pressão atmosférica, de modo que não podemos observar esse comportamento em nossa vida cotidiana.
Por exemplo, a pressão crítica da água ocorre a uma temperatura de 647,4 K e a uma pressão de 218 atm .
Já foram identificados mais de 12 tipos de gelo com propriedades físicas e estruturas cristalinas diferentes quando o gelo é submetido a pressões muito elevadas.
Vaporização: Líquido - Gás
A evaporação é a transição de fase líquido – vapor (vaporização) em uma temperatura menor do que a de ebulição (“fervura”).
Fonte: https://youtu.be/DJuhVrbDIOsFonte: https://youtu.be/A3mna0Vkyw4Evaporação
Lento, bem comportado e natural.
As partículas da superfície deixam o líquido para o ambiente (atmosfera)
Lento, violento (bolhas) e por aquecimento direto.
Envolve todo o líquido.
Ebulição
Próximo à superfície da água não há somente vapor d'água, mas outros gases, como o ar atmosférico.
A pressão exercida sobre a superfície d'água é exercida pelas moléculas d'água que evaporam, mas também pelas moléculas do ar atmosférico.
A pressão parcial de vapor d'água no ar é menor do que a pressão de vapor de equilíbrio à temperatura ambiente.
Então, não há equilíbrio e a água evapora.
Pressão de vapor
Enquanto não houver equilíbrio a água sai da fase líquida para a fase gasosa mesmo à temperatura ambiente (difusão).
\(\Rightarrow \) Evaporação.
\(\Rightarrow \) Coexistência.
\(\Rightarrow \) Condensação.
A umidade relativa é a seguinte razão:

Quando o suor evapora, o organismo precisa fornecer energia, pois é necessário 540 cal/g para evapora.
Em lugares onde a U.R. = 1 (100%) há um desconforto térmico porque vai continuar suando. O suor não vai evaporar.
Dizemos que o ar está saturado de vapor d'água quando a U.R. = 1. O ar não absorve mais moléculas d'água.
Ponto de orvalho.
A que temperatura a pressão parcial de vapor d'água ficaria igual à pressão de equilíbrio?
Ponto de orvalho é temperatura na qual a umidade relativa é de 100% para uma da pressão parcial de vapor d'água.

A temperatura será mais baixa que a temperatura ambiente.
Para a U.R. = 1, é necessário baixar a temperatura.
Esta temperatura na qual \(P_v = P_e\) é o ponto de orvalho.
Ponto de orvalho.
A pressão de vapor aumenta à medida que a temperatura aumenta.
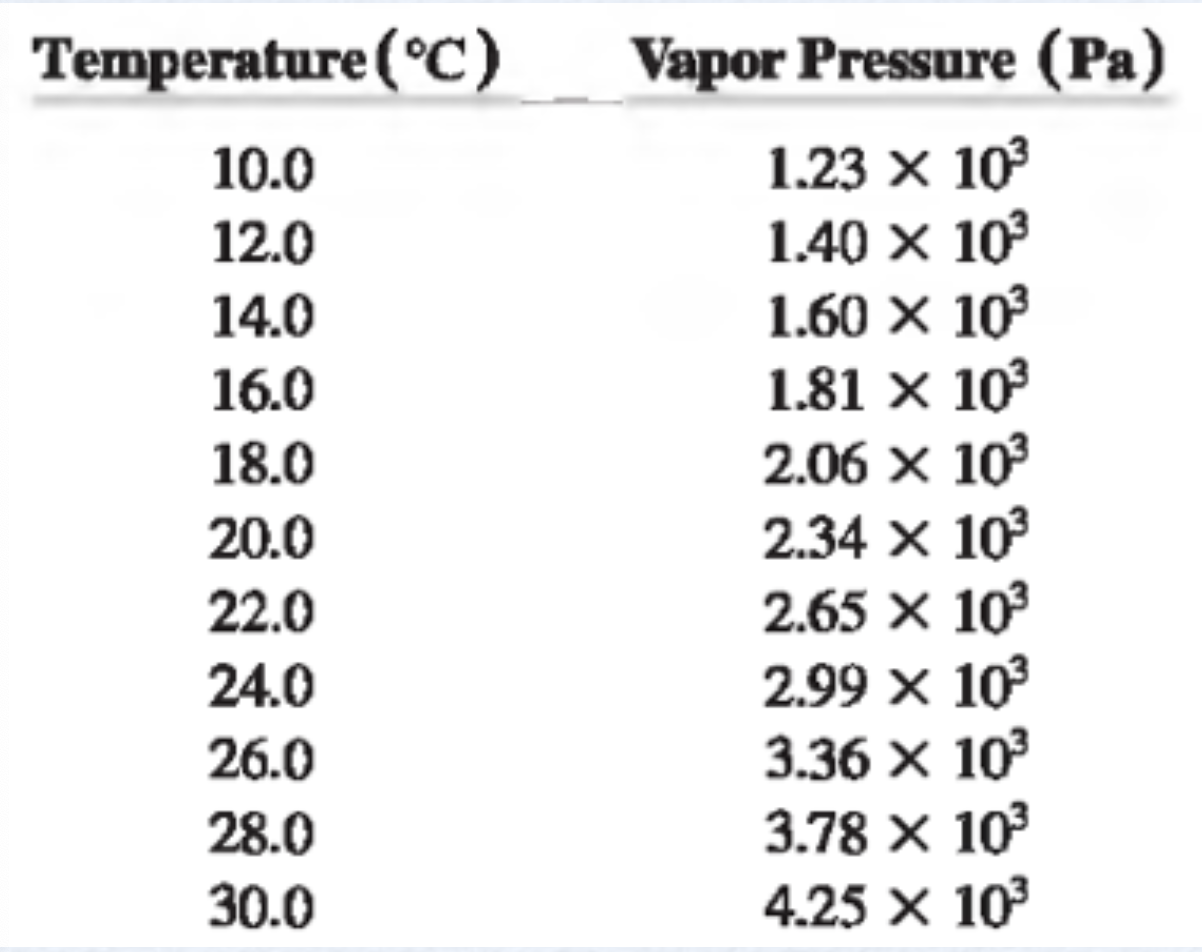
Temperatura (\(^o\)C)
Pressão de vapar (Pa)
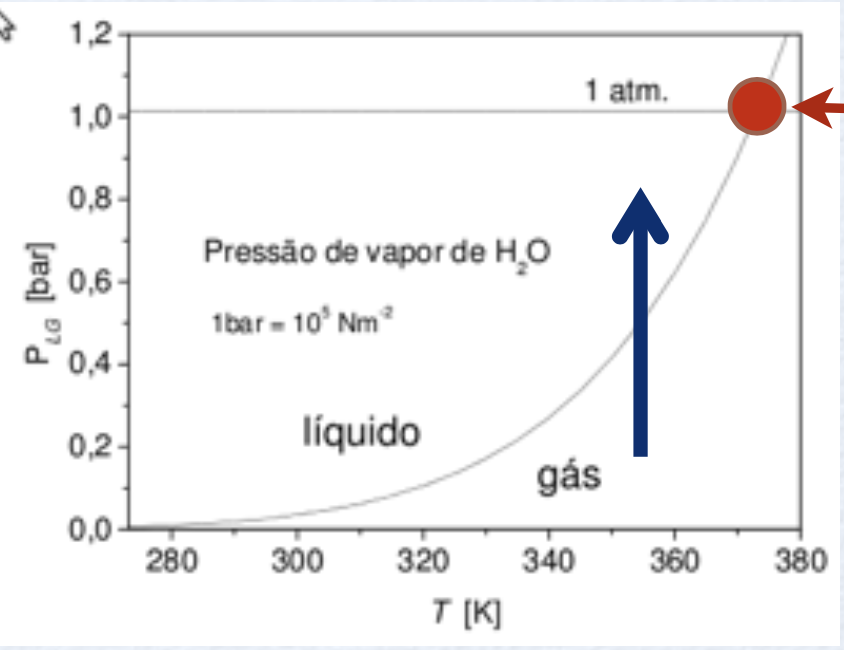
Por que uma panela aberta com água a 100°C ferver completamente?
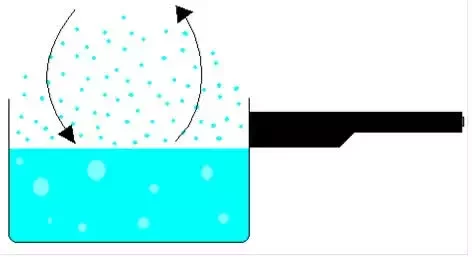
A água ferve porque existe água + ar. Assim, há menos moléculas de água para condensar e a água ferve.
Assim, o ponto de ebulição de um líquido a uma determinada pressão é a temperatura na qual sua pressão de vapor se iguala à pressão ambiente.
saturação (U.R = 1)
Se em dia de verão a temperatura vale 30 \(^o\)C a a U.R. = 0,90 (90%). Qual é o ponto de orvalho?

Fonte: https://openstax.orgPonto de orvalho.

Temperatura (\(^o\)C)
Pressão de vapor (Pa)
À 30 \(^o\)C a pressão de vapor de equilíbrio é \(4,35 \times 10^3\) Pa.
Questão 1
A figura mostra o ciclo seguido por 1,0 mol de um gás monoatômico ideal com um volume inicial V1 = 25,0 L
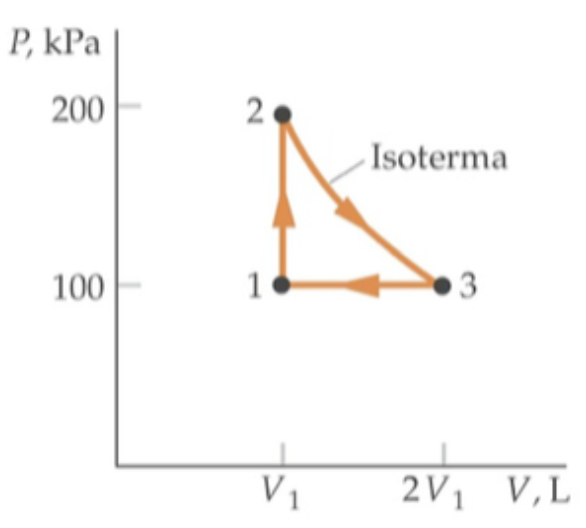
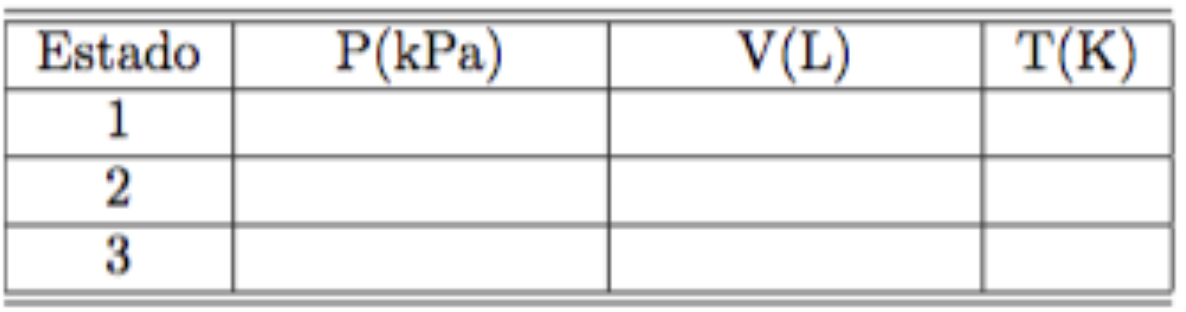
(a) Complete a tabela desta questão com as propriedades termodinâmicas (P,V,T) dos estados 1, 2 e 3.
(b) Calcule o trabalho, o calor e a variação da energia interna em cada etapa do ciclo.
(c) Calcule a eficiência do ciclo
Questão 3
T20-5) Um tanque de 20,0 L contém 300 moles de Helio a uma pressão de 400 atm. (a) Qual é o valor de a^2/V^2, e a que fração da pressão ela corresponde? (b) Qual é o valor de bn, e a que fração do volume do recipiente ele corresponde? (c) Qual é o temperatura do Helio?
Questão 4
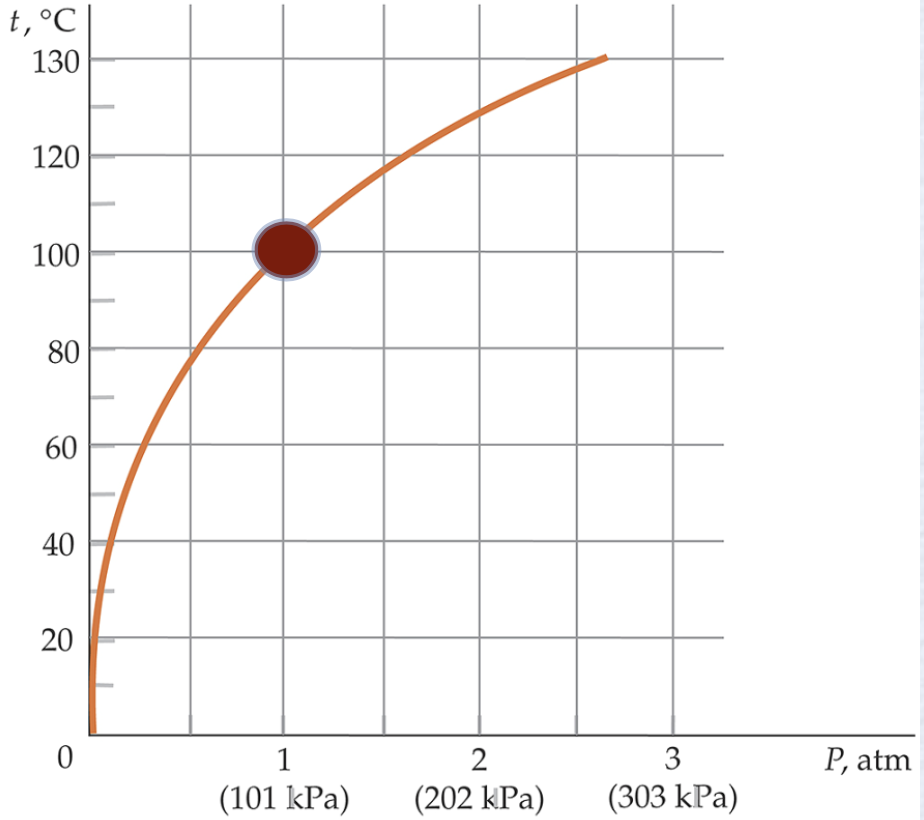
C.20 – T33 – Usando a figura, determine as seguintes quantidades: (a) A temperatura de ebulição da água em uma montanha onde a pressão atmosférica é 70,0 kPa; (b) a temperatura de ebulição da água em um recipiente onde a pressão interna é 0,500 atm e (c) a pressão na qual a água ferve a 115 oC. O ponto de ebulição diminui com a pressão. Como?

Vídeo: https://youtu.be/TTMFBZsYIdg
Questão 5
A temperatura de uma sala é 30oC. Um metereologista resfria uma lata metálica enchendo-a gradualmente com água fria. Quando a temperatura da lata atinge o valor de 16oC, pequenas gotas de água se formam na superfície externa da lata. Qual é a umidade relativa do ar dessa sala com temperatura de 30oC? Use a tabela do próximo slide.