4ESO
"A Química do Carbono"
Relator: Enric Ripoll Mira. 2020

El átomo de carbono
1. Primeiras ideas
Pensábase que todas as substancias orgánicas proviñan de seres vivos.

Foi professor da Universidade de Goettingen. Conseguiu obter pela primeira vez (1828) urea por síntese a partir do isocianato de amonio, contrariando as ideas entón en vigor de que era necesaria unha "forza vital" para a síntese dos compostos organicos.

Os enlaces do carbono
O carbono ten unha capacidade inmensa para formar longas cadeas.

Las fórmulas
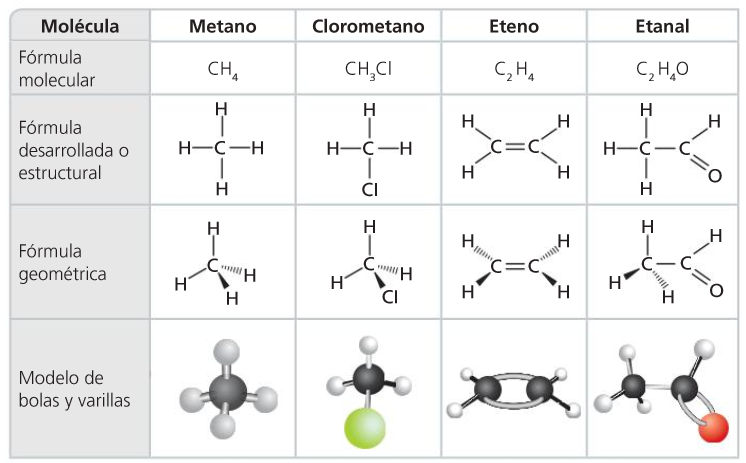
Las fórmulas
Clasificación das substancias con carbono
- Variedades alotrópicas do carbono
- Compostos inorgánicos
- Compostos orgánicos
- Polímeros
- Naturales
- Sintéticos


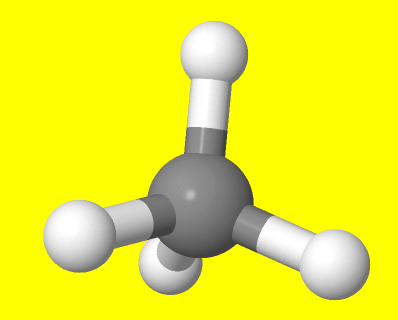
O átomo de carbono
- Configuración electrónica
- Cadeas carbonadas
- Carbonos primarios, secundarios...
- Representación de moléculas orgánicas
- F. condensadas
- F. expandidas
- Modelos moleculares


O átomo de carbono

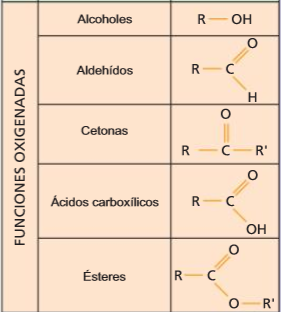
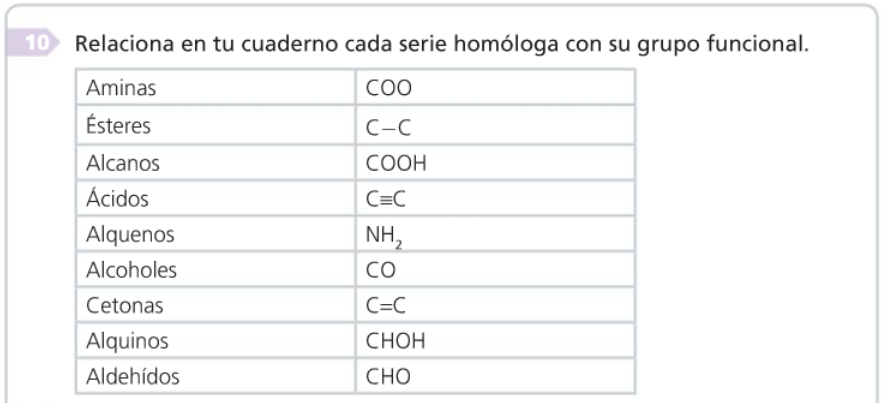
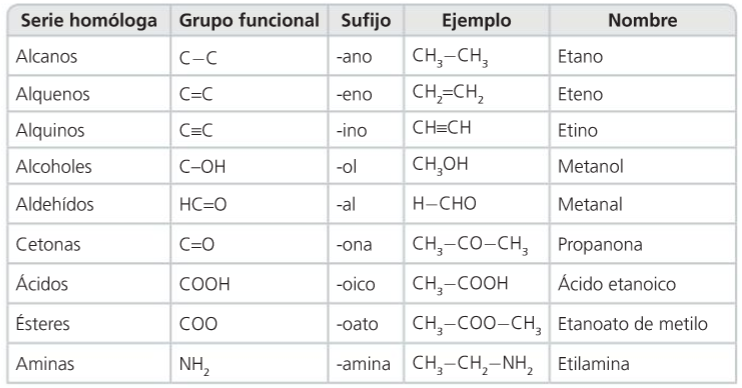
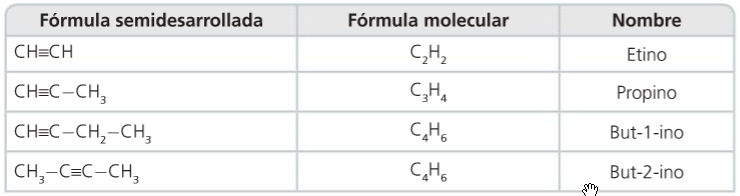
3. Grupos funcionais e series homólogas
- Grupo funcional
- Serie homóloga
- Propiedades dos compostos dunha serie
- Compostos orgánicos
- Compostos polifuncionais
Grupos funcionais e series homólogas

Grupos funcionales y series homólogas

Grupos funcionales y series homólogas

Hidrocarburos cíclicos
Saturados
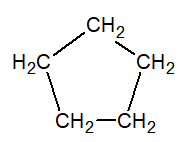
Insaturados
ciclopropano
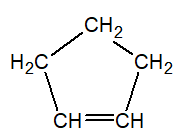
ciclopropeno
Aromáticos
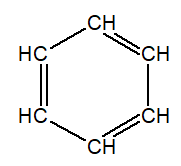
benceno
Grupos funcionales y series homólogas
Grupos funcionales y series homólogas

Grupos funcionales y series homólogas

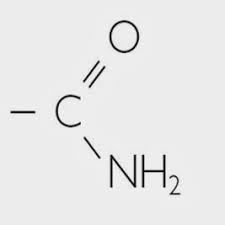
| Amidas |
|
|
|---|---|---|
| Nitrilos | -C≡N | |
Grupos funcionais e series homólogas


Actividades

Actividades
Prioridad en las funciones orgánicas
|
Función |
Nom. grupo |
Grupo |
Nom.(princ.) |
Nom.(secund) |
|
Ácido carboxílico |
carboxilo |
R–COOH |
ácido …oico |
carboxi (incluye C) |
|
Éster |
éster |
R–COOR’ |
…ato de …ilo |
…oxicarbonil |
|
Amida |
amido |
R–CONR’R |
…amida |
amido (incluye C) |
|
Nitrilo |
nitrilo |
R–C ≡N |
…nitrilo |
ciano (incluye C) |
|
Aldehído |
carbonilo |
R–CH=O |
…al |
oxo |
Prioridad en las funciones orgánicas
|
Cetona |
carbonilo |
R–CO–R’ |
…ona |
oxo |
|
Alcohol |
hidroxilo |
R–OH |
…ol |
hidroxi |
|
Fenol |
fenol |
–C6H5OH |
…fenol |
hidroxifenil |
|
Amina (primaria)
|
Amino |
R–NH2 |
…amina |
amino |
|
Éter |
Oxi |
R–O–R’ |
…il…iléter |
oxi…il |
|
Doble enlace |
alqueno |
C=C |
…eno |
…en |
Prioridad en las funciones orgánicas
|
Triple enlace |
alquino |
C ≡C |
…ino |
Ino (sufijo) |
|
Nitrocompuesto |
Nitro |
R–NO2 |
nitro… |
nitro |
|
Haluro |
halógeno |
R–X |
X… |
X |
|
Radical |
alquilo |
R– |
…il |
…il |
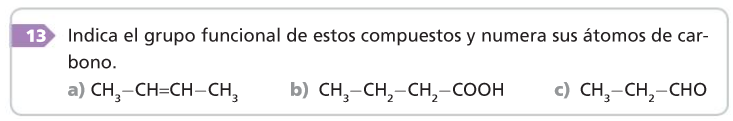
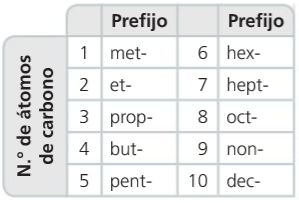
4. Reglas generales de formulación y nomenclatura
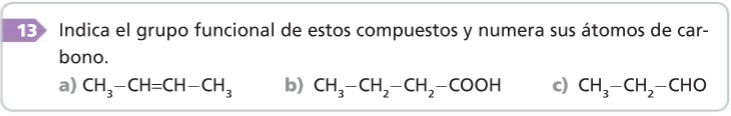
1. Se localiza la cadena carbonada más larga: esta será la cadena principal.
2. Se numeran los átomos de carbono, empezando por el extremo más próximo a la función principal.
3. Se nombran los sustituyentes anteponiéndoles un número localizador.
4. Los dobles y triples enlaces y los otros grupos funcionales se localizan de igual forma que los sustituyentes, pero los números localizadores se sitúan inmediatamente antes de la terminación del nombre.
5. El nombre de los compuestos del carbono consta de dos partes: un prefijo, que indica el número de átomos de carbono que hay en la cadena, y un sufijo, que señala el grupo funcional.
4. Reglas generales de formulación y nomenclatura
4. Reglas generales de formulación y nomenclatura

4. Alcoholes


Propiedades
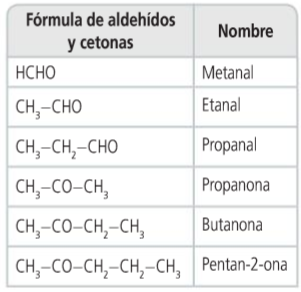
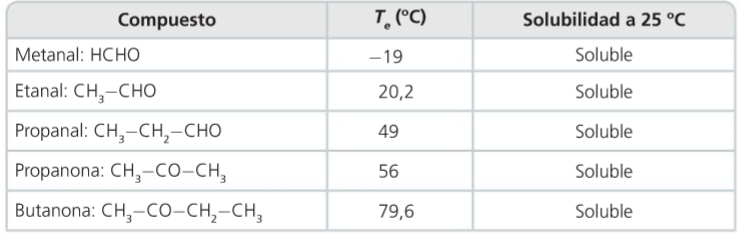
4. Aldehídos y cetonas
Propiedades
4. Aldehídos y cetonas

4. Ácidos carboxílicos y ésteres

4. Aminas
Propiedades generales de los compuestos orgánicos

5. Hidrocarburos
- Os hidrocarburos son compostos orgánicos formados por carbono e hidróxeno.
- Os enlaces covalentes entre dous átomos de carbono poden ser sinxelos, duplos ou triplos, segundo compartan un, dous ou tres pares de electróns, se todos os enlaces C-C son sinxelos, os hidrocarburos denomínanse alcanos ou hidrocarburos saturados. Se as moléculas conteñen un ou máis dun enlace duplo ou triplo entre dous átomos de carbono, os hidrocarburos denomínanse insaturados.
Hidrocarburos saturados (alcanos)
- Propiedades físicas
- Os hidrocarburos son substancias pouco polares ou non polares (as forzas entre as súas moléculas son de Van der Waals). A falta de polaridade é xeral nos hidrocarburos, e iso fai que sexan practicamente Insolubles en auga, xa que esta é un disolvente moi polar. Pola contra, son solubles noutros disolventes orgánicos como o benceno, o éter, o cloroformo, a acetona, etc.
- Propiedades químicas
- Os hidrocarburos saturados son quimicamente moi estables. A escasa capacidade de reacción débese á pouca polaridade das moléculas e a que os enlaces C-C e C-H son moi fortes.
- No entanto, sí que reaccionan fronte a axentes oxidantes (reaccións con o oxíxeno, cloro...)
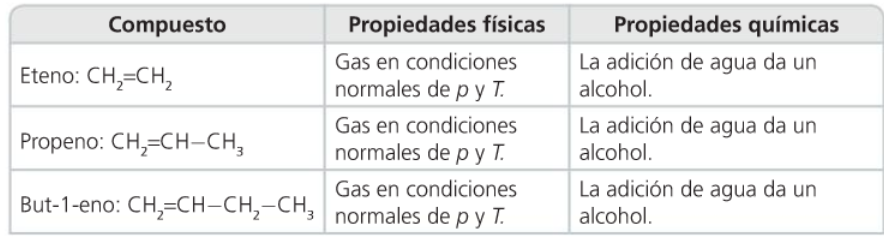
Hidrocarburos etilénicos (alquenos)
- Obtención
- Actualmente obtéñense por cracking (rotura) das fraccións lixeiras do petróleo. )
- Propiedades físicas
- Os puntos de fusión e ebulición aumentan a medida que crece a lonxitude da cadea tal como ocorre cos hidrocarburos saturados. Son insolubles en auga e menos densos ca esta.
- Propiedades químicas
- A presencia dun enlace ou máis confire unha gran reactividade química.
-
Alcoholes
- Propiedades
- Puntos de fusión y ebullición superiores a sus correspondientes hidrocarburos saturados.
- Solubles en agua ya que pueden formar con ella puentes de hidrógeno.

-
Aldehídos y cetonas
- Propiedades
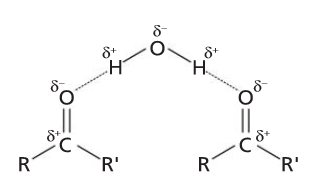
- Son compuestos polares, por tanto tendrán puntos de fusión y de ebullición más elevados que sus correspondientes hidrocarburos.
- Solubles en agua ya que pueden formar con ella puentes de hidrógeno.

Ácidos carboxílicos
- Propiedades
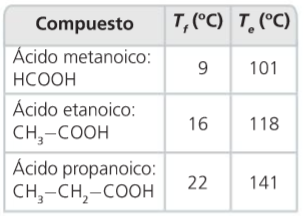
- Los ácidos con menor número de átomos de carbono son líquidos, mientras que los de más de ocho átomos de carbono son sólidos.
- Los puntos de fusión y ebullición aumentan a medida que lo hace el número de átomos de carbono.
- Los de menor peso molecular solubles en agua ya que pueden formar con ella puentes de hidrógeno. A medida que aumenta su peso molecular la parte apolar de la molécula gana importancia y pueden llegar a usarse como detergentes.

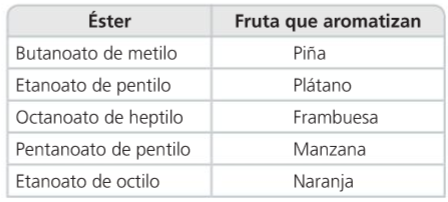
Ésteres
- Propiedades
-
Los ésteres de baja masa molar son líquidos volátiles de olor agradable. Los de masa molar elevada son sólidos cristalinos inodoros.
-
Los ésteres proporcionan su aroma característico a las frutas y flores y se utilizan en la fabricación de dulces, bebidas y perfumes.
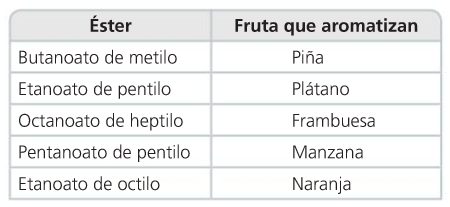
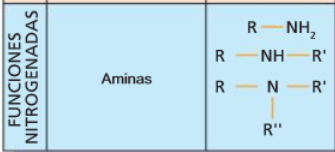
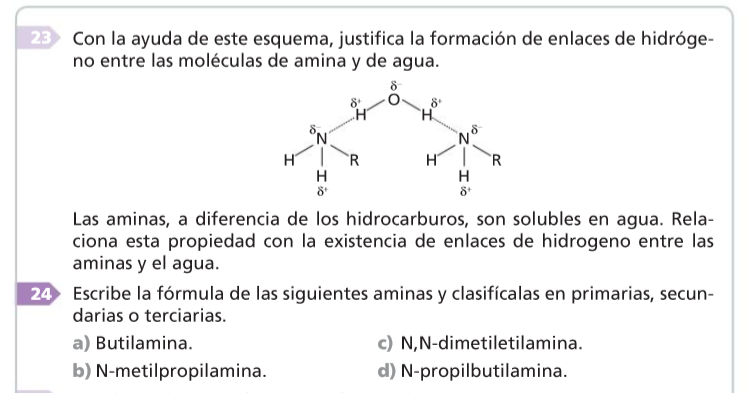
Aminas
- Propiedades
-
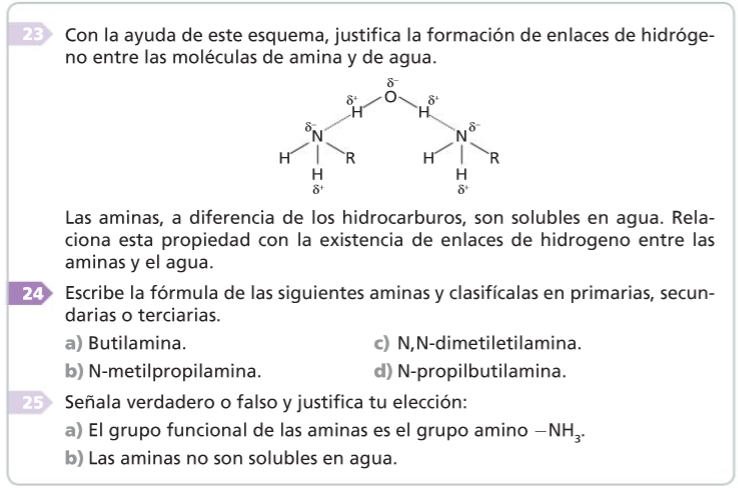
Como el enlace N—H está polarizado, las aminas primarias y secundarias forman enlaces de hidrógeno, aunque no tan fuertes como los que forman los alcoholes. La consecuencia de ello es que sus puntos de ebullición son intermedios entre los de los alcoholes y los de los hidrocarburos de análoga masa molar.
-
Las aminas son solubles en agua debido a la formación de enlaces de hidrógeno entre el agua y el nitrógeno.
Actividades
6. El petróleo

6. El petróleo como materia prima






7. El gas natural
Que é? O cheiro
Orixe e obtención
Coma combustible
O metano; hidratos de metano


Formas alotrópicas do carbono