Orixe e evolución dos compoñentes do Universo II
Relator: Enric Ripoll Mira. 2020

1. Modelo atómico da mecánica cuántica: orbitais atómicos
Neste modelo atómico, utilízanse os mesmos números cuánticos que no modelo de Bohr e cos mesmos valores permitidos, pero cambia o seu significado físico, posto que agora hai que utilizar o concepto de orbital:
http://inicia.es/de/atomos/modelos3.html
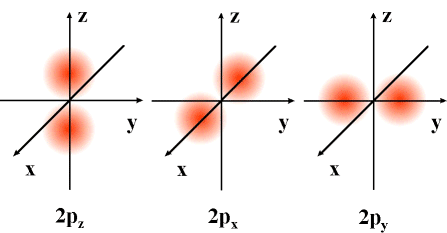

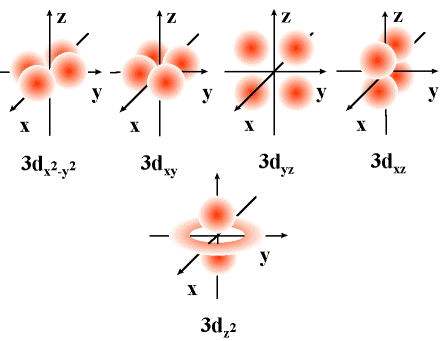

1. Modelo atómico da mecánica cuántica: orbitais atómicos
Así, cada conxunto de catro números cuánticos caracteriza a un electrón:
n determina o nivel enerxético
l determina o subnivel enerxético
m determina o orbital concreto dentro dese subnivel
s determina o electrón concreto dentro dos que poden aloxarse en cada orbital (pode haber dous electróns en cada orbital).
Isto reflíctese no Principio de exclusión de Pauli (1925):
"Nun átomo non pode haber dous electróns que teñan os catro números cuánticos iguais, polo menos teranse que diferenciar nun deles".

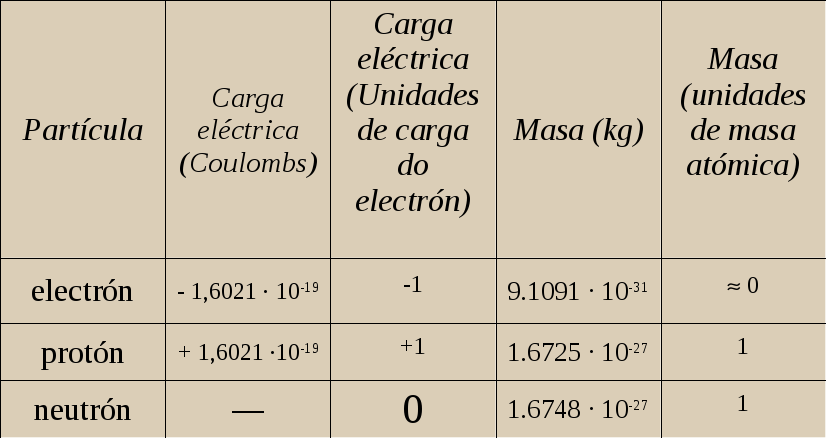
Número atómico e número másico
No ano 1913, Moseley confirma a existencia de protóns no átomo. Ao número de protóns dun átomo, Moseley chámalle número atómico, que se simboliza coa letra Z e indícase na parte inferior do símbolo do elemento:
No ano 1932, Chadwik descobre o neutrón, cunha masa semellante á do protón. Como o electrón ten unha masa moi pequena comparada co protón ou o neutrón, á suma destas dúas partículas sele chamou número másico que se simboliza cunha A e indícase na parte superior do símbolo do elemento:


Modelo atómico. Magnitudes das partículas
Modelo atómico da mecánica cuántica: orbitais atómicos
Aínda que nun átomo pode haber infinitos orbitais (o valor de n non está limitado), non existen todos eles, os electróns só “ocupan” os orbitais (dous electróns por orbital, como máximo) con menor enerxía, enerxía que pode coñecerse, aproximadamente, pola regra del Auf-Bau, regra nemotécnica que permite determinar a orde de enchido dos orbitais da maioría dos átomos. Segundo esta regra, seguindo as diagonais da táboa da dereita, de arriba abaixo, obtense a orde de enerxía dos orbitais e a súa orde, consecuentemente, a súa orde de enchido.
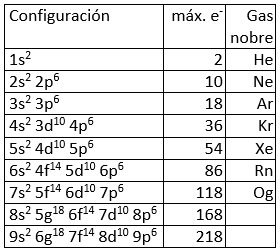
Modelo atómico da mecánica cuántica: orbitais atómicos

Os diagrama de casillas
Unha maneira habitual de facer as configuracións electrónicas para visualizar gráficamente os catro números cuánticos, é facer o diagrama de casillas ou notación orbital
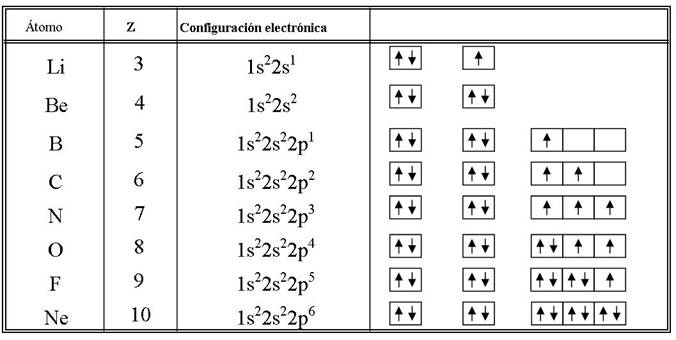

Usa el diagrama de casillas (u orbital)

Modelo atómico da mecánica cuántica: orbitais atómicos
- Principio do Aufbau, mínima enerxía
- Principio de exclusión de Pauli
- Principio de máxima multiplicidade de Hund
- Diamagnetismo e paramagnetismo
- Estabilidade adicional dun subnivel semicheo




Actividades
1. Xustifica cal ou cales das seguintes combinacións de valores de números cuánticos, listados na orde n, l, ml , están permitidas para un orbital:
(2, 2, 0); (2, 1, 1); (3, 1, 3).
2. Cal ou cales das seguintes combinacións de números cuánticos poden describir un electrón?
(0, 0, 0, _1/2); (1, 1, 0, -1/2); (2, 1, 1, -1/2); (4, 5, 0, -1/2)
3. Que orbital é máis estable, un 2s ou un 2p? Considera dous casos, para o átomo de hidróxeno, e para calquera átomo polielectrónico.
Xustifica as túas respostas.

A táboa periódica
Lei das tríadas
En 1817 Johann Dobereiner observou que o peso atómico do estroncio era aproximadamente a media entre os pesos do calcio e do bario, elementos que posúen propiedades químicas similares.
En 1829, propuxo que na natureza existían tríadas de elementos de forma que o central tiña propiedades que eran unha media dos outros dous membros da tríada.
Lei das Oitavas
En 1864, John Newlands publicou a súa versión da táboa periódica clasificando os 56 elementos e establecendo 11 grupos baseados en propiedades físicas similares. Viu que entre os elementos con propiedades similares existían diferenzas na masa atómica relacionadas con múltiplos de oito. En definitiva a súa lei establecía que un elemento dado presentaría unhas propiedades análogas ao oitavo elemento seguindo a táboa.
A táboa periódica de Дми́трий Ива́нович Менделе́ев
Táboa de Mendeleiev
Esta táboa consiste, en síntese, en colocar os elementos químicos nun cadro en orde crecente das súas masas atómicas notándose unha analoxía nas súas propiedades cada certo número de elementos (por iso denomínase táboa periódica).


A táboa periódica de Дми́трий Ива́нович Менделе́ев


A táboa periódica actual
Aínda que está baseada na proposta por D. Mendeleiev en 1869, o criterio de ordenación (debido entre outros aos estudos de Henry Moseley) é outro. Nela, os elementos atópanse ordenados, de esquerda a dereita, por valores crecentes dos seus números atómicos (Z). Ademais disto, os elementos aparecen distribuídos en filas e columnas.
Existen 7 filas horizontais que se denominan períodos e 18 columnas verticais que se denominan grupos.
Os elementos tamén se clasifican en: metais, non metais e semimetais de acordo coas súas propiedades para gañar ou perder electróns.

A táboa periódica e configuración electrónica
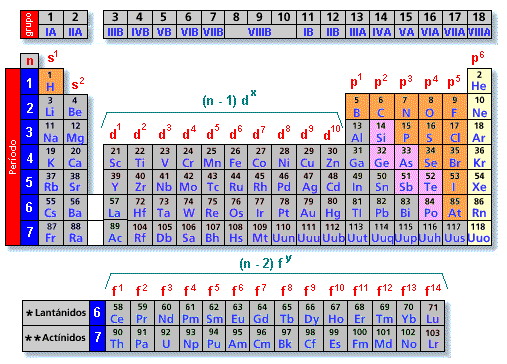
A táboa periódica clasificación
Elementos químicos
Un xeito de clasificar aos elementos químicos é:
Metais
Non metais
Metaloides
A Táboa Periódica tamén pode dividirse en zona A (elementos representativos) e zona B (elementos de transición).
Os grupos ou familias de elementos poden ser nomeados; tal como: alcalinos, alcalino-térreos, gases raros, halóxenos
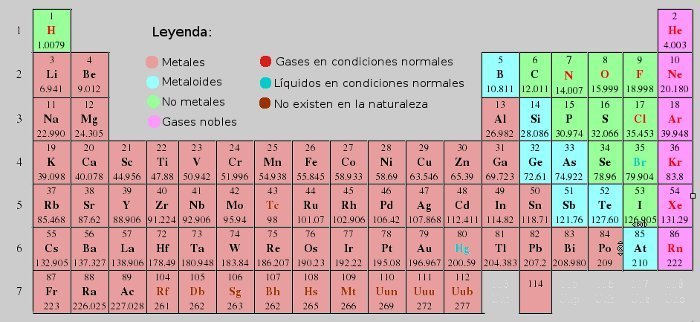
A táboa periódica: os metais
Son sólidos a temperatura ambiente (o mercurio é a excepción)
Bos condutores da calor e a electricidade.
Maleables e dúctiles.
Puntos de ebulición e densidade altos.
Común: prata, platino, cromo, cobre. Non común: calcio, sodio, cobalto.

A táboa periódica: non metais
Punto de fusión e densidade variados
Non teñen lustre.
Xeralmente malos condutores de calor e da electricidade.
Combínanse entre si para formar compostos como dióxido de carbono, hidrocarburos, etc. Exemplos: carbono, fósforo, xofre, iodo.

A táboa periódica: metaloides ou semiconductores
Exemplos: boro, silicio, xermanio, antimonio.
Propiedades intermedias. Entre os metais e os non metais





Propiedades periódicas

Propiedades periódicas
Propiedades periódicas
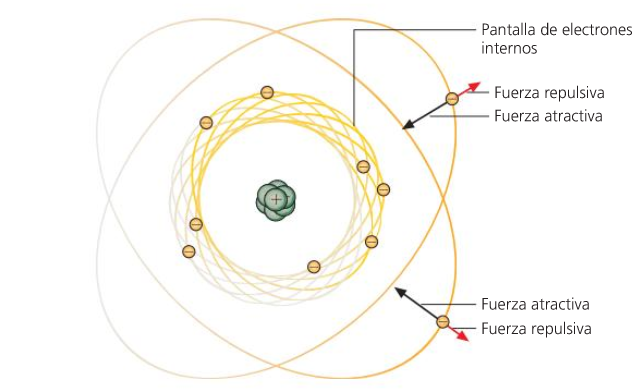
Volume, raio atómico.
RADIO ATÓMICO
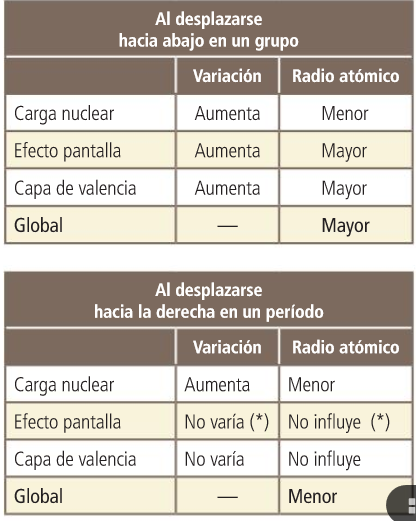
Propiedades periódicas
RADIO ATÓMICO
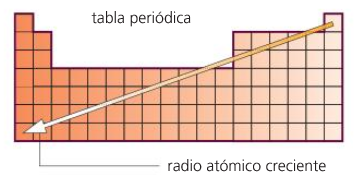
Propiedades periódicas
Volume, raio atómico.
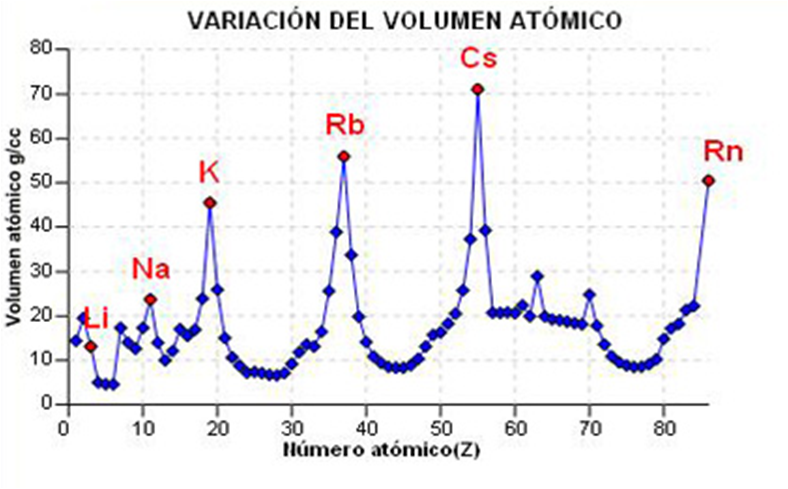
El radio iónico
Raio iónico
Raio dun ión positivo
Raio dun ión negativo
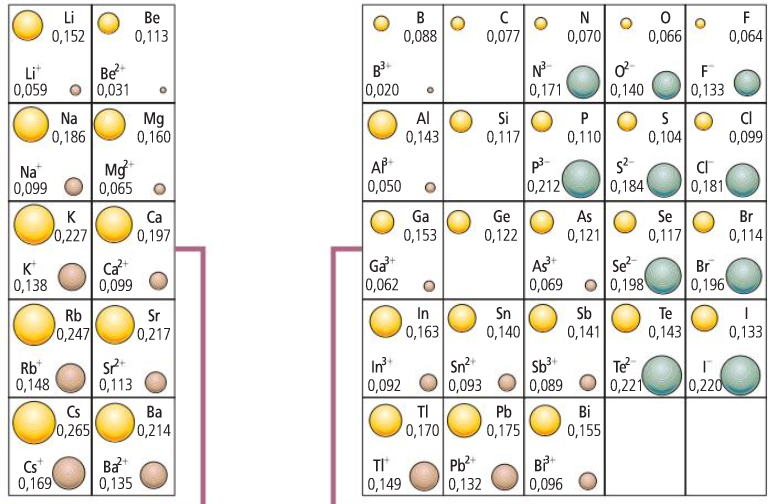
El radio

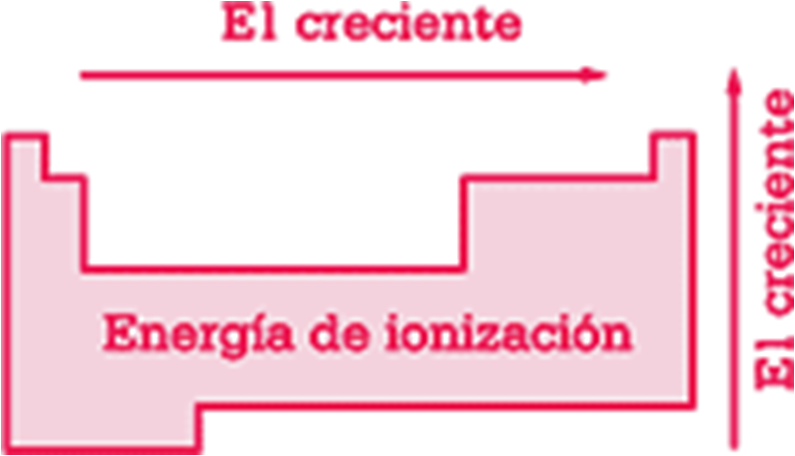
Propiedades periódicas: Potencial de ionización.
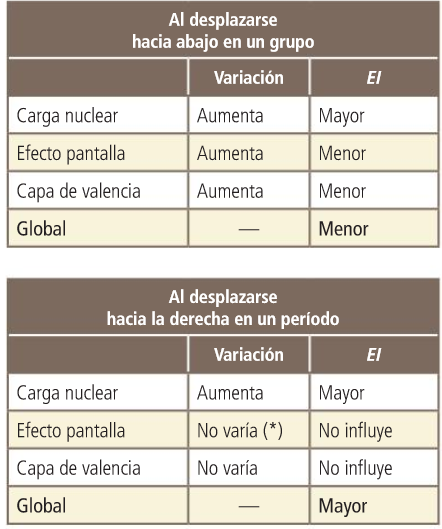
Propiedades periódicas: Potencial de ionización.


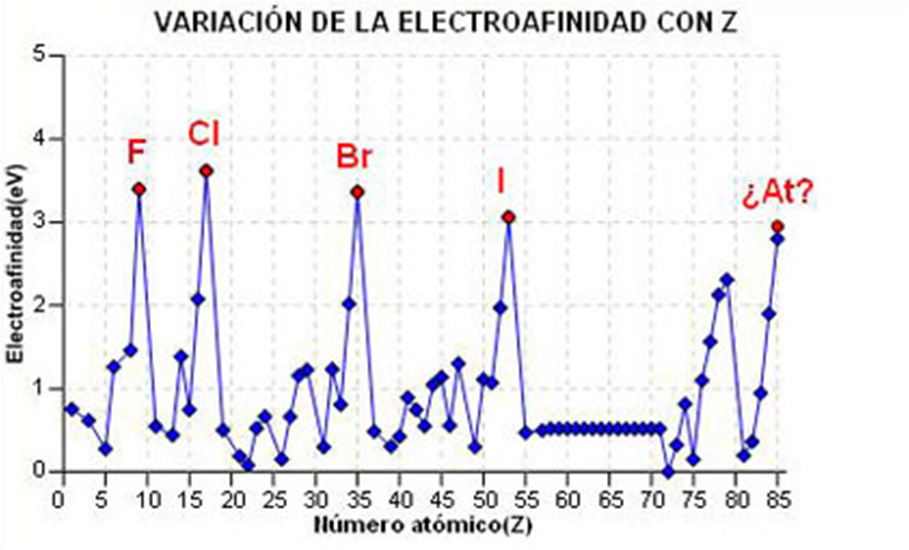
Propiedades periódicas: Afinidade electrónica
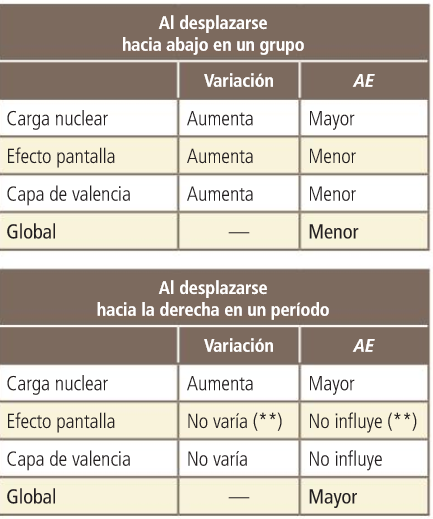
Propiedades periódicas: Afinidade electrónica
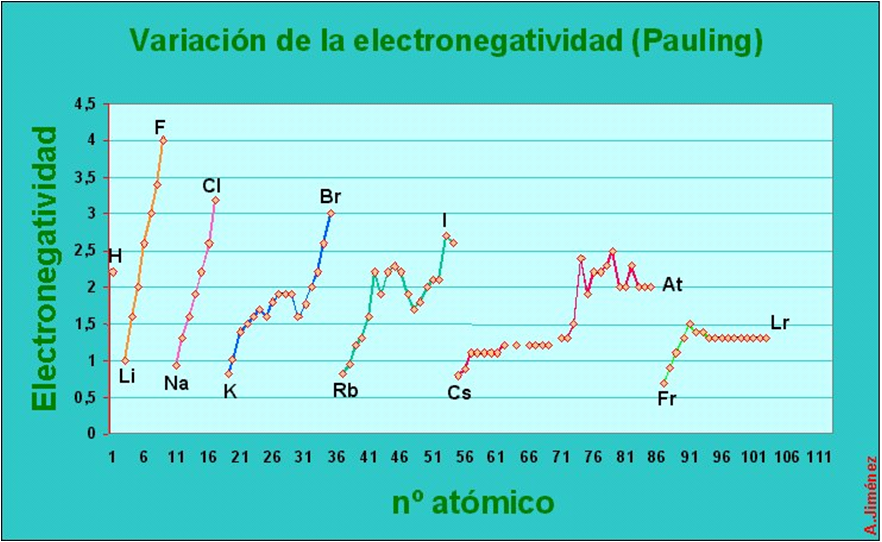
Propiedades periódicas: electronegatividade
É unha medida da forza de atracción coa que os átomos dunha molécula atraen os electróns.
Nun grupo ou familia, a electronegatividade diminúe de arriba facía abaixo, é dicir, é menor cando aumenta o número atómico. Nos períodos, a electronegatividade de esquerda a dereita.
Mentres máis próximo estean os electróns do núcleo, necesítase maior enerxía para desprendelos. É máis difícil quitarlle un electrón ao litio que ao sodio.
Os electróns situados no último nivel chámanse electróns de valencia, e contribúen para caracterizar a afinidade electrónica do elemento.
Propiedades periódicas: electronegatividade

Propiedades periódicas: electronegatividade