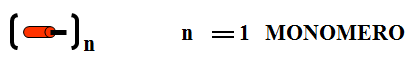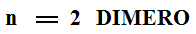Reactividade dos compostos orgánicos
Relator: Enric Ripoll Mira. 2019
Alcanos
As moléculas mantense unidas a causa das forzas de dispersión (o de London)
Son compostos apolares e, polo tanto, insolubles en auga.
Unicamente posúen enlaces sinxelos, σ
Os seus puntos de fusión e ebulición aumentan conforme aumenta o seu peso molecular
- Os primeiros membros da serie son gases a temperatura e presión habituais: metano, etano, propano, butano.
- A partir do pentano temos membros en estado líquido: pentano, hexano, heptano, octano, nonano...
- A partir de 20 átomos de carbono adoitan ser sólidos
Alcanos. Reaccións
- Oxidación
- Haloxenación. Mecanismos da reacción:
- Iniciación: hf + Cl2 → 2 Cl·
- Propagación:
- R-CH3 + Cl· → R-CH2Cl + H· (moi pouco probable)
- R-CH3 + Cl· → R-CH2· + HCl
- R-CH2· + Cl2 → R-CH2Cl + Cl·
- Finalización:
- H· + Cl· → HCl (pouco probable)
- H· + H· → H2 (moi pouco probable)
- Cl· + RCH2· → R-CH2Cl
- 2 R-CH2· → R-CH2-CH2-R
- Cl· + Cl· → Cl2
Cicloalcanos. Reaccións
- Oxidación
- Haloxenación. Mecanismos da reacción:
- Iniciación: hf + Cl2 → 2 Cl·
- Propagación:
- R-H + Cl· → R-Cl + H· (moi pouco probable)
- R-H + Cl· → R· + HCl
- R· + Cl2 → RCl + Cl·
- Finalización
- H· + Cl· → HCl (pouco probable)
- H· + H· → H2 (moi pouco probable)
- R· + Cl· → RCl
- R· + R· → R-R
- Cl· + Cl· → Cl2
- Os membros máis pequenos (ciclo propano e ciclobutano), abren o seu anel
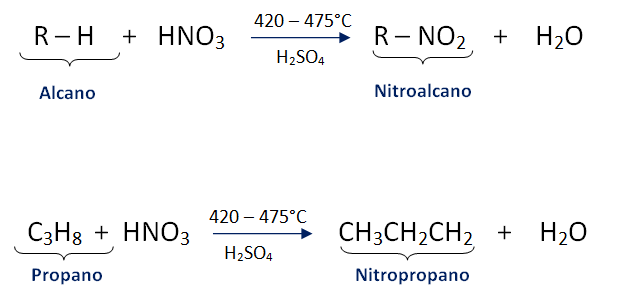
Alcanos. Reaccións
- Nitración
- Ciclación
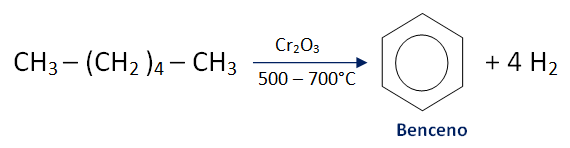
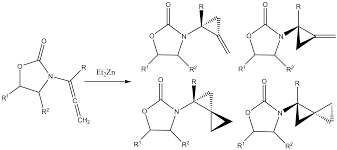
Alquenos ou olefinas
As moléculas mantense unidas a causa das forzas de dispersión (o de London)
Son compostos apolares e, polo tanto, insolubles en auga.
Posúen enlaces sinxelos, σ e dobres, π
Os seus puntos de fusión e ebulición aumentan conforme aumenta o seu peso molecular
- Os primeiros membros da serie son gases a temperatura e presión habituais: eteno, propeno, buteno.
Alquenos, reactividade
- Reaccións de adición
CH3-CH=CH2 + H2 → CH3-CH2-CH3
CH3-CH=CH2 + Cl2 → CH3-CHCl-CH2Cl
CH3-CH=CH2 + HCl → CH3-CHCl-CH3
CH3-CH=CH2 + H2O → CH3-CHOH-CH3
Regla de Markovnikov
- Reaccións de oxidación e redución:
- O2 Combustión
- O3 Formación do ozónido e descomposición final en aldehídos
Alquinos
As moléculas mantense unidas a causa das forzas de dispersión (o de London)
Son compostos apolares e, polo tanto, insolubles en auga.
Posúen enlaces sinxelos, σ e triplos, π
Os seus puntos de fusión e ebulición aumentan conforme aumenta o seu peso molecular
- Os primeiros membros da serie son gases a temperatura e presión habituais: etino (acetileno), propino, butino.
Alquinos, reactividade
- Adición ao triplo enlace:
- H2
- HCl
- H2O
- Polimerización e ciclación etino ---> Benceno
Hidrocarburos aromáticos
- Adición ao dobre enlace:
- H2
- Substitución
- Haloxenación
- Nitración
- Sulfonación
- Síntese de Friedels-Crafts
- Benceno + cloruro de etilo (AlCl3)---> etilbenceno + HCl
Tipos máis importantes de reaccións
- Adición ao dobre enlace:
- Electrófila
- Substitución
- Radicálica
- Electrofílica
- Nucleofílica
- SN1
- SN2
- Eliminación
- Transposición
- Condensación
- Oxido-redución
Mecanismos
Mecanismos
Substitución nucleofílica SN2
Desprazamentos electrónicos
1. Efecto indutivo, I
Cando se unen dous átomos de diferente electronegatividade mediante un enlace sigma, a parella de electróns estará máis desprazada cara o máis electronegativo
2. Efecto mesómero
Dáse nos enlaces múltiples e consiste no desprazamentodo dobre enlace sobre o átomo máis electronegativo.
Efecto indutivo
Efecto indutivo.
O hidróxeno tómase como referencia
(no provoca efecto indutivo)
- —l : Grupos que retiran electróns.
- Exemplos: -NO2, - COOH, -X (halóxeno), -OH, -CN, -OCH3
- Exemplos: -NO2, - COOH, -X (halóxeno), -OH, -CN, -OCH3
- +I: Grupos que aportan electróns.
- Exemplos: -CH3, -CH2-CH3, -C(CH3), -COO-, -O-
- Exemplos: -CH3, -CH2-CH3, -C(CH3), -COO-, -O-
Transmítese ao longo da cadea a enlaces adxacentes, aínda que cada vez máis debilmente.
Reaccións dos derivados de alquilo
- Substitución nucleofílica
- CH3-CH2-Cl + NaOH (H2O) → CH3-CH2OH
- Eliminación
- CH3-CH2-Cl (OH, etanol) → CH2=CH2 + HCl
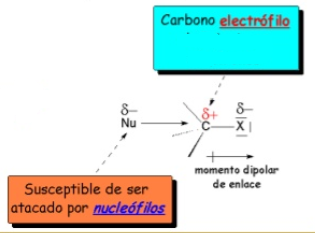
Reaccións de alcohois e fenois
- Propiedades:
- Poden formar pontes de hidróxeno coa auga e consigo mesmo. Os de baixo peso molecular, son líquidos
- Conforme aumenta o peso molecular, diminúe a solubilidade en auga e aparecen os sólidos (ceras)
- Os fenois son máis solubles en auga e presentan comportamento ácido
Reaccións de alcohois
- Substitución:
- R-CH2-OH + HBr → R-CH2-Br
- Eliminación:
- R-CH 2-OH → R'-CH=CH2 + H2O
-
R-CH2-CHOH-CH3 → R-CH=CH-CH3 + H2O; En alcohois secundarios: regra de Sayteff (retiramos o H ao C que menos ten)
- Formación de éteres (H2SO4)
- R-CH 2-OH → R'-CH=CH2 + H2O
- Oxidación e redución
- Formación de ésteres
Reaccións de fenois
- Ácido-base
- Ph-OH + NaOH → PhO- Na+ + H2O
- Entrada en orto e para:
- Nitración
- Cloración (haloxenación)
Reaccións de fenois. A nitración

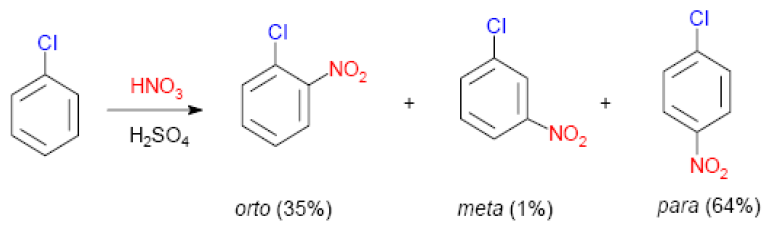
Nitración do clorobenceno
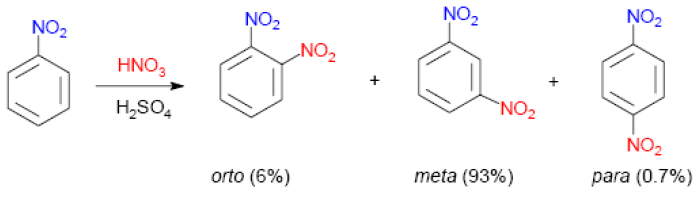
Nitración do tolueno

Nitración do nitrobenceno
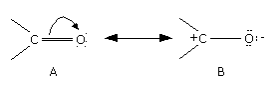
Reaccións de aldehídos e cetonas
Grupo carbonilo:
- Reaccións de adición:
- Alcohois
- HCN
- Amoníaco
- Reaccións de oxidación e redución
Reaccións de Fehling e Tollens
O reactivo de Fehling (e o de Tollens) dá reacción positiva con aldehidos e alfahidroxicetonas (cetonas cun grupo hidroxi adxacente), pero dá reacción negativa coas cetonas que non son α-hidroxicetonas. Os azucres chamados "cetosas" (a fructosa, por exemplo) son α-hidroxicetonas e, dan reacción positiva co Fehling, pero non así a propanona.
| Reaccións de Fehling (Cu2O) e de Tollens (Ag): | |
|---|---|
| Propanaldehido (propanal) | Positiva (formación de precipitado de Cu2O) Positiva (formación de espello de prata, Ag) |
| Propanona | Negativa Negativa |
| Glucosa (aldosa): | Positiva (formación de precipitado de Cu2O) Positiva (formación de espello de prata, Ag) |
| Fructosa (cetosa): | Positiva (formación de precipitado de Cu2O) Positiva (formación de espello de prata, Ag) |
Reaccións de ácidos carboxílicos
O seu enlace é moi polar e pode formar pontes de hidróxeno, polo tanto serán solubles en auga
- Reaccións de esterificación
- Reaccións de oxidación e redución
- Formación de amidas: Ácido + NH3 → Amida + Auga
Reaccións dos compostos nitroxenados
Nas aminas, o seu enlace no nitróxeno é polar e pode formar pontes de hidróxeno, polo tanto serán solubles en auga se o seu peso molecular é pequeno. Son ácidos débiles fronte a auga e son bases débiles fronte aos ácidos
Reactividade das aminas
- Ácido base: amina primaria + ácido carboxílico → amida sec + H2O
- Reaccións con haluros de alquilo: amina + cloruro alquilo → amina sec + HCl
Reactividade amidas
- Hidrólise: Amida + H2O → Ácido + NH3
- Redución: Amida + H2 → Amina; amida sec + H2 → amina sec
- Degradación (reacción de Hofmann): O tratamento con bases fortes conduce a aminas cun átomo de carbono menos (CO2)
- Deshidratación: Amida + desecante (P2O 5) → R-C≡N + H2O
Reaccións dos nitrilos
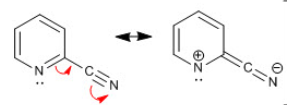
O seu triplo enlace no nitróxeno é polar e prodúcese un desprazamento por efecto mesómero
Reactividade dos nitrilos
- Hidrólise:
- R-C≡N + 2H2O → R-COOH + NH3
- R-C≡N + R-OH + H2O → R-COO-R' + NH3
- Redución.
-
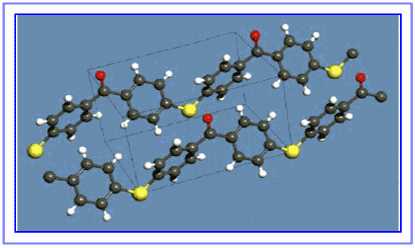
Polímeros
-
Definición
- Un polímero é unha macromolécula formada pola unión de moléculas de menor tamaño que se coñecen como monómeros
-
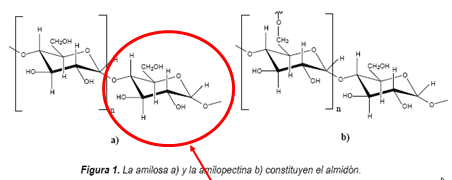
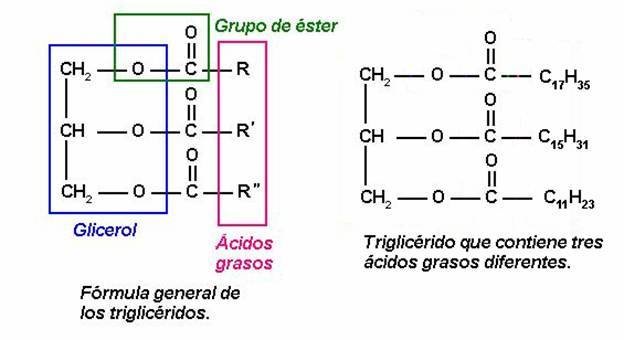
Polímeros naturais
- Entro os polímeros naturais máis importantes encontramos:
- - Proteínas
- - Polisacáridos
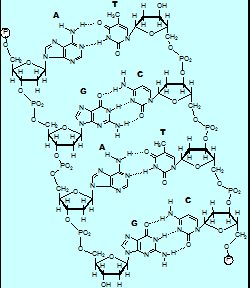
- - O DNA
- -Lípidos
-
Polímeros sintéticos
- Os polímeros sintéticos o artificiales son os fabricados porlo home. Clasifícanse en:
- Termoplásticos: polietileno, PVC, PS
- Elastómeros: caucho
- Termorrígidos: baquelita
- Fibras: poliéster, nylon (poliamida)
-
Plásticos
- Un plástico é un material polimérico. O termo vén do grego πλαστικός ( plastikos), "apto para moldaxe", de πλαστός ( plastos) "moldeado". Isto refírese á súa plasticidade durante o procesado, que permite o uso dunha gran cantidade de métodos de conformado, porén moitos plásticos xa procesados non presentan comportamento plástico (isto é, rompen sen se deformaren previamente).
-
Clasificación segundo o comportamento fronte a temperatura
-
Termoplásticos
- Un termoplástico é un plástico que a temperatura ambiente é plástico ou deformábel, derrétese cando é quentado e endurécese nun estado vítreo cando é suficientemente arrefriado.
- Os principais son:
- Polietilenos e derivados: empregan como materia prima o etileno obtido do craqueo do petróleo, o PVC, o polistireno, o metacrilato etc.
-
Termoestábeis
- Os plásticos termoestábeis son materiais que unha vez que sufriron o proceso de aquecemento-fusión e formación-solidificación, convértense en materiais ríxidos que non volven fundirse.
- Baquelita.
- Poliésteres
-
Clasificación segundo o método de síntese
- Polímeros de adición
- Implican sempre a ruptura ou apertura dunha unión do monómero para permitir a formación dunha cadea. (PE, CH2=CH2; PVC,ClHC=CH2;PS,Phe-CH=CH2;Caucho)
- Exemplo:
- 2n H2C=CH2 → [-CH2-CH2-CH2-CH2-]n
- Polímeros de condensación
- Son aqueles nos que a reacción ten lugar entre grupos funcionais reactivos presentes nos monómeros. Debe ter, cando menos, dous grupos reactivos por monómero para darlle continuidade á cadea. (poliamidas, poliésteres,PET)
- Exemplo:
- R-COOH + R'-OH → R-CO-OR' + H2O
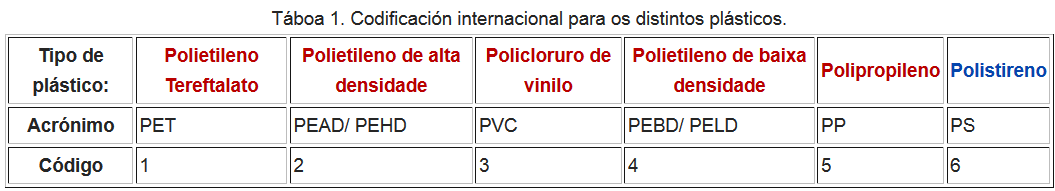
Codificación
- Existe unha grande variedade de plásticos e para clasificalos existe un sistema de codificación que se mostra na Táboa 1.
- Os produtos levan unha marca que consiste no símbolo internacional de reciclaxe co código correspondente no medio segundo o material específico.