2º Bacharelato
Ácidos e bases
Enric Ripoll 2020

Propiedades
ÁCIDOS :
Teñen sabor agre.
Son corrosivos para a pel.
Avermellan certos corantes vegetales .
Disolven sustancias
Atacan os metais desprendendo H2 .
Perden as súas propiedades ao reaccionar con bases.
Propiedades
BASES :
Ten sabor amargo.
Suaves ao tacto pero corrosivos coa pel .
Dan cor azul a certos colorantes vegetales.
Precipitan sustancias disoltas por ácidos.
Disolven graxas .
Perden as súas propiedades ao reaccionar cos ácidos.
Electrólitos
Son substancias
condutoras, en estado líquido ou disolución, que contén ións e deixan
pasar facilmente a corrente eléctrica .
Durante a electrólise, o electrólito sofre un proceso de descomposición química.
Actividades
1. Xustifica a maior ou menor condutividade eléctrica dunha disolución acuosa dunha substancia segundo que sexa : a) electrólito forte ou b), electrólito débil.
2 A figura mostra a disolución acuosa dun composto. Clasifícao como electrólito forte, electrólito débil ou non eleclrólito .
3 Razoa a veracidade ou falsidade da seguinte proposición : «O ácido nítrico é un electrólito forte, polo tanto, unha disolución acuosa 1 M do devandito ácido daría unha concentración 1 M de ións NO 3 - l M e 1 M de ións H + ».
Arrenius publica en 1887 a súa teoría de “disociación iónica”.
Hai sustancias (electrólitos) que en disolución se disocian en catións e anións.
ÁCIDO : Substancia que en disolución acuosa disocia catións H + .
BASE : Substancia que en disolución acuosa disocia anións OH – .
Definicións de ácidos e bases
HCl (en disolución acuosa) ➫ Cl – + H +
H 2 SO 4 (en disolución acuosa) ➫ SO 4 2 – + 2 H +
NaOH (en disolución acuosa) ➫ Na + + OH –
Disociación
ÁCIDOS FORTES:
AH (en disolución acuosa) ➫ A – + H +
BASES FORTES:
BOH (en disolución acuosa) ➫ B + + OH –
Definición de Arrhenius
Disociación
ÁCIDOS DÉBILES:
AH (en disolución acuosa) ⇄ A – + H +
Exemplos :
CH 3 COOH (en disolución acuosa) ⇄ CH 3 COO – + H +
BASES DÉBILES:
BOH (en disolución acuosa) ⇄ B + + OH –
Exemplo :
NH 4 OH (en disolución acuosa) ⇄ NH 4 + + OH –
Definición de Arrhenius
Definición de Arrhenius
Prodúcese ao reaccionar un ácido cunha base por formación de auga :
H + + OH – ➫ H 2 O
O anión que se disoció do ácido e o catión que se disoció da base quedan en disolución inalterados ( sae disociada):
NaOH +HCl ➫ H 2 O + NaCl ( Na + + Cl – )
NEUTRALIZACIÓN SEGUNDO ARRHENIUS
Arrhenius

ÁCIDO:
“Substancia que cede H + ” .
BASE:
“Substancia que acepta H + ”.
Definición de Brönsted e Lowry
Definición de Brönsted e Lowry
Sempre que unha sustancia se comporta como ácido (cede H + ) hai outra que se comporta como base (captura devanditos H + ).
Cando un ácido perde H + convértese na súa “base conxugada ” e cando unha base captura H + convértese no seu “ácido conxugado ”.
Pares ácido-base conxugados
Disociación dun ácido:
HCl (g) + H 2 O (l) ⇄ H 3 O + (ac) + Cl – (ac)
Neste caso o H 2 O actúa como base e o HCl ao perder o H + transfórmase en Cl – (base conxugada)
Disociación duna base:
NH 3 (g) + H 2 O (l) ⇄ NH 4 + + OH –
Neste caso o H 2 O actúa como ácido pois cede H + ao NH 3 que se transforma en NH 4 + (ácido conxugado)
Exemplos de par ácido-base conxugados
A teoría de Bronsted-Lowry permite xustificar porque moitas substancias poden actuar ás veces como ácidos e, outras, como bases. Así, por exemplo, vimos como a auga se comporta como unha base fronte ao ácido clorhídrico pero, non obstante, actúa como ácido fronte ao amoníaco. Este tipo de substancias denomínanse anfóteras
Substancias anfóteras
Actividades
8.- Utilizando a teoría de Brönsted-Lowry , clasifica como ácidos e bases as seguintes especies:
a) HCIO 4 , b) SO 3 2- , c) HPO 4 2- , d) NH 3
9.- Indica con nomes e fórmulas cales son os ácidos conxugados das seguintes bases:
a) OH - , b) HSO 4 - , c) CO 3 2- , d) NH 3
10.- Escribe as reaccións do ión HS - cunha base, NH 3 , e cun ácido, HIO 3 . Formula todas as especies químicas que aparezan.

ÁCIDOS:
“Substancia que contén polo menos un átomo capaz de aceptar un par de electróns e formar un enlace covalente coordinado”.
BASES:
“Substancia que contén polo menos un átomo capaz de aportar un par de electróns para formar un enlace covalente coordinado”.
Teoría de Lewis
Teoría de Lewis
Teoría de Lewis
Exemplos
HCl (g) + H 2 O (l) ⇄ H 3 O + (ac) + Cl – (ac)
Neste caso o HCl é un ácido porque contén un átomo (de H) que ao disociarse e quedar como H + vai aceptar un par de electróns do H2Ou formando un enlace covalente coordinado (H 3 O + ) .
NH 3 (g) + H 2 O (l) ⇄ NH 4 + + OH –
Neste caso o HCl é un ácido porque contén un átomo (de H) que ao disociarse e quedar como H+ vai aceptar un par de electróns do H2O formando un enlace covalente coordinado (NH 4 + ) .
Teoría de Lewis
Deste xeito , substancias que non teñen átomos de hidróxeno , como o AlCl 3 poden actuar como ácidos :
AlCl 3 + :NH 3 Cl 3 Al :NH 3
Cl H Cl H
| | | |
Cl–Al + : N–H ⇄ Cl– Al – N–H
| | | |
Cl H Cl H
A experiencia demostra que a auga ten unha pequena condutividade eléctrica o que indica que está parcialmente disociado en ións:
2 H 2 O (l) ⇄ H 3 O + (ac) + OH – (ac)
[ H 3 O + ] · [ OH – ]
K c = ——————
[ H 2 O ] 2
Como [ H 2 O ] é constante por tratarse dun líquido, chamaremos
K w = K c · [ H 2 O ] 2 = [ H 3 O + ] · [ OH – ]
coñecido como “ produto iónico da auga ”
Equilibrio de ionización da auga
Actividades
11 Por que se a auga non conduce practicamente a electricidade, dicimos que é moi perigoso tocar un enchufe ou un aparello eléctrico cando estamos mollados?
12 Xustifica a seguinte afirmación: «A concentración de auga pura é 55.6 mol/L».
13 Dinnos que nunha disolución acuosa dun ácido
dado a 37°C, a concentración de ións
hidronio
é 2.55·10
-3
mol/L. É posible que nela existan ións hidróxido? En caso Afirmativo, calcula a
súa concentración. É necesario ter un dato do volume para realizar este
cálculo?
Mira a kw no libro

Medida da acidez, concepto de pH
O valor do devandito produto iónico da auga é: K W (25ºC) = 10 –14
No caso da auga pura:
[ H 3 O + ] = [ OH – ] = 10 –7 M
Denomínase pH a:

E, para o caso de auga pura, como [ H 3 O + ] =10 –7 M:
pH = – log 10 –7 = 7
Tipos de disolucións
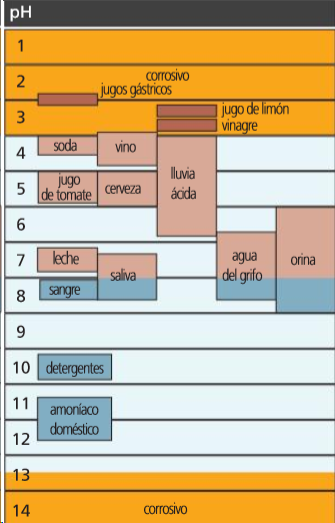
Ácidas: [ H 3 O + ] > 10 –7 M ➡ pH < 7
Básicas: [ H 3 O + ] < 10 –7 M ➡ pH > 7
Neutras: [ H 3 O + ] = 10 –7 M ➡ pH = 7
En todos os casos: K w = [ H 3 O + ] · [ OH – ]
Polo tanto se [ H 3 O + ] aumenta (disociación dun ácido), entón [ OH – ] debe diminuír para que o produto de ambas concentracións continúe sendo 10 –14
Escala de pH![http://getwellstaywellathome.com/blog/wp-content/uploads/2012/03/ph-scale-1024x512.jpg]()
Escala de pH
Concepto de pOH
Ás
veces
úsase
este
outro
concepto,
case
idéntico
ao
de
pH
:
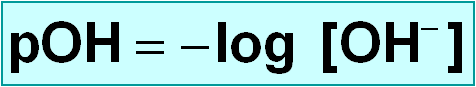
Como K w = [ H 3 O + ] · [ OH – ] = 10 –14
Aplicando logaritmos e cambiando o signo tendríamos:
pH + pOH = 14
para unha temperatura de 25 ºC .
Actividades
14 É sempre: pH + pOH = 14?
15 Sabendo que o pH dunha disolución a 37°C, é 3.7, calcula a concentración de ións hidróxido que hai presentes. Utiliza os datos que necesites da táboa 3.
16 Nalgunhas zonas industriais chegouse a medir auga de chuvia con pH de 2.0. Cantas veces é maior a concentración de ións hidronio nesta auga que na auga de chuvia normal, cuxo valor do pH é 5.8?

Forza dos ácidos
Segundo o valor de K a falaremos de ácidos fortes ou débiles :
Se K a > 100 ➡ O ácido é forte e estará disociado case na súa totalidade .
Se K a < 1 ➡ O ácido é débil e estará só parcialmente disociado .
Por exemplo, o ácido acético (CH 3 –COOH) é un ácido débil xa que a súa K a = 1,8 · 10 –5
Forza das bases
En disolucións acuosas diluidas ( [ H 2 O ] » constante) a forza dunha base BOH depende da constante de equilibrio:
B + H 2 O ⇄ BH + + OH –
[ BH + ] x [ OH – ] [ BH + ] x [ OH – ]
K c = —————— ; K c x [ H 2 O ] = ——————
[ B ] x [ H 2 O ] [ B ] 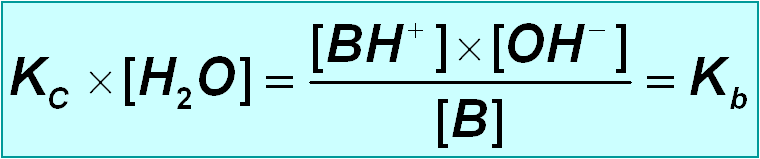
Forza dos ácidos e das bases: Ka
Ao igual que o pH denomínase pK a:
pK a = – log K a ; pK b = – log K b
Canto maior é o valor de K a ou K b , maior é a forza do ácido ou da base.
Igualmente, canto maior é o valor de pK a ou pK b menor é a forza do ácido ou da base.
Relación entre ka e kb
Equilibrio de disociación dun ácido:
HA + H 2 O ⇄ A – + H 3 O +
Reacción da base conxugada coa auga :
A – + H 2 O ⇄ HA + OH –
[
A
–
]
x
[
H
3
O
+
]
[
HA
]
x
[
OH
–
]
K
a
=
——————
;
K
b
=
——————
[ HA ] [ A – ]
[
A
–
]
x
[
H
3
O
+
]
x
[
HA
]
x
[
OH
–
]
K
a
x
K
b
=
——————————
—
—
—
— = K
W
[ HA ] x [ A – ]
Relación entre ka e kb
Na práctica, esta relación ( K a x K b = K W ) significa que:
Se un ácido é forte a súa base conxugada é débil.
Se un ácido é débil a súa base conxugada é forte .
Á constante do ácido ou base conxugada na reacción coa auga chamamola constante de hidrólise ( Kw ).
Ácidos fortes e débiles
Ácidos poliprótidos
Son os que poden ceder más dun H + . Por exemplo o H 2 CO 3 é diprótico . Existen tantos equilibrios como H + se podan disociar:
H 2 CO 3 + H 2 O ⇄ HCO 3 – + H 3 O +
HCO 3 – + H 2 O ⇄ CO 3 2– + H 3 O
[ HCO 3 – ] · [ H 3 O + ] [ CO 3 2– ] · [ H 3 O + ] K a1 = ————————------ K a2 = ——————----------- [ H 2 CO 3 ] [ HCO 3 – ]
K a1 = 4,5 · 10 –7 M K a2 = 5,7 · 10 –11 M As constantes sucesivas sempre van diminuíndo.

Cálculo del pH


Actividades
17. Escribe as expresións das constantes de disociación (ou ionización) dos ácidos HF, H SO 4 - e NH 4 + e das bases F – , OH – e NH 3 .
18. Comproba a validez da expresión escrita no texto: Ka · Kb = Kw.
19. Utilizando os datos de constantes de ionización do apéndice do texto, ordea de menor a maior o carácter básico das seguintes especies químicas fronte á auga: HS – , NO 2 – , HPO 4 2– , NH 3 .
20. Ordena de menor a maior a acidez fronte á auga as especies H 3 PO 4 ,H 2 PO 4 – e HPO 4 2-
21. Á vista da estrutura molecular do HNO 2 e do HNO 3 , xustifica a maior forza relativa do ácido nítrico.
Relación entre a constante de acidez e o grao de disociación
Na disociación dun ácido ou unha base:
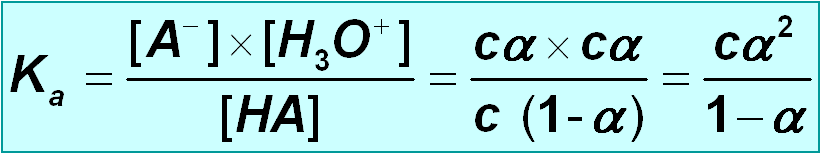
Igualmente:
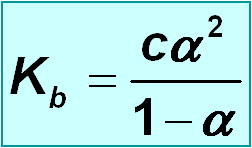
No caso de ácidos ou bases moi débiles ( K a /c o K b /c < 10 –4 ), α despreciase fronte a 1 co que : K a = c a 2 ( K b = c a 2 )
De onde :

Actividades
22. Calcula o pH e o grao de ionización das seguintes disoluciones acuosas, todas elas 0.05 M: a) HNO 3 ; b) HNO 2 ; c) C 6 H 5 NH 2 .
(Consulta os datos de Ka e Kb no apéndice do libro.)
23. Calcula o pH dunha disolución 0.250 M de amoniaco sabendo que está ionizada un 0.84%. Que volume de ácido clorhídrico 0.125 M se necesitaría para neutralizar 50 mL da disolución anterior?
24. Calcula a constante de ionización dun ácido débil monoprótico ionizado un 2.5%, en disolución acuosa 0.2 M.
25. Calcula o pH da disolución resultado de mesturar 100 mL dunha disolución acuosa de HCl ao 29.2% en masa e densidade 1.145 g/cm 3 con 100 mL doutra disolución acuosa de hidróxido de potasio 2.5 M.
Hidrólise de sales
É a reacción dos ións dun sal coa auga.
Só é apreciable cando estes ións proceden dun ácido ou unha base débil:
Hidrólise ácida (dun catión) :
NH 4 + + H 2 O ⇄ NH 3 + H 3 O +
Hidrólise básica (dun anión) :
CH 3 –COO – + H 2 O ⇄ CH 3 –COO H + OH –
Tipos de hidrólise
Segundo procedan o catión e o anión dun ácido ou unha base forte ou débil, os sales clasifícanse en:
Sales procedentes de ácido forte e base forte.
Exemplo: NaCl
Sales procedentes de ácido débil e base forte.
Exemplo: NaCN
Sales procedentes de ácido forte e base débil.
Exemplo: NH 4 Cl
Sales procedentes de ácido débil e base débil.
Exemplo: NH 4 CN
Sales procedentes de ácido forte e base forte .
Exemplo: NaCl
NON SE PRODUCE HIDRÓLISIS
xa
que tanto o Na
+
que é
un
ácido
moi
débil como o Cl
–
que é unha base
moi
débil apenas
reaccionan
con
auga
. É
dicir
os
equilibrios
:
Na
+
+ 2 H
2
O
D
NaOH
+
H
3
O
+
Cl
–
+ H
2
O
D
HCl
+
OH
–
están moi desprazados cara á esquerda.
Sal de ácido forte e base forte
Sales procedentes de ácido forte e base débil.
Exemplo: NH 4 Cl
PRODÚCESE HIDRÓLISIS ÁCIDA xa que o NH4+ é un ácido relativamente forte e reacciona con auga mentres que o Cl– é unha base débil e non o fai de forma significativa: NH 4 + + H 2 O ⇄ NH 3 + H 3 O +
o que provoca que o pH < 7 ( dis . ácida).
Sales procedentes de ácido forte e base débil
Sales procedentes de ácido débil e base forte .
Exemplo: Na+CH3–COO
–
PRODÚCESE HIDRÓLISIS BÁSICA xa que o Na + é un ácido moi débil e apenas reacciona con auga, pero o CH 3 –COO – é unha base forte e si reacciona con esta de forma significativa:
CH 3 –COO – + H 2 O Á CH 3 –COO H + OH –
lo que provoca que o pH > 7 (dis. básica).
Sal de ácido débil e base fuerte
Sales procedentes de ácido débil e base débil
Exemplo : NH 4 CN
Neste
caso tanto o catión NH
4
+
como o anión CN
–
hidrolizanse
e a disolución será ácida
ou
básica segundo que ion se hidrolice en
maior
grado.
Como Kb(CN
–
) = 2 · 10
–5
M e
Ka (NH 4 + ) = 5,6 · 10 –10 M , neste caso, a disolución é básica xa que Kb(CN – ) é maior que Ka (NH 4 + )
Sal de ácido débil e base débil
Actividades
26. Xustifica como será o pH das disolucións acuosas dos seguintes sales: NaCN ; NH4Br; NaF . Cal de todas elas terá o maior valor de pH?
Utiliza os datos necesarios da táboa 5.
27. Unha disolución acuosa de cloruro de estano (IV), será ácida, básica ou neutra?
28. Mestúranse 50 mL de HCl 0.1 M con 50 mL de NH 3 de igual concentración. Razoa como será o pH da disolución resultante.
29. Calcula o pH e o grado de hidrólise dunha disolución acuosa 0.50 M de cloruro de amonio.



Efecto del ión común

Efecto del ión común

Disolucións amortiguadoras
Son capaces de manter o pH logo de engadir pequenas cantidades tanto de ácido como de base. Están formadas por:
Disolucións de ácido débil + sal de devandito ácido débil con catión neutro:
Exemplo: ácido acético + acetato de sodio.
Disolucións de base débil + sal de devandita base débil con anión neutro:
Exemplo: amoníaco e cloruro de amonio.
Disolucións amortiguadoras
Disolucións amortiguadoras
Actividades
30. Explica, coas correspondentes ecuacións, como funcionaría unha disolución reguladora formada por amoníaco e cloruro amónico.
31. Deduce a expresión que permite calcular o pOH no par formado por unha base e o seu ácido conxugado.
32. Calcula a variación de pH que se produce cando se engade 1 mL de HCl 1 M a 1 L de disolución reguladora de amoníaco 0.75 M e cloruro de amonio 0.75 M.

Indicadores ácido-base
Son substancias que cambian de cor ao pasar da forma ácida á básica:
HIn + H 2 O ⇄ In – + H 3 O +
forma ácida forma básica
O cambio de cor considérase apreciable cando [ HIn ] > 10·[In – ]
ou [ HIn ]< 1/10·[In – ]
[ In – ] · [ H 3 O + ] [ HIn ]
K a = —————— ; [ H 3 O + ] = K a · ———
[ HIn ] [ In – ]
pH = p K a + log [ In – ] / [ HIn ] = p K a ± 1
|
Indicador |
Color forma ácida |
Color forma básica |
Zona de viraxe (pH) |
|
Violeta de metilo |
Amarelo |
Violeta |
0-2 |
|
Vermello Congo |
Azul |
Vermello |
3-5 |
|
Vermello de metilo |
Vermello |
Amarelo |
4-6 |
|
Tornasol |
Vermello |
Azul |
6-8 |
|
Fenolftaleína |
Incoloro |
Rosa |
8-10 |
Indicadores
Indicadores
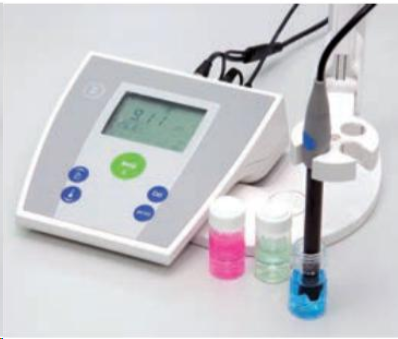
Valoracións ácido-base
Valorar é medir a concentración dun determinado ácido ou base a partir da análise volumétrico da base ou ácido utilizado na reacción de neutralización .
Valoracións ácido-base
Enric Ripoll
Gráfica dunha valoración
Valoración con indicador
Enric Ripoll
Valoración con pHmetro
Enric Ripoll
Cálculo da concentración
A neutralización dun ácido/base cunha base/ácido de concentración coñecida conséguese cando n( OH – ) = n( H 3 O + ).
A
reacción de neutralización
pode
escribirse:
b H a A + a B(OH) b → B a A b + a · b H 2 O
En realidade , o sal B a A b ( aB b+ + bA a – ) encóntrase disociada, polo que a única reacción é: H 3 O + + OH – → 2 H 2 O
n (ácido) x a = n (base) x b
cálculo da concentración
V ácido x [ácido] x a = V base x [base] x b
Aínda se usa moito a concentración expresada como Normalidade :
Normalidade = Molaridade x n (H u OH)
V ácido x N ácido = V base x N base
No caso de sales procedentes de ácido ou base débiles debe utilizarse un indicador que vire ao pH do sal resultante da neutralización.
Actividades
33. Debuxa a curva de valoración que resulta de valorar unha base forte cun ácido forte.
34. Quérese determinar o contido de NaOH nunha sosa cáustica comercial mediante a súa valoración cun ácido forte. Para iso, pésanse 2.0 g de sosa e disólvense nun matraz aforado ata un volume final de 500 mL. Sabendo que 25.0 mL desta disolución necesitaron 18.8 mL de HCl 0,1 M ata o viraxe do indicador, pídese:
a) A pureza en NaOH da sosa, expresando o resultado como % en masa.
b) Un indicador apropiado para poder seguir a valoración.
