4 ESO. LA REACCIÓN QUÍMICA
Relator: Enric Ripoll 2018
La reaccion Química
Relator: Enric Ripoll 2019
- Reactivos y productos
- Mecanismo de una reacción
- Leyes de la química
- Cálculos con ecuaciones químicas
- Reacciones químicas y energía
- Tipos de reacciones
Reactivos y productos
Actividades: 1
Mecanismo de una reacción
Teoría de las colisiones
Complejo activado
Actividades: 2, 3, 4
Teorías para explicar la cinética química

Teoría de las colisiones
Teoría del complejo activado
Leyes fundamentales de la química
Conservación de la masa
Proporciones definidas
Actividades: 5
Leyes fundamentales de la química
Ley de Gay-Lussac
Hipótesis de Avogadro
Actividades: 6, 7, 8, 9, 10
Cálculos con ecuaciones químicas
Actividades: 11, 12, 13, 14, 15
Reacciones Químicas y energía
Actividades: 16, 17
Velocidad de las reacciones
Actividades: 18, 19
Factores
Actividades 20, 21
¿Qué es la cinética Química?
La concentración de los reactivos

Concentración
Factores que influyen en la velocidad de las reacciones químicas.

Concentración
Temperatura
Catalizadores
Grado de división de los reactivos
Naturaleza de los reactivos
La concentración de los reactivos

Concentración
La temperatura

Grado de división de los reactivos
Naturaleza de los reactivos
Utilización de catalizadores en procesos industriales.
Síntesis del amoníaco: Proceso de Haber-Bosch. Usa un catalizador de hierro y óxidos metálicos
Utilización de catalizadores
Catalizadores biológicos
Catalizadores
- No se consumen en la reacción
- Pueden ser:
- Positivos
- Negativos
- La catálisis puede ser:
- Homogénea
- Heterogénea
Actividades


Actividades



Actividades

Mecanismo y molecularidad
1º Paso: 2 NO2 → NO3 + NO (lento)
2º Paso: NO3 + CO → NO2 + CO2 (rápido)
Actividades


Actividades

Actividades

Actividades

Actividades del final


Actividade del final


Actividade del final

Deducción de un orden de reacción

Supón que a partir de dos reactivos A y B variamos la concentración inicial de A manteniendo constante la de B. Los resultados se encuentran en la tabla siguiente. ¿Cuál es el orden de esta reacción respecto de A?
Deducción del orden de una reacción
6) Explica si se atraen o se repelen dos péndulos eléctricos que:
a) No están cargados eléctricamente.
b) Están cargados con electricidades del mismo tipo.
c) Estén cargados con electricidades de signos contrarios.
7) Completa las siguientes frases en tu cuaderno:
a) Los fenómenos eléctricos son debidos a una propiedad de la materia denominada ___________
b) En la materia existen dos tipos de cargas eléctricas, denominadas ________ y ________
c) Las cargas del mismo tipo se ______ y las cargas de distinto tipo se _____________
d) Un cuerpo es eléctricamente neutro cuando el número de cargas positivas es ____________ al número de cargas negativas.
Naturaleza eléctrica
8. Responde verdadero o falso y justifica tu respuesta:
«Un cuerpo eléctricamente neutro es el que no tiene cargas positivas ni negativas.»
La carga del electrón es la carga elemental; por tanto, la carga eléctrica de un cuerpo es un múltiplo entero de la carga del electrón.
9. Identifica cuáles de estas cantidades de carga eléctrica no pueden ser posibles:
10. Si al frotar un cuerpo este adquiere una carga positiva de 10-5 C, ¿qué carga ha adquirido el cuerpo con el que se frotó? ¿por qué?
Naturaleza eléctrica
11. Observa el esquema del tubo de descarga similar a aquel en el que Thomson descubrió los electrones y Goldstein, los protones.
¿De qué electrodo (ánodo o cátodo) crees que parten
a) los electrones?
b) ¿A qué electrodo se dirigen?
c) ¿Qué tipo de sustancia contiene el tubo en su interior?
d) ¿A qué electrodo se dirigen los protones?
Naturaleza eléctrica
Naturaleza eléctrica
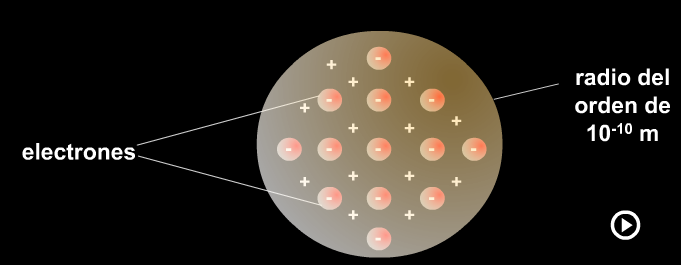
Modelo de Thomson
Modelo de Thomson
Modelo de Thomson
13. Describe cómo es el modelo de átomo ideado por Thomson. Según este modelo, ¿cómo es el átomo, divisible o indivisible?
14. ¿Cómo explica el modelo atómico de Thomson los fenómenos de electrización por frotamiento? Explícalo con la ayuda de esquemas o dibujos.
15. ¿Cómo adquiere un cuerpo eléctricamente neutro carga positiva? ¿Y carga negativa?
16. ¿Qué relación hay entre el número de electrones y el de protones en la materia eléctricamente neutra?
Descubrimiento del protón
Descubrimiento del neutrón
Características de las partículas atómicas
Modelo de Rutherford
Actividades
17.Copia en tu cuaderno y completa los textos siguientes:
«Durante mucho tiempo, los científicos creyeron que los átomos eran las partículas más pequeñas de la materia. Actualmente sabemos que los átomos están formados por partículas más pequeñas llamadas ___»
«Un _ es una partícula que tiene carga positiva y está localizada en el _ del átomo»
«El _ es una partícula que no tiene carga eléctrica y que, junto al ___ está localizada en el ___del átomo.»
«Existe una tercera particula, llamada _, que tiene carga eléctrica _ y que no está localizada en el _ del átomo.»
18. Relaciona a los siguientes científicos: Geiger y Marsden, J. J. Thomson, E. Goldstein, J. Chadwick y R. Rutherford, con su aportación al estudio de la estructura del átomo:
a) Descubrimiento del protón.
b) Descubrimiento del electrón.
c) Modelo atómico del pudin de pasas.
d) Descubrimiento del neutrón.
e) Experiencia de la lámina de oro,
f) Modelo del átomo nuclear.
Actividades
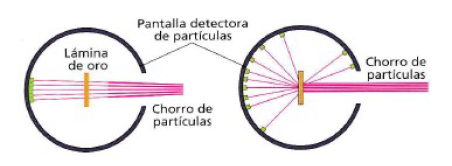
19. En las ilustraciones se representan las experiencias de Geiger y Marsden. En una de ellas observamos cuáles eran los resultados esperados de acuerdo con el modelo de Thomson y en la otra, los resultados reales, Identifica cada una de estas ilustraciones y explica:
a) Por qué eran esperables estos resultados, según Thomson,
b) Cómo justifica Rutherford esos resultados experimentales
Explica cómo justifica el modelo atómico de Rutherford que en el experimento de Geiger y Marsden:
a) La mayor parte de las partículas positivas atravesaran la lámina de oro sin desviarse.
b) Algunas partículas positivas se desviaran considerablemente.
c) Unas pocas partículas positivas rebotaran hacia la fuente de emisión.
Actividades
20. ¿Por qué se vio obligado Rutherford a suponer que en el núcleo debía existir una partícula que aún no se había descubierto y a la que denominaron neutrón?
21. Escribe en tu cuaderno la opción correcta. La carga del electrón es:
a) Mayor que la del protón.
b) Menor que la del neutrón
c) Igual que la del protón.
22. ¿Qué partículas son, fundamentalmente, las responsables de la masa del átomo?
23. Las partículas con las que Geiger y Marsden bombardearon la fina lámina de oro eran partículas alfa. Una partícula alfa es un átomo de helio que tiene en su núcleo dos protones y dos neutrones, pero ha perdido sus dos electrones:
a) ¿Cuál es la carga de una partícula alfa?
b) ¿Cuál será la masa, expresada en kilogramos, de una partícula alfa?
c) Dibuja un átomo completo de helio y una partícula alfa a partir de un átomo de helio.
Actividades
24. En esta página web puedes encontrar un simulador del experimento de Geiger y Marsden. Con la ayuda de las simulaciones, explica qué se esperaba que sucediera de acuerdo con el modelo de Thomson y qué es la que realmente sucedió:
25.Relaciona cada partícula: electrón, protón y neutrón, con alguna o algunas de las características siguientes:
a) Tiene carga eléctrica positiva.
b) No posee carga eléctrica.
c) Se encuentra solo en el interior del núcleo.
d) Gira alrededor del núcleo.
e) Tiene una masa ligeramente mayor que la del protón.
f) Tiene carga eléctrica negativa.
g) Su masa es menor que la del protón.
Actividades
26. Un átomo de hidrógeno está formado por un protón y un electrón.
a) ¿Cuál es la masa del átomo de hidrógeno?
b) ¿Qué le ocurrirá al átomo de hidrógeno si pierde su único electrón?
27. Escribe en tu cuaderno las opciones correctas y corrige las incorrectas.
a) un átomo de flúor se convierte en un anión cuando pierde un protón.
b) Un átomo de flúor se convierte en un anión cuando gana un electrón.
c) Un átomo de sodio se convierte en un catión ganando un protón,
d) Un átomo de sodio se convierte en un catión perdiendo un electrón
¿Cómo se identifican los átomos
28. Copia en tu cuaderno y completa la siguiente frase:
«El número atómico del cobre, Cu, es 29, y su número másico 64, lo cual quiere decir que este átomo de cobre tiene ___ protones y _ neutrones, y si es eléctricamente neutro, tiene ___ electrones.»
29. Representa los átomos de cada uno de los elementos siguientes:
Oxígeno, símbolo O, Z=8, A = 16,
Nitrógeno, símbolo N, Z=7, A=14,
Calcio, símbolo Ca, Z = 20, A= 40.
Magnesio, símbolo Mg, número de protones 12 y número de neutrones 13,
Bromo, símbolo Br, número de protones 35 y número de neutrones 45,
¿Cómo se identifican los átomos
30. Determina el número de protones, neutrones y electrones de:
a) Un átomo de eléctricamente neutro.
b) Un ion
c) Un ion
d) Un átomo de eléctricamente neutro,
e) Un átomo de eléctricamente neutro,
¿Cómo se identifican los átomos
31. El número de neutrones del litio es uno más que el de protones. Sabiendo que su número másico es 7:
a) ¿Cuál es su número atómico?
b) ¿Cuántos electrones tiene un átomo de litio eléctricamente neutro?
32.¿Puede un átomo de número atómico 17 tener como isótopo otro átomo cuyo número atómico sea 18? Justifica tu respuesta.
33. Conocemos los siguientes datos sobre los átomos A, B, C y D:
|
A |
B |
C |
D |
|
13 protones |
14 protones |
14 protones |
13 protones |
|
14 neutrones |
13 neutrones |
15 neutrones |
15 neutrones |
a) ¿Cuáles pertenecen a isótopos diferentes del mismo elemento?
b) ¿Cuáles pertenecen al mismo isótopo del mismo elemento?
c) ¿Son B y C átomos del mismo elemento?
¿Cómo se identifican los átomos
34. El número de neutrones del sodio es dos más que el de protones. Si su número másico es 23, ¿cuántos electrones tendrá?
35. Escribe el número de protones, neutrones y electrones de cada uno de estos átomos:
a) ; b) ; c) ; d)
Isótopos
Problemas con el modelo de Rutherford
Según las leyes del electromagnetismo, cualquier carga eléctrica en movimiento acelerado, emite energía continuamente en forma de radiación.
Para Rutherford, el electrón gira alrededor del núcleo, lo que implica una aceleración centrípeta.
Los nuevos modelos atómicos
Postulados de Bohr
Primer postulado. Existe cierto número de órbitas circulares estables en las cuales el electrón se desplaza a gran velocidad sin emitir energía.
Con este postulado se evita el gran inconveniente que presentaba el modelo atómico de Rutherford, ya que el electrón no emite energía al girar en su órbita.
Segundo postulado. El electrón tiene en cada órbita una energía determinada, que es tanto mayor cuanto más alejada del núcleo se encuentra esa órbita. Lo que caracteriza a una órbita es el nivel energético, que se identifica por un número (n=1, 2, 3...)
No todas las órbitas son posibles y, además, cada una es distinta de las demás. Los niveles de energía son diferentes para cada elemento, por eso sus espectros atómicos también lo son.
Tercer postulado. El electrón no radia energía mientras permanece en una órbita estable. Cuando cae de un nivel de energía superior a otro de energía inferior, emite una cantidad de energía definida en forma de radiación.
Los nuevos modelos atómicos

La distribución de los electrones en las capas se denomina configuración electrónica y se realiza de la siguiente manera: La 1ª capa puede contener,
como máximo, 2 electrones. La 2ª capa puede contener, como máximo, 8 electrones. Comienza a llenarse una vez que la 1ª ya está completa. La 3ª capa puede contener, como máximo, 18 electrones.
Comienza a llenarse una vez que la 2ª capa ya está completa. El número de electrones en cada capa se representa entre paréntesis y separados por comas.
Por ejemplo, un átomo que tenga 11 electrones, los distribuye así: (2,8,1). Es decir, 2 electrones en la capa 1, 8 electrones en la capa 2 y 1 electrón en la capa 3.
El modelo de Bohr
Los nuevos modelos atómicos
36. Elige y copia en tu cuaderno la opción correcta.
a) Cuando un átomo es excitado, algunos electrones pueden pasar de niveles de _ energía a otros de _ energía.
b) Cuando un electrón emite energía es porque ha pasado de un nivel de _ energía a otro de _ energía_
37.Corrige las afirmaciones que sean falsas.
a) El nivel energético 2 puede contener como máximo 18 electrones.
b) El nivel energético 1 puede contener como máximo 2 electrones.
c) El modelo atómico de Rutherford no es válido, porque cualquier carga eléctrica que gire debe emitir radiación y esto no sucede.
d) El primer postulado de Bohr afirma que el electrón se mueve alrededor del núcleo en órbitas circulares, sin que exista emisión de energía.
e) Según Bohr, todos los electrones de un átomo se encuentran en un mismo nivel de energía.
Los nuevos modelos atómicos
38. Responde a las siguientes cuestiones relacionadas con los modelos atómicos de Bohr, Thomson y Rutherford.
a) Ordena cronológicamente estos modelos atómicos.
b) Describe brevemente las características de cada uno de los modelos.
c) Asocia cada modelo con uno de los siguientes dibujos:

Definiciones
39. Asocia cada térrino con su defnición: número atómico, isótopo, núcleo atómico, ion y neutrón.
a) El centro de un átomo.
b) Número de protones en un núcleo.
c) Partcula nuclear sin carga eléctrica.
d) Átomo con carga eléctrica.
e) Átomos de un mimo elemento con diferente número de neutrones en su núcleo.
Cómo dibujar átomos

Radioactividad

Lectura comprensiva
«1001 cosas que todo el rundo debería saber sobre ciencia., de Jares TREFIT.
La radiactvidad no es innatural. Puesto que e/ conociriento hurano de la radiactvidad es reciente, mucha gente cree que es algo nuevo en el entorno hurano. De hecho, nuestra especie vive y ha evolucionado en un entorno que está lleno de radiactvidad. El uranio, que sufre desintegraciones radiactvas, es un elerento corún en la corteza terrestre. Es más corún que elerentos coro la plata y e/ rercurio. La desintegración en cadena que inicia llena la Tierra de núcleos radiactvos Aderás, la Tierra está siendo bombardeada constanterente por los rayos cósricos. Estos son, en su rayor parte, protones y otras partculas de alta energía y se generan en el Sol y en otras estrellas, y llueven constanterente sobre nuestra atmósfera. Allí colisionan con las moléculas del aire y producen lluvias de partculas. En este mismo momento, las partculas de esas lluvias pasan a través de nuestros cuerpos con una frecuencia de unas tres veces por minuto, añadiéndose así a los niveles de radiación de fondo.
Así cuando lee usted algo acerca de que se ha descubierto radiactvidad en alguna parte, tene que ser consciente de que en la mayoría de los lugares hay ya materiales radiactvos y de que la pregunta que debe formularse no es ¿es radiactvo?, sino ¿es más radiactvo de lo debería ser normalmente?
Lectura comprensiva
a) ¿Por qué la gente cree que la radiactvidad es un fenómeno moderno?
b) ¿Qué fenómenos naturales relacionados con la radiactvidad describe el autor?
c) ¿Qué son los rayos cósmicos y cuál es su origen?
d) ¿La radiactvidad natural es perjudicial?
Presentación
Estratexias necesarias na actividade científica: O método científico
O método científico

Actividades
1. Suscita dous problemas, un que se poida investigar cientificamente e outro que non poida serdo. Para o primeiro deles, enuncia algunhas hipóteses cientificas.
2. No seguinte relato, identifica as etapas do método científico: No último terzo do século xviii se sabia que cando os metais quentábanse (calcinábanse), no proceso gañábase peso. Por que ocorría isto? En 1774, Lavoisier abordou o fenómeno o supoñendo que na calcinación dos metais estes reaccionaban con algún compoñente do aire, e a iso atribuíu o aumento de peso. Para comprobalo, quentou mercurio nun recipiente pechado e comprobou que o peso total non cambiou durante o proceso. Xurdiu así a «lei de conservación da masa».
3. Deseña un experimento, diferente ao de Galileo, para comprobar que a rapidez de caída dos corpos non depende do seu peso. Realiza unha procura en Internet titulada «Experimento pluma martillo Lúa»; unha vez que atopes o video dunha experiencia que se realizou na superficie da Lúa explica, dun modo crítico, que se podería concluír dela.
Magnitudes físicas.
- Unha magnitud física é calquera propiedade da materia que se pode medir de forma obxectiva
- Unha unidade física é calquera cantidade arbitraria que se adopta como patrón de unha magnitude
Sistema Internacional de unidades

Actividades
5. No último párrafo do apartado 2.4 incluíronse algúns exemplos de unidades que non pertencen ao Sistema Internacional de Unidades. Con que magnitudes están relacionadas? Busca a equivalencia entre estas unidades e as correspondentes do SI.
Actividades
7. Inventa unha unidade de lonxitude, e expresa nela a túa altura.
Ao comezo deste tema falouse de que o fracaso do proxecto da Mars Climate Orbiter debeuse a que non todos os equipos utilizaron o mesmo sistema de unidades. Indaga en Internet cal foi, exactamente, o erro cometido. Na túa indagación, segue o esquema simplificado do método científico mostrado o epígrafe anterior.
A análise dimensional
Actividades

Actividades

A medida
Medir é unha operación que consiste en determinar a cantidade dunha magnitude ao comparala coa súa unidade.
Instrumentos de medida
Para medir úsanse instrumentos, algunhas calidades destes son:
- Cotas máxima e mínima
- Sensibilidade
- Fiabilidade
Medidas directas e indirectas
Actividades
En www.anayaeducacion.es atópase unha animación interactiva que che axudará a utilizar correctamente o calibre. Pensa en como medirías o grosor dunha folla de papel, de forma directa e de forma indirecta.
Erros nas medidas
- Tipos de erros
- Accidentais
- Sistemáticos
- Precisión
- Similitude nas medidas realizadas
- Exactitude
- Proximidade entre medidas realizadas e valor real
- Erro absoluto e relativo
- Cálculo de erros nas medidas indirectas
- Notación científica
- Expresión da medida: 10±3 cm
- Interpretación de gráficas, dedución de leis
Mútiplos e submúltiplos no SI
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Actividades
13. Pode ser unha medida precisa pero inexacta? E o contrario? Propón algún exemplo para apoiar o teu razoamento.
14. Cando se mira a hora nun reloxo que atrasa, estase cometendo un erro sistemático ou aleatorio?
15. Se mides a túa altura cunha cinta métrica, e o erro absoluto da medida é de 1 cm, cal é o erro relativo? Exprésao mediante valor numérico e porcentual.
16. Explica a diferenza entre exactitude e precisión.
Actividades
17. Realízanse cinco medidas da lonxitude da mesa do laboratorio cunha cinta métrica, obtendo estes valores, en cm:
120,6 120,4 120,5 120,4 120,3.
Cal sería o valor da medida? E os erros, absoluto e relativo?
18. Cando se miden as dimensións dun obxecto plano rectangular obtense: a = 40,05 ± 0,01 cm e b = 120,1 ± 0,1 cm. Determina a superficie e o erro absoluto da medida.
19. Expresa estas cantidades en notación científica:
a) 75 600 000 g
b) 0,000 000 025 V
c) 149 800 000 km
20. Selecciona en cada parella a cantidade superior:
a) 0,0055 m3 e 5,5 mL. b) 612 cg e 0,0612 kg.
Actividades
19. Expresa correctamente as medidas das actividades 17 e 18 da páxina anterior.
20. Para medir a celeridade dun móbil procédese a medir o espazo que percorre e o tempo que tarda en facelo. Realízanse tres medidas de cada magnitude, obtendo os seguintes valores:
e1= 49,9 cm e2=49,9cm e3=50,0 cm
t1=1,47s t2=1,51s t3=1,50 s
a) Determina o limiar de resolución dos instrumentos de medida utilizados.
b) Cal é a celeridade?
c) E o erro relativo?
Actividades
21. Que podes concluír das diferenzas entre as cantidades numéricas 2,0: 2,00: 2,000, procedentes da medida experimental dunha magnitude física?
22. Sería correcto dicir que unha medida de tempo dá como resultado t = 1,35±0,15 s. Por que?
23. Móstranse a continuación parellas de datos tempo (s)-distancia (cm) medidos nun movemento: (1, 3.9); (2, 8.2); (3, 11.7); (4, 16.0); (5, 19.9). Preséntaos nunha táboa de datos e a partir da súa representación gráfica, determina relación entre as dúas magnitudes físicas.
Actividades
24. Estuda as relacións de proporcionalidade na ecuación d=m/V, onde d é a densidade, m é a masa, e V o volume.
25. Propón dous exemplos de pares de magnitudes independentes.
Actividade resolta
18. Cando se miden as dimensións dun obxecto plano rectangular obtense: a = 40,05 ± 0,01 cm e b = 120,1 ± 0,1 cm. Determina a superficie e o erro absoluto da medida.

Tecnoloxías da información e da comunicación no traballo científico
-
As follas de cálculo