Formulación inorgánica 1 BACH
Relator: Enric Ripoll 2018
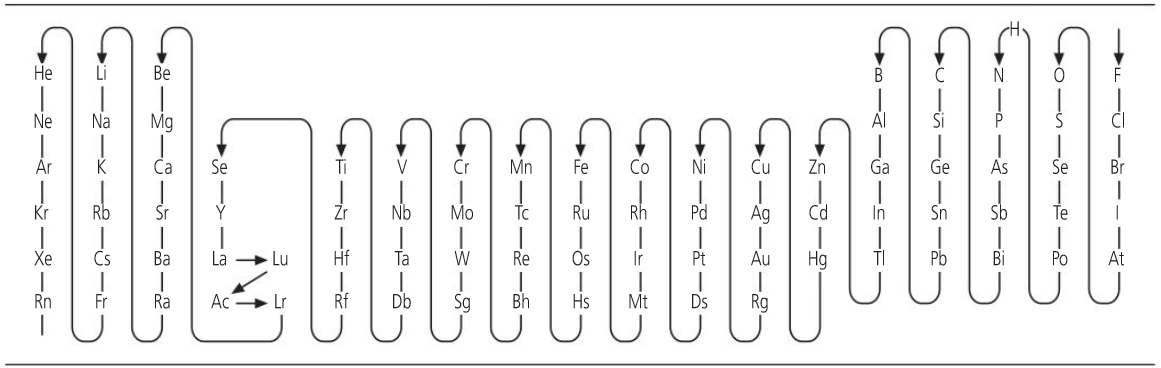
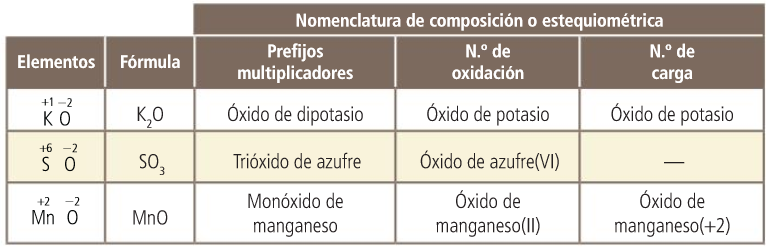
Los números de oxidación
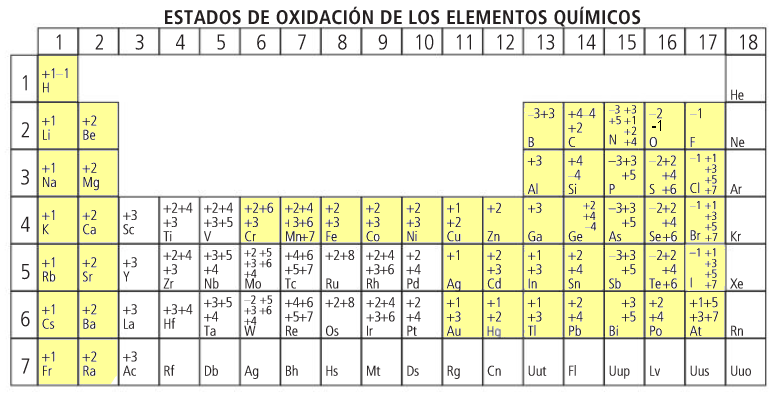
Tabla IUPAC de electronegatividades
Cómo se formula
Para formular intercambiamos los números de oxidación de los dos elementos (sin signo) colocando en primer lugar el elemento menos electronegativo
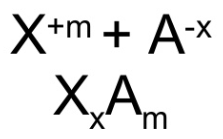
Formulación y nomenclatura de compuestos binarios
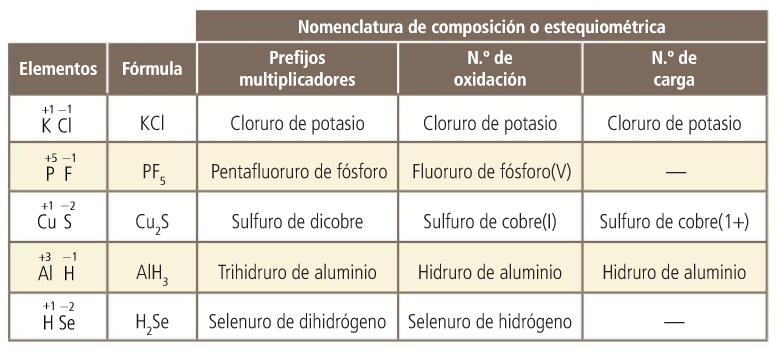
Lo que se indica a continuación es válido para compuestos que no llevan oxígeno en su composición:
- A la izquierda se escribe el nombre del elemento con número de oxidación positivo y a la derecha el negativo.
- El símbolo de cada elemento lleva el subíndice necesario para que la suma de los números de oxidación de todos los átomos sea cero.
- El nombre del compuesto comienza con el del elemento negativo terminado en -uro, le sigue la partícula de y luego el nombre del elemento positivo.
- La composición se puede indicar haciendo uso de prefijos multiplicadores o con el número de oxidación o el número de carga, si el elemento positivo puede actuar con varios.
Formulación y nomenclatura de compuestos binarios
Cómo se nombra
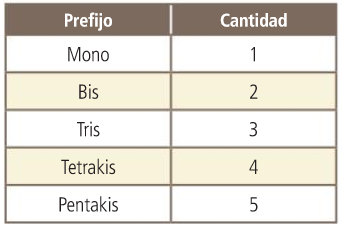
Mediante prefijos multiplicadores que indican el número de átomos de cada elemento (mono, di, tri, tetra, penta, hexa...).
Ejemplos: CO2 dióxido de carbono; CrCl3 tricloruro de cromo
El prefijo mono en segundo lugar se omite.
Ejemplo: CO, monóxido de carbono
Mediante el número de oxidación. Si uno de los elementos (el positivo) puede actuar con más de un número de oxidación, se especifica el que utiliza en este compuesto. En este caso, se escribe en números romanos y entre paréntesis, a continuación del nombre y sin dejar espacio.
Ejemplo: CO2 óxido de carbono(IV)
Si el elemento solo puede actuar con un número de oxidación, no se especifica.
Mediante la carga del ion. Solo es válido para compuestos iónicos en los que uno de los elementos puede formar varios iones.
Ejemplo: CrCl3, cloruro de cromo(3+)
Hidruros de los grupos 13,14,15
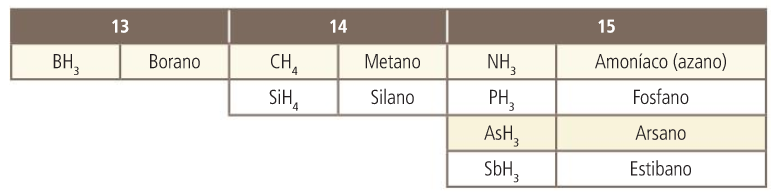
Tienen carácter básico
Hidruros de los grupos 16 y 17
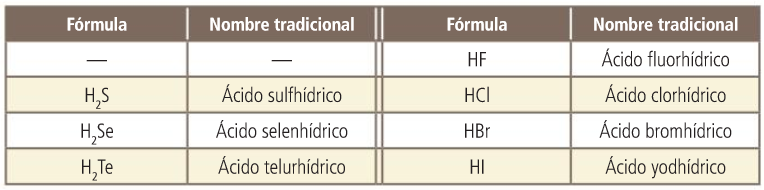
Tienen carácter ácido



Óxidos
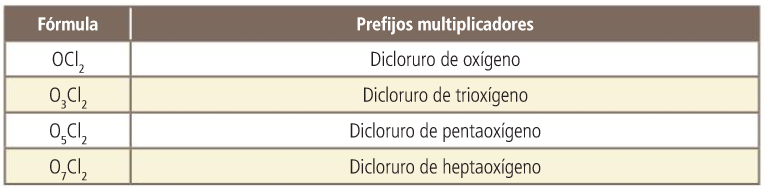
Peróxidos

Los peróxidos son el único caso en que el oxígeno actúa con número de oxidación -1.
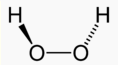
Peróxido de hidrógeno
Dioxano
Agua oxigenada
Hidróxidos

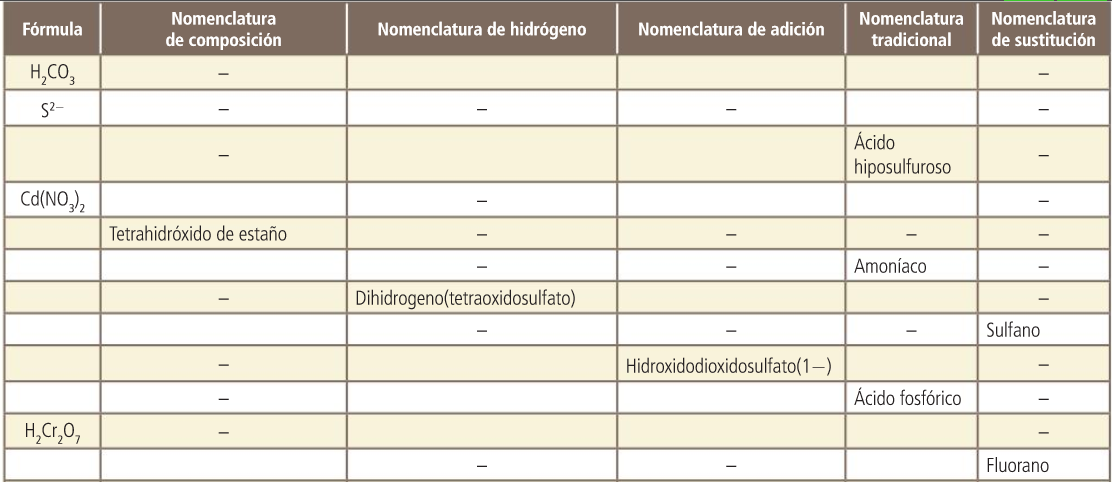
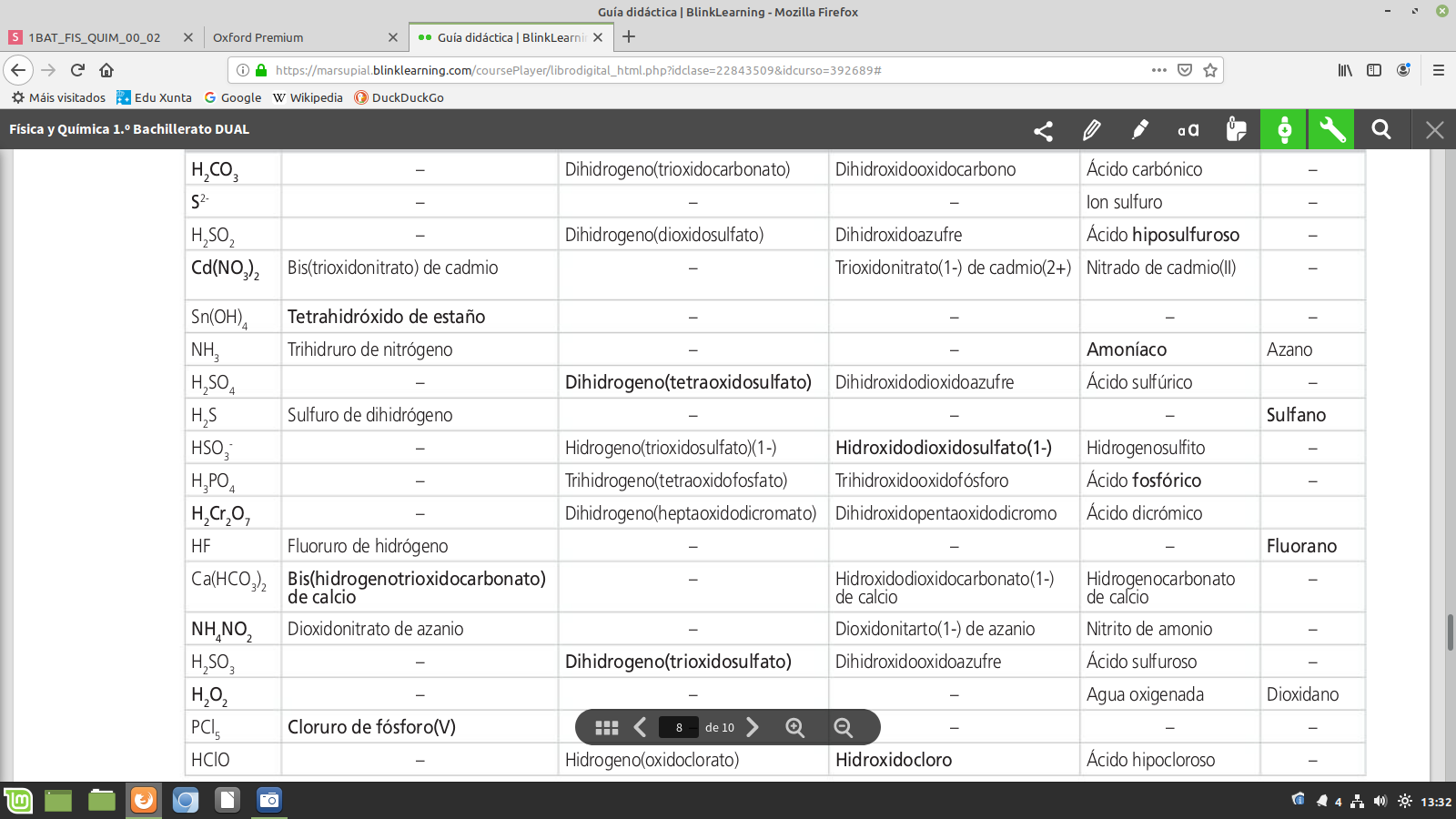
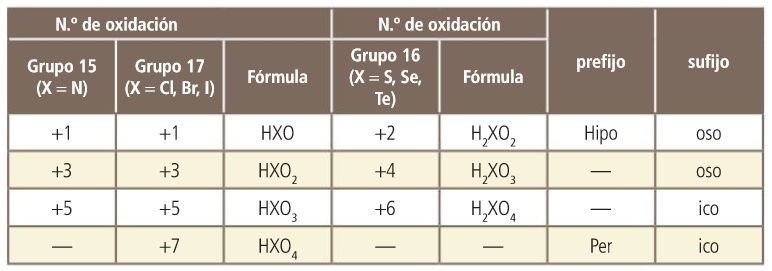
Oxoácidos. Nomenclatura de hidrógeno
Para nombrarlos, la IUPAC propone varias formas. La más adecuada a este nivel es la nomenclatura de hidrógeno que se construye sobre la fórmula.
H2 SO4 dihidrogeno(tetraoxidosulfato)
Para construir el nombre del compuesto se escribe: hidrógeno a continuación, entre paréntesis y sin dejar espacio, oxido seguido del nombre del no metal terminado en —ato. Cada una de estas palabras va precedida del prefijo de cantidad correspondiente a su subíndice en la fórmula.
Oxoácidos. Nombres tradicionales
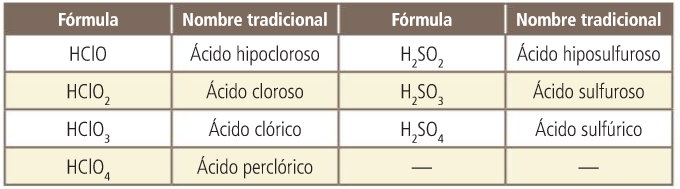
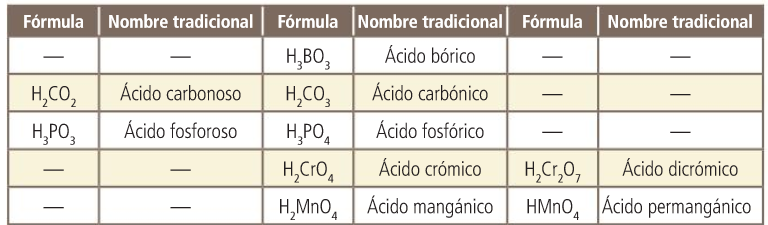
Oxoácidos. Nombres tradicionales
Sales
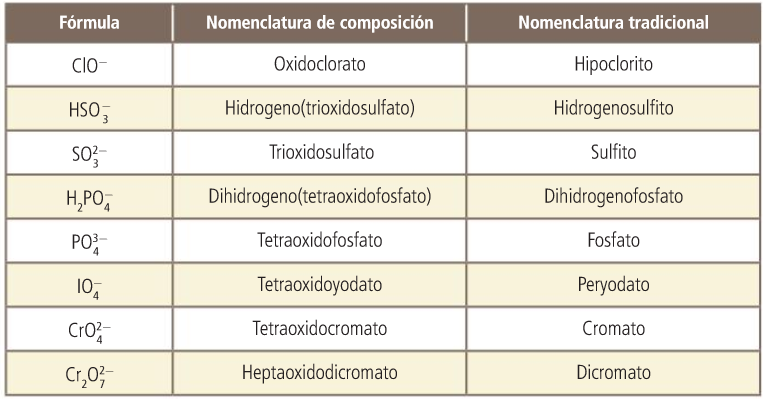
Sales. Nomenclatura de composición. Con prefijos multiplicadores.
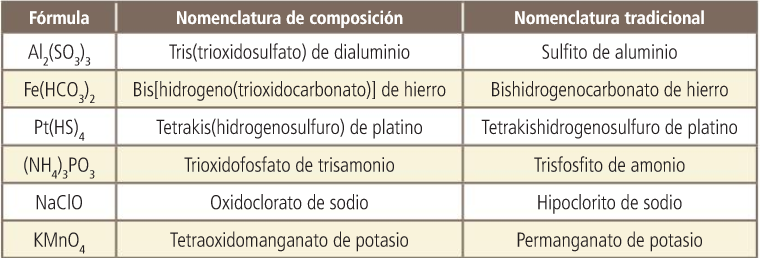
Sales. Nomenclatura de composición. Con número de carga.

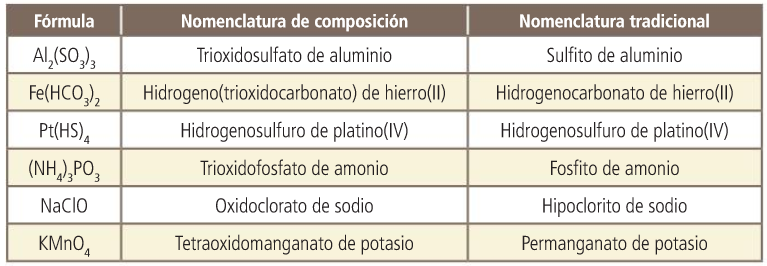
Sales. Nomenclatura de composición. Con número de oxidación
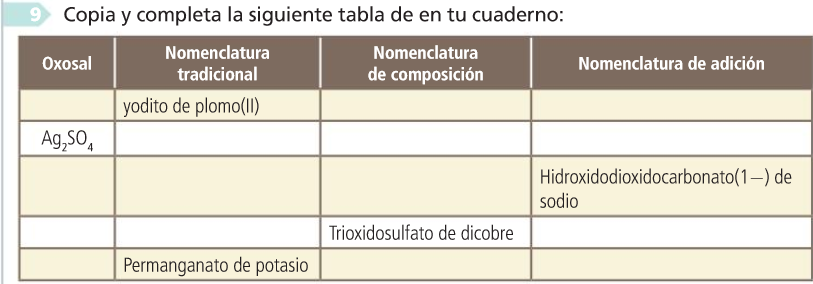
Actividades
Actividades