4 ESO. Bloque 3. Los cambios
La reacción Química
Relator: Enric Ripoll 2020
La reaccion Química
Relator: Enric Ripoll 2020
Índice
- Reactivos y productos
- Mecanismo de una reacción
- Leyes de la química
- Cálculos con ecuaciones químicas
- Reacciones químicas y energía
- Tipos de reacciones
Reactivos y productos
Actividades: 1

Mecanismo de una reacción
Teoría de las colisiones
Complejo activado
Actividades: 2, 3, 4
Teorías para explicar la cinética química

Teorías para explicar la cinética química


Teoría de las colisiones
Teoría del complejo activado
Teoría del complejo activado

Leyes fundamentales de la química
Conservación de la masa
Proporciones definidas
Actividades: 5
Ley de conservación de la masa

Ley de las proporciones definidas


Ley de las
proporciones
definidas
Leyes fundamentales de la química
Ley de Gay-Lussac
Hipótesis de Avogadro
Actividades: 6, 7, 8, 9, 10

Las hipótesis de Avogadro


Cálculos con ecuaciones químicas



67.2 L
La concentración de las disoluciones
Molaridad
Moles de soluto
Volumen en litros de disolución
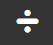
La concentración de las disoluciones
Reacciones en disolución

En primer lugar escribimos la ecuación de la reacción y la ajustamos:
Vemos que la ecuación está ajustada y nos dice que: "Cuando un mol de HCl reacciona con un mol de KOH, se produce un mol de KCl y un mol de agua". Los moles de HCl que tenemos son: n = M·V(L)
n =0.2·0.1 = 0.02 mol
Luego será necesaria la misma cantidad de KOH para reaccionar con el HCl. Por tanto:
Reacciones Químicas y energía


Velocidad de las reacciones
Factores de que depende


Velocidad de las reacciones

Catalizadores
- No se consumen en la reacción
- Pueden ser:
- Positivos
- Negativos
- La catálisis puede ser:
- Homogénea
- Heterogénea
Utilización de catalizadores en procesos industriales.
Síntesis del amoníaco: Proceso de Haber-Bosch. Usa un catalizador de hierro y óxidos metálicos
Velocidad de las reacciones

Catalizadores biológicos
¿Qué es la cinética Química?
La concentración de los reactivos

Concentración
Factores que influyen en la velocidad de las reacciones químicas.

Concentración
Temperatura
Catalizadores
Grado de división de los reactivos
Naturaleza de los reactivos
La concentración de los reactivos

Concentración
La temperatura

Grado de división de los reactivos
Naturaleza de los reactivos
Tipos de reacciones

Sintesis del amoníaco

Síntesis del ácido sulfúrico

