Powtórzenie
CHEMIA KLASA 1
Aleksandra Klank
Zuzanna Chabowska
Substancje chemiczne
Wszystko co nas otacza uczeni nazwali materią. Na przykład szpilka i gwóźdź to przedmioty które wykonano z żelaza. Zeszyt i wata to przedmioty wykonane z celulozy.
Elementy materii, które mają ten sam skład i charakterystyczne cechy, nazywamy substancjami
Piktogramy
Substancje chemiczne, które są niebezpieczne dla zdrowia i życia człowieka, muszą być odpowiednio oznaczone za pomocą piktogramów

Substancja, a ciało fizyczne
Ciałem fizycznym nazywamy rzeczy, które nas otaczają
Przykłady ciał fizycznych:



Substancja - materiał z którego jest zbudowane ciało fizyczne
Ciała fizyczne
Substancje
IGLO
WATA CUKROWA
SOPEL LODU
WODA
CUKIER
WODA
Właściwość fizyczna
- Stan skupienia
- Temperatura topnienia
- Barwa
- Rozpuszczalność w wodzie
- Gęstość
- Kowalność
- Połysk
Charakterystyczne cechy danej substancji, za pomocą których można ją opisać, nazywamy właściwościami fizycznymi
Właściwością fizyczną jest:
Podział substacji

Substancja złożona
tlenek żelaza III

Substancja prosta
jod

Substancje proste to pierwiastki chemiczne,
a substancje złożone to związki chemiczne
Pierwiastek chemiczny
Pojęcie pierwiastka chemicznego wprowadził w II połowie XVII wieku angielski uczony Robert Boyle.

Znane dziś pierwiastki występujące w przyrodzie zostały odkryte do 1925 roku. W miarę postępu nauki otrzymywano nowe pierwiastki.
Nazwy pierwiastków
- nazw państw: na przykład polon otrzymał swoją nazwę na cześć Polski, gdzie urodziła się Maria Skłodowska-Curie. To ona otrzymała ten pierwiastek jako pierwsza.
- nazw ciał niebieskich: na przykład hel ( z greckiego helios – słońce)
- imion bogów i postaci mitologicznych: na przykład niob
- nazwisk wybitnych uczonych: na przykład kiur – nazwa nadana na cześć odkryć Marii Skłodowskiej-Courie i jej męża Piotra.
- Właściwości pierwiastków: na przykład fosfor zawdzięcza swoją nazwę temu, że jedna z jego odmian świeci w ciemności ( phosphorus oznacza „niosący światło”)
Nazwy pierwiastków pochodzą m.in od:
Symbole pierwiastków
Obecnie stosowaną symbolikę wprowadził w 1815 roku Jacob Berzelius.

Symbol chemiczny pierwiastka jest umownym międzynarodowym zapisem danego pierwiastka. Tworzy się go od pierwszej litery jego nazwy łacińskiej. Jeżeli nazwy kilku pierwiastków zaczynają się na tę samą literę, to do pierwszej wielkiej litery dodaje się drugą lub dalszą małą literę. Na przykład magnez – Mg – Magnesium.
Stany skupienia substancji chemicznej
Substancje chemiczne mogą występować w stanie:
gazowym, np. para wodna
ciekłym, np. kwas siarkowy VI
stałym, np. tlenek wapnia



Przemiany chemiczne
- substancje mogą zmieniać tylko niektóre swoje właściwości fizyczne i wtedy zachodzi zjawisko fizyczne
- mogą powstawać nowe substancje chemiczne i wtedy zachodzi reakcja chemiczna
- substancje mogą się ze sobą mieszać w dowolnym stosunku masowym- powstają mieszaniny substancji
- z jąder jednych atomów mogą powstawać jądra innych atomów- są to przemiany promieniotwórcze
Substancje chemiczne mogą występować w stanie:
Wewnętrzna budowa materii
Materia
Materia – w potocznym rozumieniu ogół obiektywnie istniejących przedmiotów fizycznych poznawalnych zmysłami. W fizyce termin "materia" stosowany jest w kilku różnych, opisanych w artykule znaczeniach.

Atom i masa cząteczkowa
Atom jest to najmniejsza część pierwiastka zachowująca wszystkie jego właściwości, biorąca udział w reakcjach chemicznych
Masa cząsteczkowa danego związku chemicznego jest sumą mas poszczególnych atomów wchodzących w skład tego związku
Jednostka masy
Jednostką masy jest UNIT (u)
1 unit (u) = 1/2 masy atomu węgla, dokładnie izotopu węgla
Izotopy są to odmiany tego samego pierwiastka różniące się między sobą liczbą neutronów w jądrze atomowym, więc różnią się liczbą masową
Podział iotopów
- naturalne to takie które występują w przyrodzie
- sztuczne to izotopy otrzymywane przez człowieka
ZE WZGLĘDU NA POCHODZENIE:
- trwałe to takie ,których jądra nie ulegają przemianom jądrowym
- promieniotwórcze to izotopy których jądra ulegają przemianom jądrowym
ZE WZGLĘDU NA TRWAŁOŚĆ IZOTOPÓW:
Budowa atomu
Atomy każdego pierwiastka zbudowane są z jądra ,które znajduje się w środku atomu .Jądro otoczone jest chmura elektronów .
W skład jądra atomowego wchodzą cząstki elementarne :protony i neutrony .Atom ,którego jądro ma określona liczbę protonów i neuronów ,nazywamy nuklidem .W różnych odległościach od jądra atomowego poruszają się elektrony ,które tworzą tzw. Powłoki elektronowe .
Znając liczbę atomowa i masowa ,możemy określić liczbę protonów ,neutronów i elektronów w atomie pierwiastka Liczbę atomowa wpisujemy po lewej stronie u dołu symbolu pierwiastka ,natomiast u góry symbolu pierwiastku umieszczamy liczbę masowa .
W atomie elektrony znajdujące się na ostatniej powłoce ,czyli elektrony najbardziej oddalone od jądra atomowego ,to elektrony walencyjne ,decydujące w właściwościach pierwiastków
Wiązania chemiczne
są to charakterystyczne oddziaływania występujące pomiędzy atomami, grupami atomów, jonami lub cząsteczkami. Wiązania chemicznepowstają w wyniku oddziaływania, przyjmowania lub uwspólniania elektronów walencyjnych reagujących ze sobą atomów.
Wiązanie kowalencyjne niespolaryzowanr występuje tylko pomiedzy atomami tego samego pierwiastka (np. H -H )
wiązanie kowalencyjne spolaryzowane występuje pomiędzy cząsteczkami dwóch ròżnych atomòw ( np. Cl - H )
Oba te wiązania występują tylko pomiędzy niemetalami
Wiązanie jonowe (wiązanie elektrowalencyjne, wiązanie heteropolarne, wiązanie biegunowe) – rodzaj wiązania chemicznego, którego istotą jest elektrostatyczne oddziaływanie między jonami o różnoimiennych ładunkach. Wiązanie to powstaje najczęściej między metalem a niemetalem.

Mieszanina, a związek chemiczny
PODZIAŁ MIESZANIN:
-Niejednorodne to takie w których można za pomocą wzroku lub przy użyciu prostych przyrządów np lupy rozróżnić składniki
-Jednorodne to mieszaniny w których nie są widoczne poszczególne zmieszane ze sobą składniki Np: woda z solą
Sposoby rozdziału mieszanin
Sączenie (filtracja)- polega na przelewaniu mieszaniny cieczy z ciałem stałym przez sączek z bibuły umieszczony w lejku. W oczyszczalniach ścieków i przemyśle stosuje się w tym celu filtry. na sączku (filtrze) pozostaje ciało stałe, a ciecz klarowna (przezroczysta) spływa do zlewki (zbiornika).

Sedymentacja- jest to opadanie na dno naczynia cząsteczek ciała stałego w cieczy pod wpływem siły ciężkości (np. w wypadku wody z kredą).
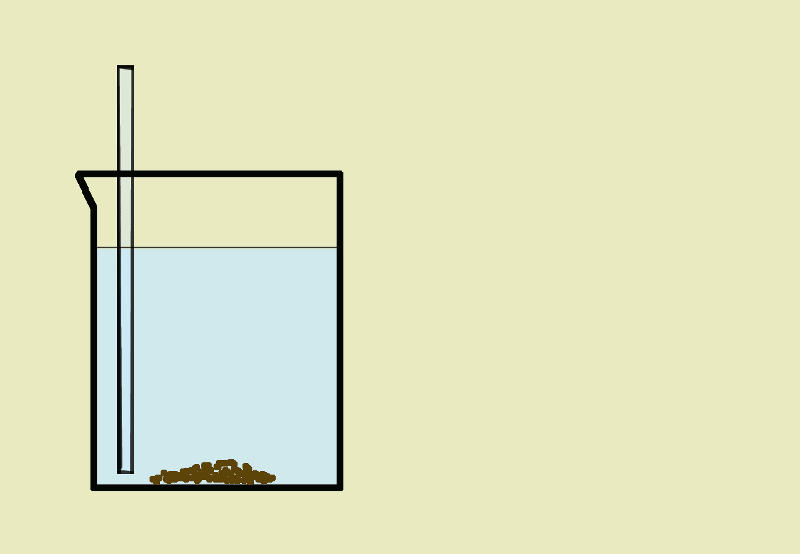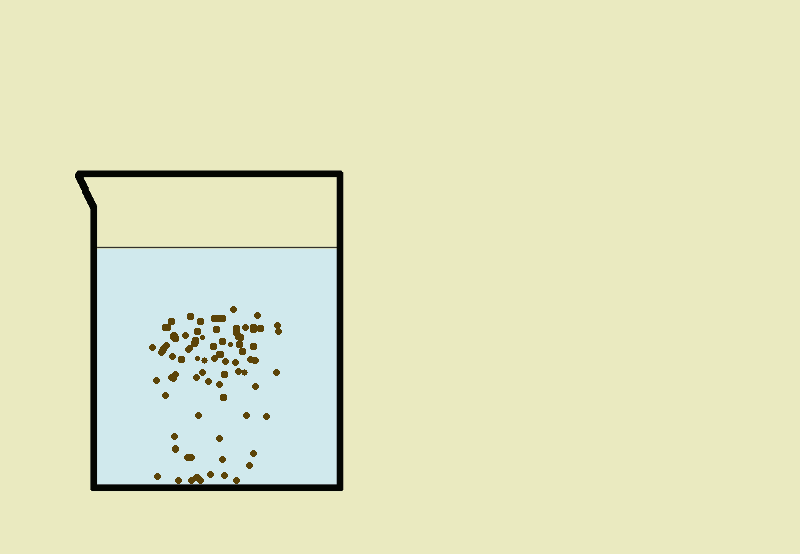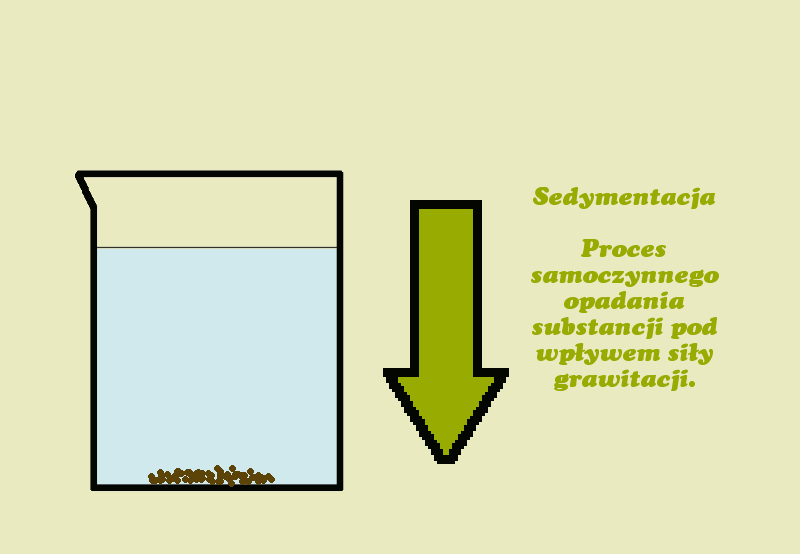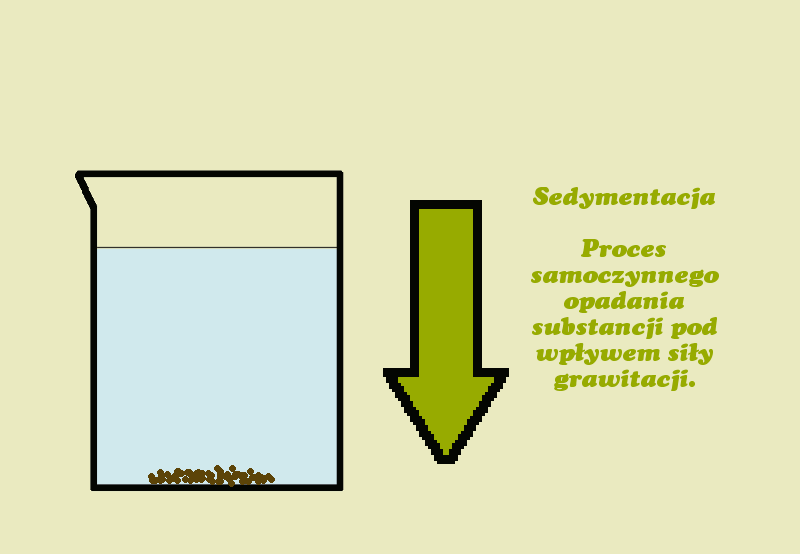
Dekantacja- polega na oddzieleniu ciała stałego od cieczy przez zlanie klarownej cieczy znad osadu.

Krystalizacja- polega na wydzielaniu się z roztworu substancji w postaci kryształków wskutek np. odparowania wody (rozpuszczalnika).

Destylacja- polega na rozdzieleniu składników mieszaniny ciekłej jednorodnej. wykorzystuje się tu różnice temperatur cieczy. ciekłą mieszaninę jednorodną umieszcza się w kolbie destylacyjnej podłączonej do chłodnicy. mieszaninę ogrzewa się, kontrolując na termometrze jej temperaturę. składniki mieszaniny kolejno - w miarę wzrostu temperatury - zostają odparowane, a ich pary skraplają się w chłodnicy i ściekają do podstawionego naczynia.

Związek chemiczny i reakcja chemiczna
Związek chemiczny – jednorodne połączenie co najmniej dwóch różnych pierwiastków chemicznych za pomocą dowolnego wiązania. Podstawową jednostką związku chemicznego jest cząsteczka. Cząsteczki powstają i rozpadają się w wyniku tworzenia i zrywania wiązań chemicznych między atomami.
Reakcja chemiczna – każdy proces, w wyniku którego pierwotna substancja zwana substratem przemienia się w inną substancję zwaną produktem.
Prawo zachowania masy
Prawo zachowania masy – prawo przyrody opisujące zachowanie(pozostawanie stałą) wielkości fizycznej – masy w układzie zamkniętym i układzie izolowanym podczas przemian i oddziaływań fizycznych oraz reakcji chemicznych.
Typy reakcji chemicznych
Reakcja syntezy -w wyniku których z kilku substratów powstaje tylko jeden produkt np 2 Mg+O2----->2MgO
Reakcja analizy - są to relacje podczas których z jednego substratu otrzymujemy kilka produktów np H2+Cl2---->2HCl
Relacja wymiany -są to reakcje chemiczne podczas których z kilku substratów powstaje kilka produktów Np. CuO+H2---->Cu+H2O
Roztwory wodne
Woda w przyrodzie
- Stałym
- Ciekłym
- Gazowym
Woda w przyrodzie występuje w 3 stanach skupienia:

Właściowści wody
- przezroczysta
- bez kształtu
- bezwonna
- bez smaku
- substancja jednorodna
- ma określoną gęstość i ciężar
- jest dobrym rozpuszczlnikiem
- paruje w każdej temperaturze
- zamarzanie wody oraz topnienie lodu zachodzi w 0 stopniach Celsjusza
- jest dobrym przewodnikiem prądu elektrycznego
Zastosowanie wody
- można ją stosować do rozpuszczania, ponieważ woda jest dobrym rozpuszczalnikiem
Roztwór - jednorodna mieszanina dwóch substancji lub więcej związków chemicznych
Podział roztworów
- gazowe, np. powietrze
- ciekłe, np. ocet
- stałe, np. szkło
Ze względu na stan skupienia:
Ze względu na zawartość substancji rozpuszczonej w roztworze:
- nasycone
- nienasycone
- przesycone
Roztowry
- Roztwór nasycony
to roztwór o stężeniu odpowiadającym rozpuszczalności danego składnika, czyli roztwór zawierający maksymalną ilość substancji rozpuszczonej.
2. Roztwór nienasycony
to taki, w którym jest mniej rozpuszczonej substancji niż to wynika z rozpuszczalności.
3. Roztwór przesycony
to roztwór o stężeniu większym od stężenia roztworu nasyconego w danej temperaturze.
Stężenie procentowe roztoru
jest to liczba gramów substancji zawarta w 100g roztworu, wyrażona w %
Obliczamy to ze wzoru:
Cp=(ms/mr)*100%
Stężenie molowe roztworu wyraża liczbę moli w substancji rozpuszczonej w 1 dm^3 roztworu
WZÓR:
Cm= n/Vr= (ms*dr)/(M*mr)