Opetus.tv PRO
Opetus.tv
Atomien välille voi muodostua
epämetalli + epämetalli
yleensä epämetalli + metalli
metalli + metalli
elektronit yhteiskäytössä
positiivinen ioni luovuttaa elektronin negatiiviselle ionille
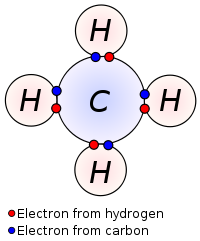
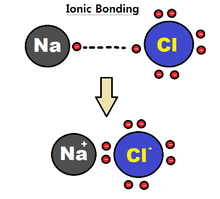
Jokaisella alkuaineella on oma elektronegatiivisuusarvonsa, joka kertoo alkuaineen kyvystä vetää elektroneja puoleensa.
Sidoksen poolisuus määräytyy sen perusteella, kuinka suuri sidokseen osallistuvien atomien elektronegatiivisuusero on.
Jos atomien välinen elektronegatiivisuusero on 0, sidos on pooliton.
Jos 0 < elektronegatiivisuusero 0,4, niin sidos on heikosti poolinen.
Jos 0,4 < elektronegatiivisuusero 1,7, niin sidos on poolinen.
Jos 1,7 < elektronegatiivisuusero, niin sidos on ionisidos.
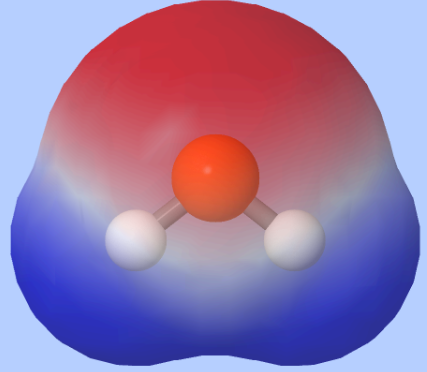
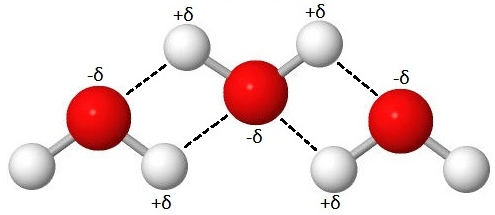
Molekyyli on poolinen, jos
molekyylin sidokset ovat poolisia ja molekyylin muoto ei kumoa poolisuutta
Molekyyli on pooliton, jos
1) sidokset ovat poolittomia
tai
2) sidokset ovat poolisia, mutta
molekyylin muoto kumoaa poolisuuden
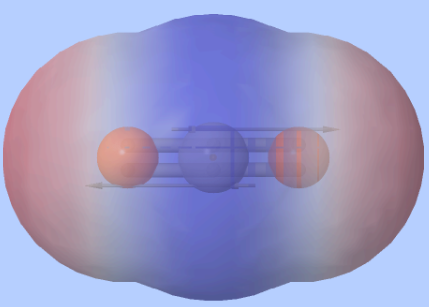

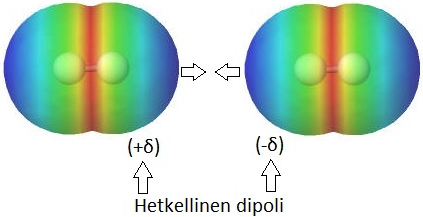
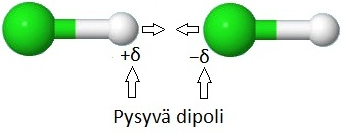
pysyvä dipoli eli elektronitihentymä
negatiivinen osittaisvaraus
positiivinen osittaisvaraus
By Opetus.tv