UAEH, sistema de Universidad Virtual
Sistema de Universidad Virtual de la Universidad Autónoma del Estado de Hidalgo.

Idea Original:
Lic. Biolg.Exp. Ma. Cristina Armijo Barragán
Colaborador
MBA R.Adriana Monroy Resendiz
Agosto, 2014
www.uaeh.edu.mx/virtual
¿Qué es in Isómero?
Son compuestos diferentes con la misma fórmula molecular
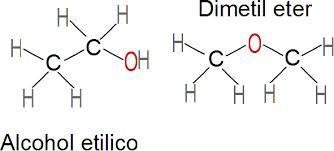
¿En qué consiste la Isomería?
El fenómeno de la Isomería en la Química es semejante al fenómeno de palabras diferentes por pemutación de letras:
Amor y Roma
Ave y Eva
Así e Isa
Zorra y Arroz
Sabes y Sebas
Adula y Aluda
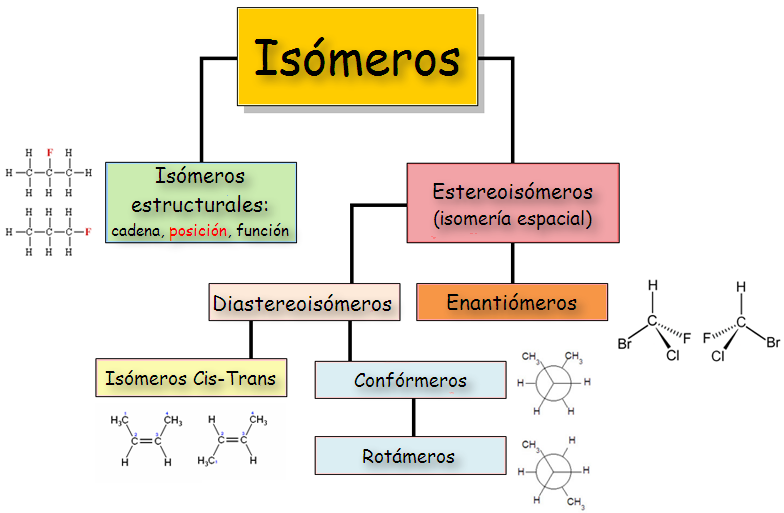
Tipos de Isomerías
Estructural o
Constitucional
Mismos Átomos pero con distinta conectividad (difieren en el orden en el que se entrelazan los átomos en la molécula
Cadena
Posición
Función
Espacial o
Estereoisometría
Conformacional: (se interconvierten mediante rotaciones sobre enlaces sencillos)
Configuracional: Distinta configuración, no son interconvertibles
Diastereometría
Cis
Trans
Enantiometría
D- L
R- S
La Isomeria Constitucional o Estructural
Las moléculas con la misma fórmula tienen una diferente distribución en los enlaces entre sus átomos
Cadena
Posición
Función
Tienen componentes de la cadena acomodados en diferentes lugares
Los grupos funcionales están unidos en diferentes posiciones
Pueden general diferentes grupos funcionales en la cadena
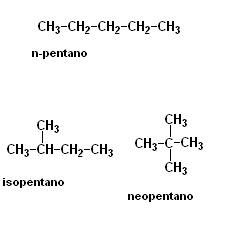
Isomería de Cadena
En estos ejemplos las cadenas están acomodados en diferentes lugares
Recuerda: "Los Isómeros tienen cadenas carbónicas diferentes, osea la disposición de los átomos en la cadena suele ser diferente"
Isomería de Posición
Observa la estructura del Pentanol
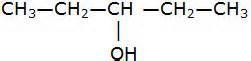
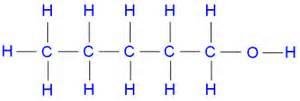
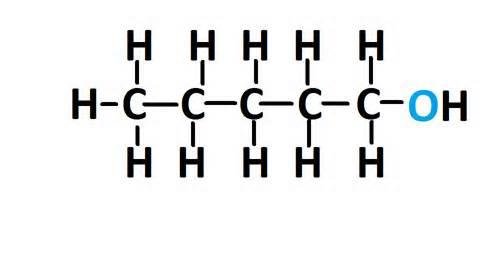
Observa ahora el grupo funcional
¿Notas la diferencia?
Mientras que en el primero el grupo funcional está colocado en el carbono 1, en el segundo ejemplo está colocado en el carbono 3
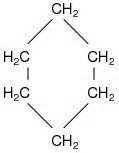
Isomería del Grupo Funcional
Un ejemplo es el ciclohexano y el 1-hexano, que tienen la misma fórmula molecular (C6H12), pero el ciclohexano es un alcano cíclico y cicloalcano y el 1- hexano es un alqueno
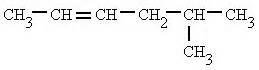
Isomería Espacial
Son aquellos compuestos que tienen formas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de cadena, los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta, o sea, difieren en la posición espacial de sus átomos)
Conformacional
Configuracional
Enantriometría
Diastereometría
Se divide en:
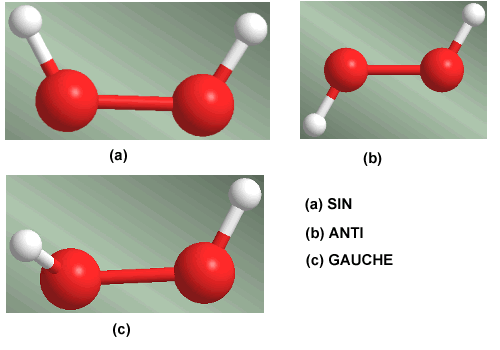
Isometría Conformacional
Se caracterizan por poder interconvertirse (modificar su orientación espacial, convirtiéndose en otro isómero de la misma molécula) a termperatura ambiente, por rotación en torno a enlaces simples, anti, eclipsada o alternada.
Son compuestos que, generalmente no pueden aislarse físicamente, debido a su facilidad de interconversión
Isometría Configuracional
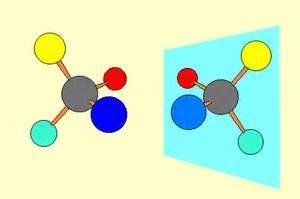
Enantiometría:
Un complejo quiral es aquel cuya geometría no es superponible con la de su imagen especular. Dos complejos quirales, cada uno es la imagen especular del otro, se conocen como isómeros ópticos.
Los dos isómeros ópticos forman un par de enantiómeros.
Los isómeros ópticos se denominan así porque son ópticamente activos, es decir, un enantiómero gira el pleno de la luz polarizada en una dirección y el otro rota dicho plano el mismo ángulo pero en dirección contraria
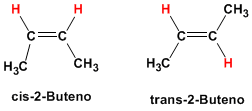
Diastereometría:
Son una clase de estereoisómetros tales que no son superponibles pero tampoco imagen especular uno del otro, es decir no son enantiómetros. Los diastereosímeros diferen en sus propiedades físicas y químicas.
Dentro del grupo de los diasterómeros se encuentran los isómeros cis-trans (antes conocidos como isómeros geométricos) los confórmeros o isómeros, y en las moléculas con varios centros quirales, los isómeros que pertenecen a distintas parejas de enantiómeros.
Para resumir:
Una vez analizado los Isómeros, cómo pregunda final a esta presentación responde:
¿Cuál es la importancia biológica de cómo están distribuidos los carbonos en el espacio?
Para responder a esta pregunta siguiero que visites la página:
http://www.maph49.gaelon.com/biomol1/isomers.html
Referencias Bibliográficas
Martínez, J. (2002). Física y Química 1°Bachillerato, México., Ed. Santillana pp120-150)
By UAEH, sistema de Universidad Virtual
Sistema de Universidad Virtual de la Universidad Autónoma del Estado de Hidalgo.