Gli Enzimi
Definzione
Gli enzimi sono delle macromolecole biologiche costituite da proteine semplici e coniugate in grado di catalizzare reazioni chimiche.
Composizione degli enzimi
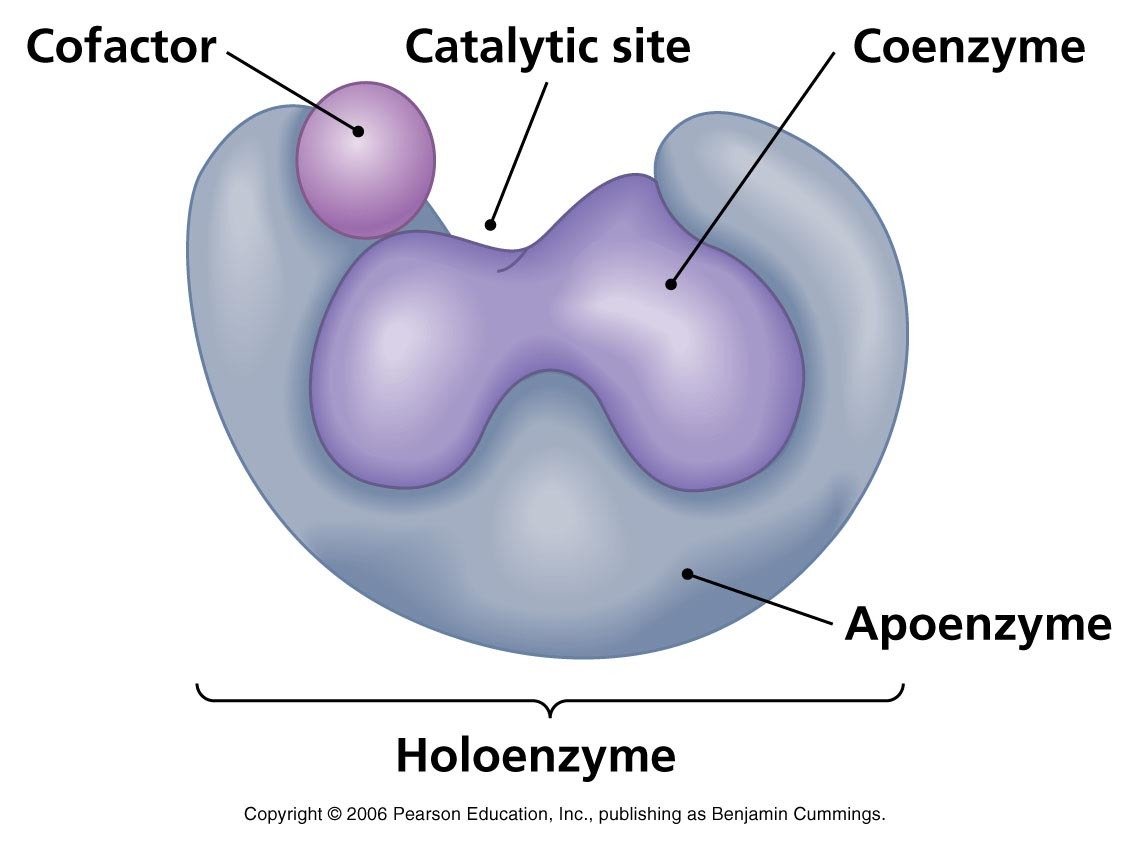
In alcune situazioni gli enzimi sono costituiti da una componente proteica definita apoenzima e una componente non proteica chiamata cofattore o coenzima o gruppo prostetico.
Il complesso formato da apoenzima e coenzima viene definito oloenzima.
Cofattori
I cofattori possono essere di origine:
- inorganica (K+,Mg+2,Fe2+)
- organica (NAD, NADP, FAD, CoA)
Si uniscono alla componente proteica mediante legami covalenti o di coordinazione.
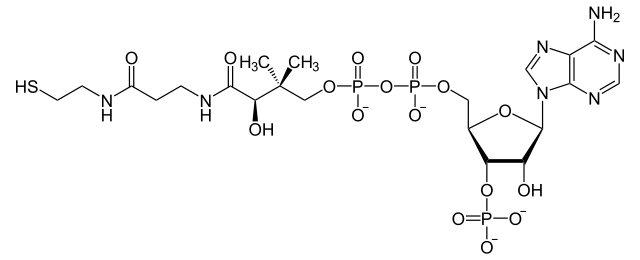
Coenzima A
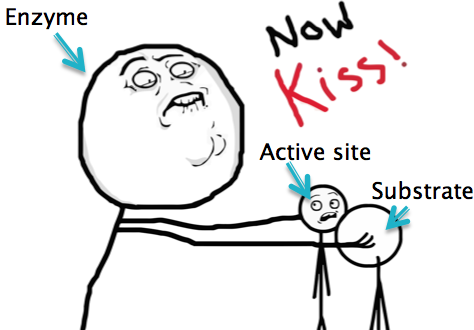
Il sito attivo
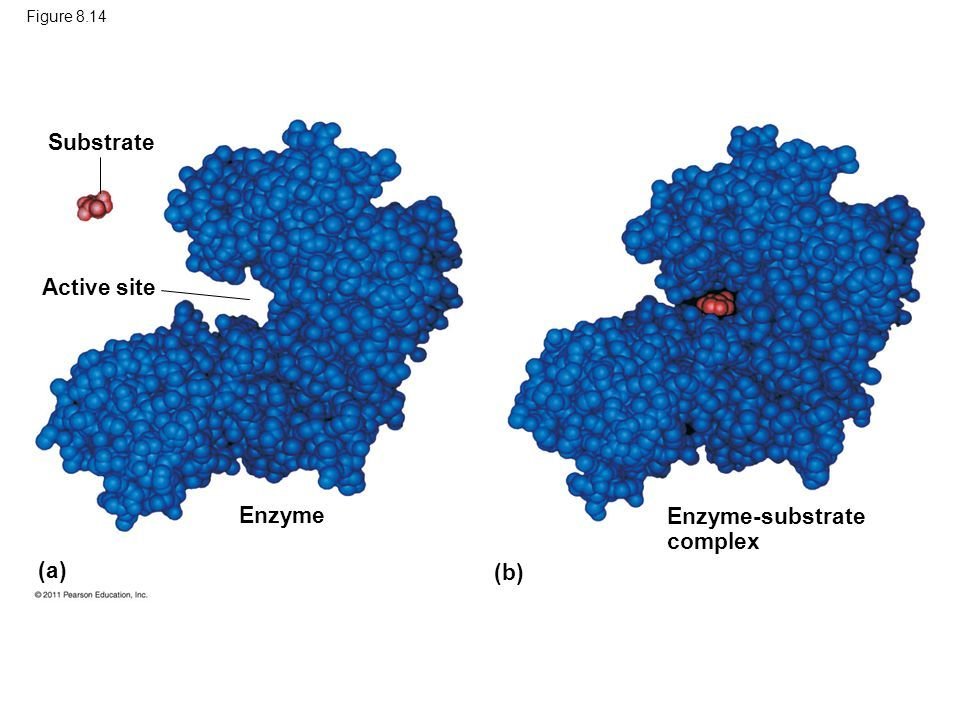
È la porzione di molecola enzimatica che si occupa di interagire con il substrato.
È costituito da una piccola superficie di enzima chiamata "tasca", contenente residui amminoacidici che conferiscono carica, idrofobicità e altre caratteristiche che responsabili della stereospecificità
Siti allosterici
Possiedono la capacità di inibire o attivare l'enzima.
Un composto che si lega al sito allosterico provoca un riarrangiamento dei domini che costituiscono l'enzima modificando la struttura terziaria.
I composti che regolano allostericamente l'attività enzimatica sono detti modulatori
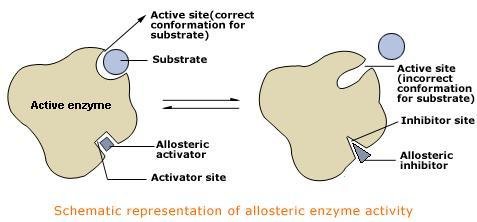
Gli inibitori enzimatici
Instaurano legami chimici con l'enzima diminuendone l'attività, possono essere:
- Reversibili
- Irreversibili
Inibitorire reversibili
competitivo
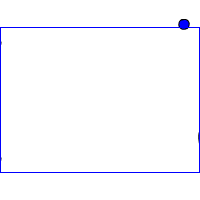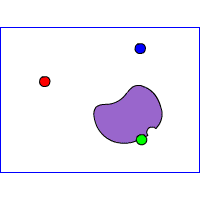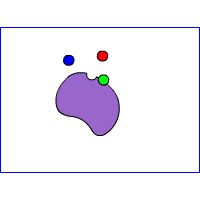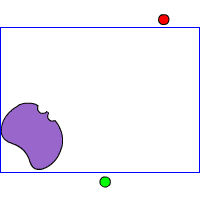
non competitivo
incompetitivo
Il loro ruolo
Cosa fanno?
Le 5 caratteristiche degli enzimi
- aumentano la velocità delle reazioni
- non alterano l'equilibrio l'equilibrio delle reazioni
- sono inalterati alla fine delle reazioni
- agiscono a piccole concentrazioni
- sono altamente specifici
Specificità assoluta: glucochinasi
Specificità relativa: esochinasi
Il modello chiave-serratura e il modello dell'adattamento indotto
Attraverso il modello chiave-serratura Fischer ipotizza che l'enzima possiede un sito attivo con forma complementare al substrato che permette un incastro perfetto.
Tale modello ha il limite di non spiegare in particolare il meccanismo di conversione S→P
Koshland invece a differenze del modello di Fischer immagina un sito attivo in grado di rimodellarsi in presenza o meno substrato.
Cinetica enzimatica

Cosa influenza la cinetica enzimatica?
- concentrazione del substrato
- concentrazione del enzima
- concentrazione dei cofattori
- temperatura
- pH
- presenza di sostanze inibitrici
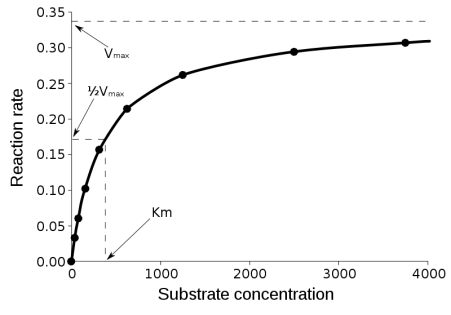
Equazione di Michaelis-Menten
Temperatura e pH
L'aumento della temperatura di 10° corrisponde all'aumento del 10% della velocità enzimatica.
Per ogni enzima esiste un valore e un valore
Sopra il valore massimo avviene la denaturazione dell'enzima
Sotto il valore minimo l'enzima si inattiva.
Ogni enzima possiede un pH ottimale, allontanandosi da questo valore si riduce l'efficienza enzimatica

Classificazione
- Nome corrente es. lattato deidrogenasi
- Nome sistematico es. L-lattato, NAD ossidoreduttasi
- Numero di classificazione EC es. 2.7.1.9
- ossidoreduttasi (comportano l'ossidoriduzione)
- transfeasi (trasferiscono gruppi funzionali
- idrolasi (reazioni di idrolisi)
- liasi (addizione di gruppi a doppi legami)
- isomerasi (catalizzano reazioni di isomerizzazione)
- lagasi (permettono formazione legami)
Regolazione attività enzimatica
- modificazione della produzione enzimatica
- modificazioni post traduzionali
- compartimentazione delle vie metaboliche
- presenza di siti allosterici
Gli Enzimi
By Cristiano Colpo
Gli Enzimi
- 1,059
