
Grupo : Ana Diany, Luan, William.
Professor :
Alexandre Salvador


Ácidos carboxílicos
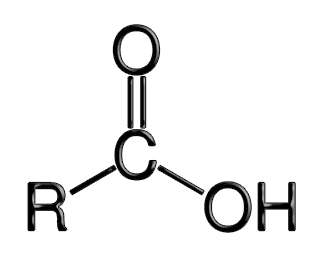
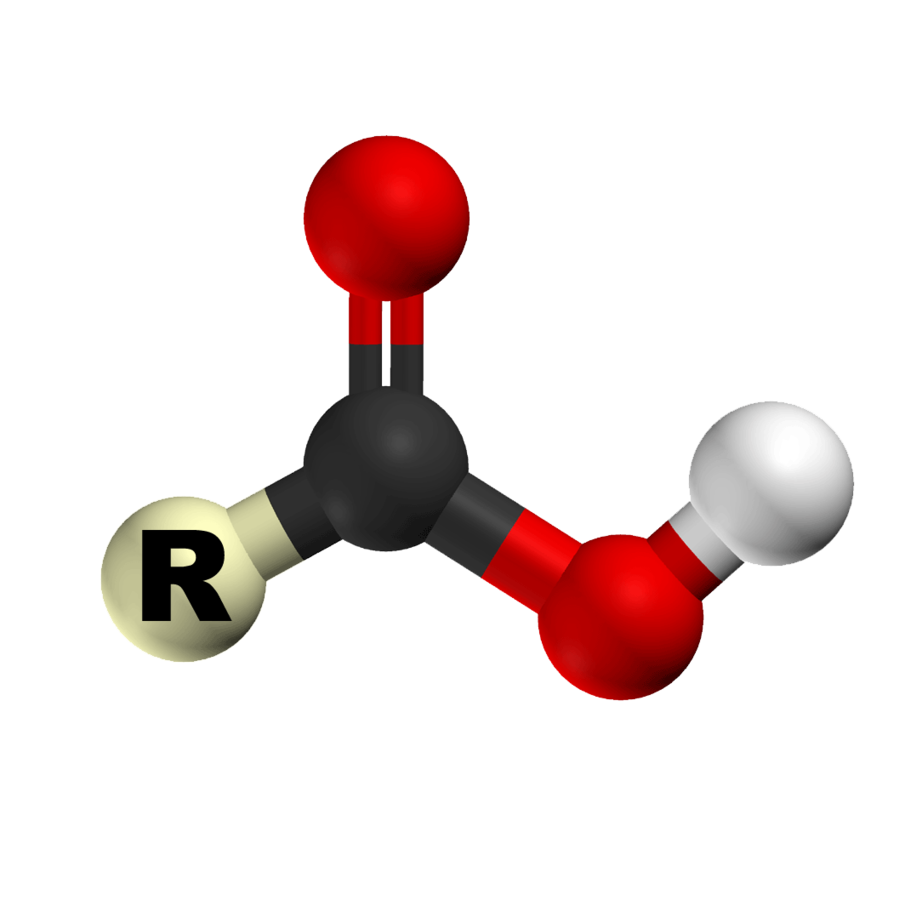
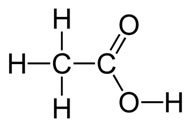
Os ácidos carboxílicos são caracterizados pelo grupo carboxila (carbonila + hidroxila),(-COOH), ligado à um carbono da cadeia principal.
A fórmula estrutural plana da carboxila é:

Esses compostos são ácidos fracos, mesmo assim são os compostos orgânicos mais ácidos.
Quando têm mais de 10 carbonos, são conhecidos como ácidos graxos.
No ser humano, esses ácidos estão presentes no suor, o que faz com que alguns animais reconheçam seus donos apenas pelo cheiro que exalam.






Nomenclatura oficial e usual
A nomenclatura oficial é bem parecida com a dos hidrocarbonetos, apenas trocando a terminação para -óico e adicionando a palavra ácido na frente do nome.
A numeração é feita começando pelo carbono da carboxila.
Exemplo: Ácido etanóico.

A função orgânica dos ácidos carboxílicos é uma das mais importantes, visto estar presente na maior parte das moléculas contendo funções mistas.
No que tange aos ácidos carboxílicos presentes em nosso cotidiano, talvez cinco deles mereçam um destaque especial, os quais serão abordados neste texto.
Principais Ácidos Carboxílicos

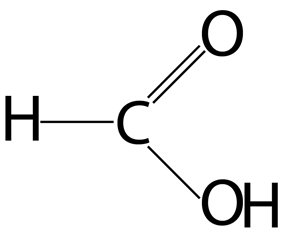
O ácido metanóico é um líquido incolor, corrosivo, de odor característico.
Foi obtido pela destilação seca de formigas, daí a razão de seu nome alternativo (fórmico).
É fabricado a partir do monóxido de carbono.
As principais aplicações do ácido metanóico são como mordente em tinturaria, na fabricação de ácido oxálico; na medicina, no tratamento de reumatismo.
O ácido metanóico, por apresentar o grupo funcional aldeído na molécula, oxida-se facilmente, produzindo gás carbônico e água.
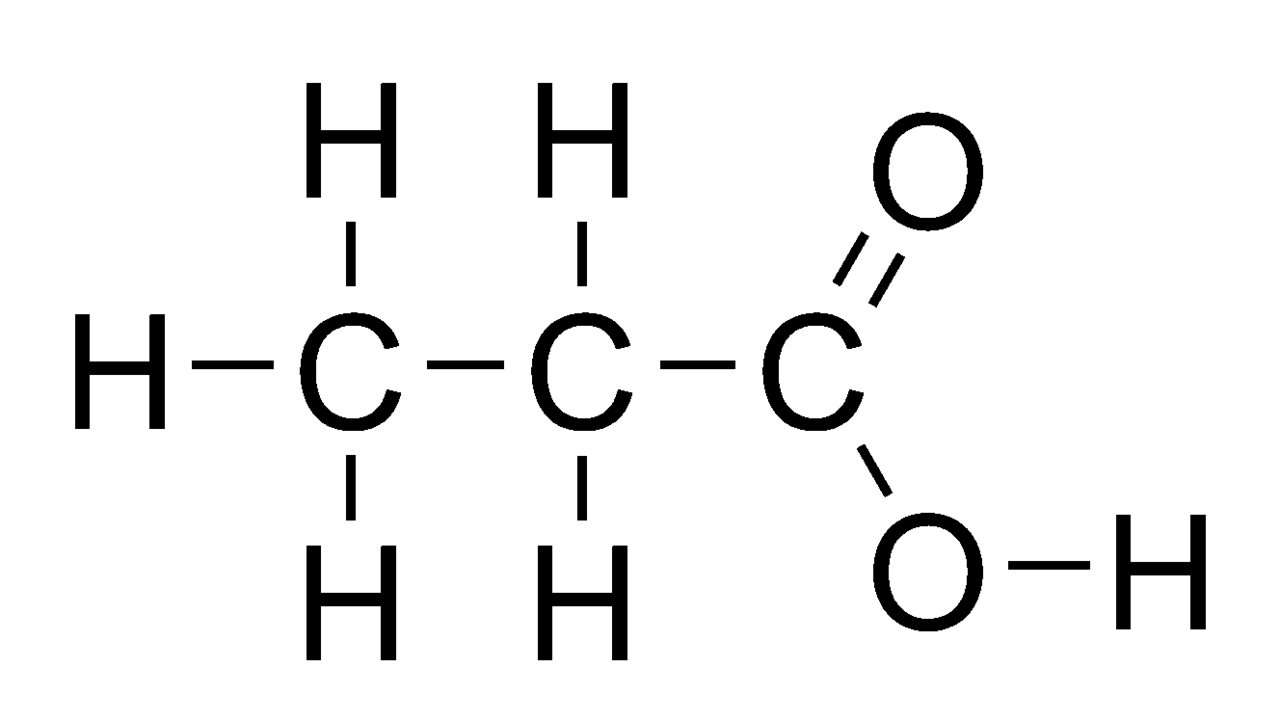
O ácido etanóico, também chamado de ácido acético, é um líquido incolor, de odor e sabor característico; é corrosivo, solúvel na água.
Os processos industriais de obtenção deste ácido são a partir do etanol, a partir do carvão e da destilação seca da madeira.
Além de ser usado na alimentação sob a forma de vinagre, é empregado na obtenção de diversas substâncias orgânicas, como, por exemplo, acetatos de metais, ésteres, anidrido etanóico, cloreto de etanoíla e propanona.







O ácido etanodióico, também chamado de ácido oxálico, apresenta-se no estado cristalino com duas moléculas de água.
É fabricado a partir do etanoato de sódio que, por sua vez, é fabricado a partir do CO e NaOH.
É usado como branqueador de couros e fibras vegetais, como mordente para remover manchas de ferrugem da roupa branca.
O ácido 2-hidróxipropano-tricarboxílico é mais conhecido pelo seu nome vulgar, ácido cítrico.
Encontra-se na natureza no suco de frutos ácidos, principalmente nos cítricos (o limão chega a ter 7%).
O ácido 2-hidróxibenzeno carboxílico é também conhecido como ácido salicílico e como ácido orto-hidroxibenzóico.
Este e seus derivados constituem importantes compostos medicinais.
É usado como anti-séptico e na eliminação de calos; internamente é usado como analgésico, antipirético e antirreumático.
Entretanto, nas aplicações internas, não se pode ingeri-lo diretamente porque provoca dores e vômitos.
Daí o emprego de seus derivados, como, por exemplo, o ácido acetilsalisílico (aspirina).










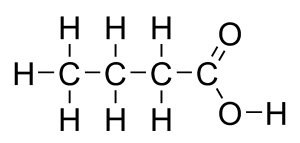

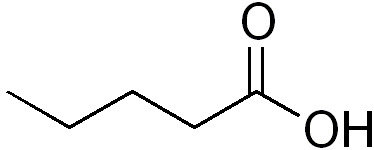
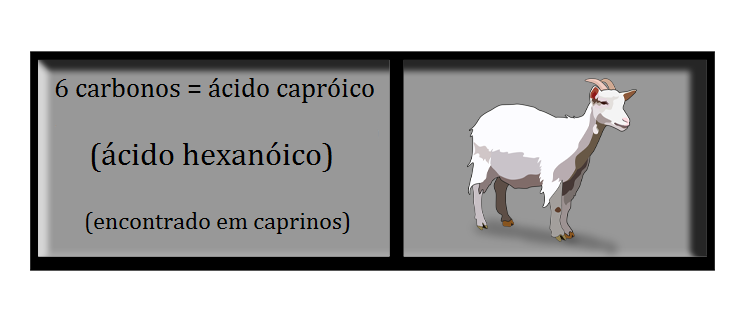
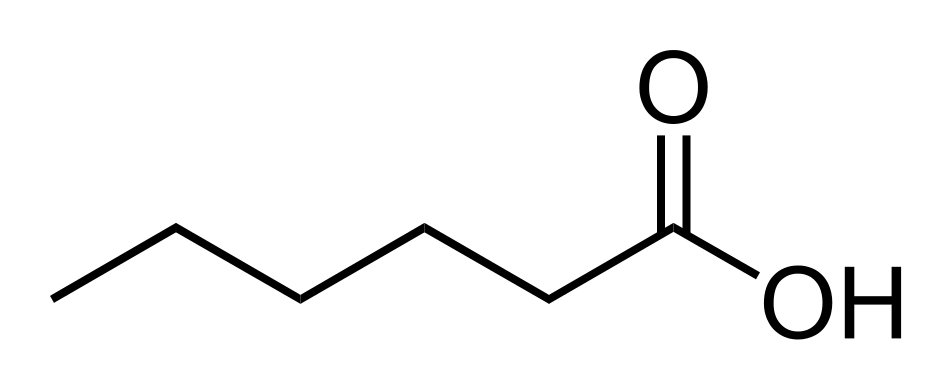

Sua nomenclatura oficial segue as seguintes regras:
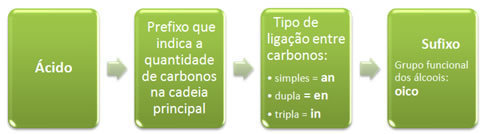
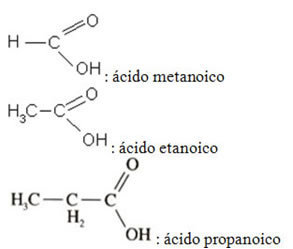
Veja alguns exemplos simples:

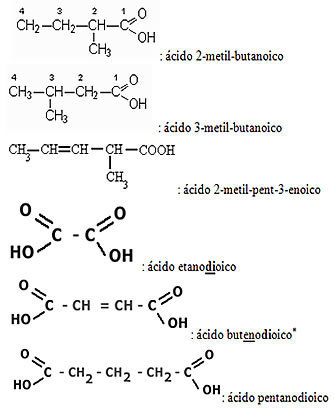
Visto que o carbono só pode fazer quatro ligações, o grupo carboxila sempre aparecerá no início ou no final da molécula.
Portanto, não é necessário numerar a posição do grupo funcional.
Já as insaturações e as ramificações precisam ser sempre numeradas.
Lembre-se de dois pontos importantes ao numerar uma cadeia:
- A numeração sempre deve começar a partir da extremidade mais próxima do grupo funcional;
- As ramificações são colocadas em ordem alfabética.
Além disso, se houver mais de um grupo carboxila, isso é indicado pelos sufixos: di, tri, tetra, etc.
Aplicando esses pontos, temos:

Éteres
Éteres são compostos orgânicos que apresentam o grupo funcional - O- (oxigênio) entre dois radicais (carbonos), ou seja, os éteres são compostos orgânicos que possuem o elemento oxigênio entre dois carbonos.
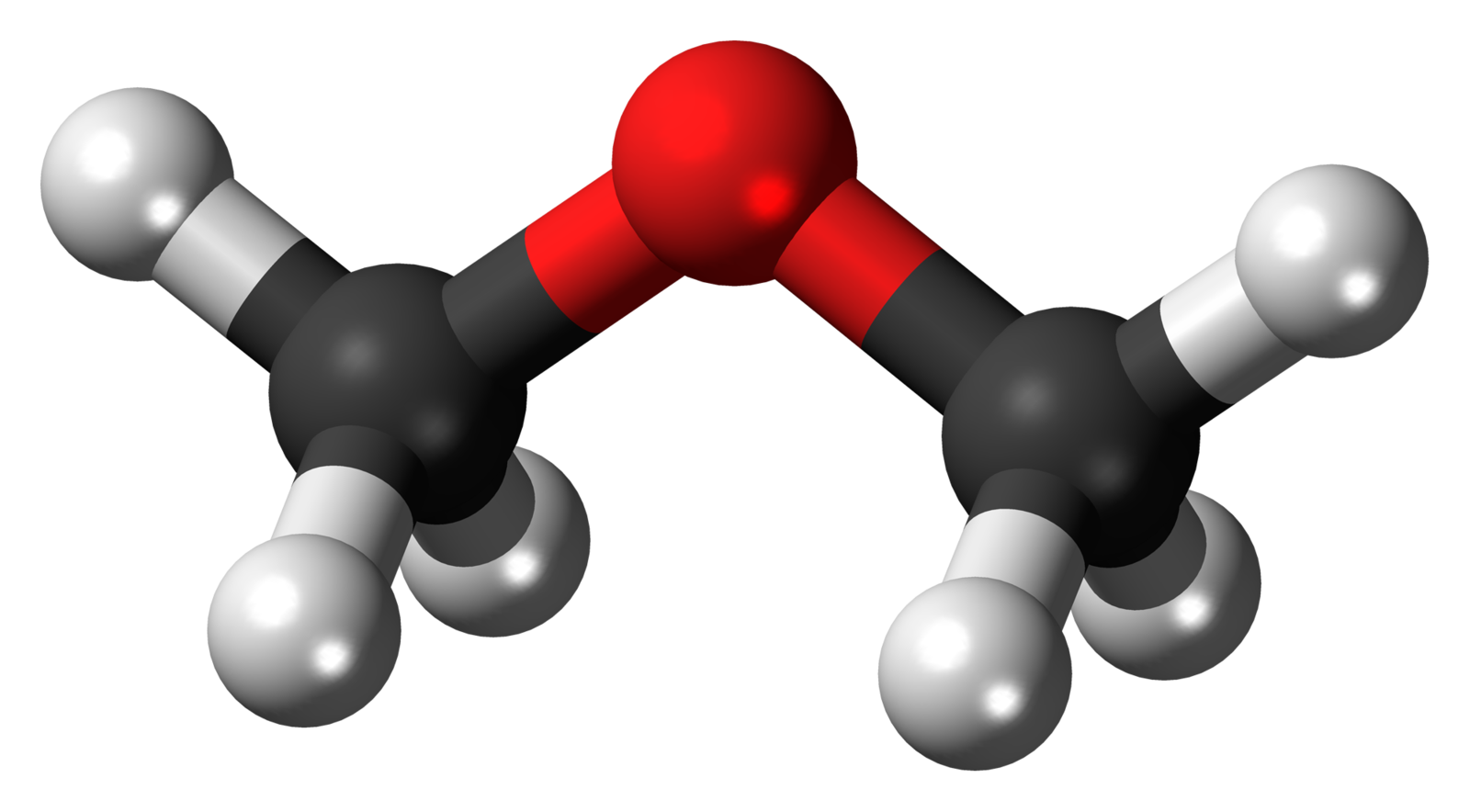
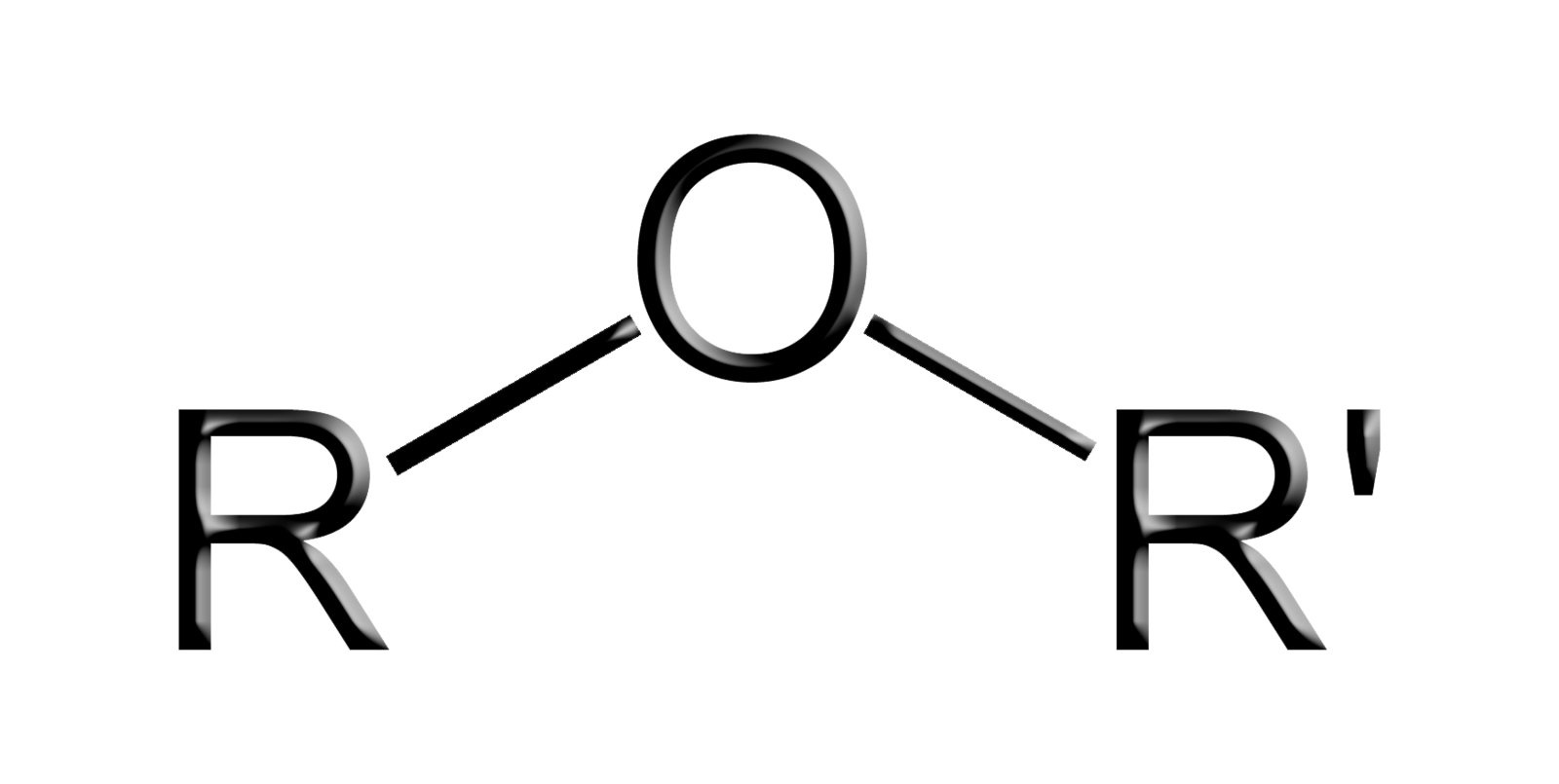

Características físicas dos éteres: no estado líquido são muito voláteis, incolores e de cheiro agradável, não apresentam solubilidade em água, mas podem ser encontrados também na fase sólida ou gasosa.
Para saber o estado físico de um éter é só observar a quantidade de carbonos: os éteres com até três carbonos se encontram no estado gasoso, os com mais de três carbonos são líquidos e os de massa molecular maior são sólidos.

Quanto às propriedades químicas, pode-se dizer que os éteres são altamente inflamáveis, apesar da pouca reatividade.
A aplicação desses compostos é variada, podem ser usados para fabricar seda artificial, celulóide e ainda como solvente na obtenção de gorduras, óleos e resinas.
A aplicação de éteres na medicina é importante: é usado como anestésico e para preparar medicamentos.

Uma conhecida forma de éter, muito usada em nosso cotidiano e na medicina, é o éter comum, um líquido altamente volátil que atualmente entrou em desuso em razão dos perigos de se inflamar e causar incêndios.
Esse éter também é conhecido pelas denominações de éter etílico, éter dietílico ou éter sulfúrico.
Mas não é só na medicina que encontramos os éteres, são aplicados também na indústria, como solvente de tintas, óleos, resinas, graxas, em razão da propriedade que possui de dissolver esses compostos.




Nomenclatura
Exemplos:
CH3 — O — CH2 — CH3→ metoxietano
CH3 — CH2 — O — CH2 —CH3→ etoxietano
CH3 — CH2 — O — CH2 — CH2 —CH3→etoxipropano
CH3 — O — CH2 — CH ═ CH —CH3→ metoxibuteno
CH3 — CH2 — CH2 — O — CH2 — CH2 — CH2 — CH2 — CH3→propoxipentano

A nomenclatura oficial dos éteres, conforme a IUPAC, pode ser feita de duas maneiras. Veja cada uma:
1ª maneira:

Consideram-se os dois grupos ligados ao oxigênio como substituintes, sendo indicados por ordem de complexidade com o sufixo ico, ou seja, segue a seguinte regra:
2ª maneira:
éter + 1º grupo + 2º grupo + ico
Exemplos:
CH3— O —CH2 —CH3→ éter etílico e metílico
CH3 —CH2—O —CH2 —CH3→éter dietílico
CH3 —CH2—O —CH2 —CH2 —CH3→éter etílico e propílico
CH3 —CH2 —CH2—O —CH2—CH2 —CH2 —CH2 —CH3→éter propílico e pentílico

Fontes :
- http://brasilescola.uol.com.br/quimica/eteres.htm
- http://www.soq.com.br/conteudos/em/funcoesorganicas/p19.php
- http://www.infoescola.com/quimica/acidos-carboxilicos/
- http://mundoeducacao.bol.uol.com.br/quimica/nomenclatura-dos-acidos-carboxilicos.htm
- http://brasilescola.uol.com.br/quimica/nomenclatura-dos-Eteres.htm

Grupo : Ana Diany, Luan, William.
Professor :
Alexandre Salvador



Éteres e ácidos carboxílicos
By William Remor
Éteres e ácidos carboxílicos
- 2,327



