Kursusarbejde
5
Mohrs titrering
Hvad er titrering?
Titrering er en metode til at bestemme indholdet af en bestemt kemisk forbindelse i en prøve.
En burette bruges til at tilsætte titrator. Buretten bruges da den kan måle volumen af titratoren meget præcist.
Titratoren reagerer med prøven, som også bliver kaldt titranden.
En indikator bliver ofte tilsat. Når der sker en ændring i prøven, så ved man at alle molekylerne af det undersøgte stof har reageret med titratoren.
Mohrs titrering?
Mohrs titrering bruges til at bestemme saltindholdet i en prøve.
I Mohrs titrering bruges kaliumchromat som en indikator.
Det er altså den samme procedure som normal titrering, men bare hvor man går specifikt ind og bestemmer saltindholdet og bruger kaliumchromaten som en indikator.
Formål
Formålet med forsøget var at vi skulle repetere emnet om mængdeberegning og fældningsreaktioner.
Formålet med forsøget er også at lære noget nyt, bl.a. at opnå en forståelse for analysemetoden, titrering og vi skulle også kunne bruge koncentrationensberegninger.
Teori
Mængdeberegningstrekant
n
M
m
m = masse (g)
n
M
m
n = stofmængden (mol)
n
M
m
M = molarmassen (g/mol)
Koncentrationstrekant
c
V
n
n = stofmængden (mol)
c
V
n
c = koncentrationen (mol/L)
c
V
n
V = volumen (L)
Fældningsreaktioner
NaCl + AgNO3 => AgCl + NaNO3
(s)
(aq)
Køkkensalt og sølvnitrat
Udfældning af alt chlorid
(aq)
Efter udfældning (ækvivalenspunkt)
2Ag + CrO4 => Ag2CrO4
(aq)
(aq)
(s)
+
2-
Første del
Forsøgsopstilling

- 1,0519g NaCl
- 100mL målekolbe
Vi puttede først NaCl i og derefter hældte vi lidt vand i, så vi kunne opløse saltet optimalt. Efter alt saltet var opløst, så kunne vi hælde vand op til 100mL mærket på målekolben.
Det færdige resultat ses på billedet.
Anden del
Forsøgsopstilling
Apparatur
- 100mL kronisk kolbe
- 10mL pipette
- Pipettebold
- Burette
- Stativ
- Magnetomrører + magnet
- Tragt
Kemikalier
- 0,1M AgNO3
- 0,1M K2CrO4
Forsøgsopstilling



Forsøgsopstilling

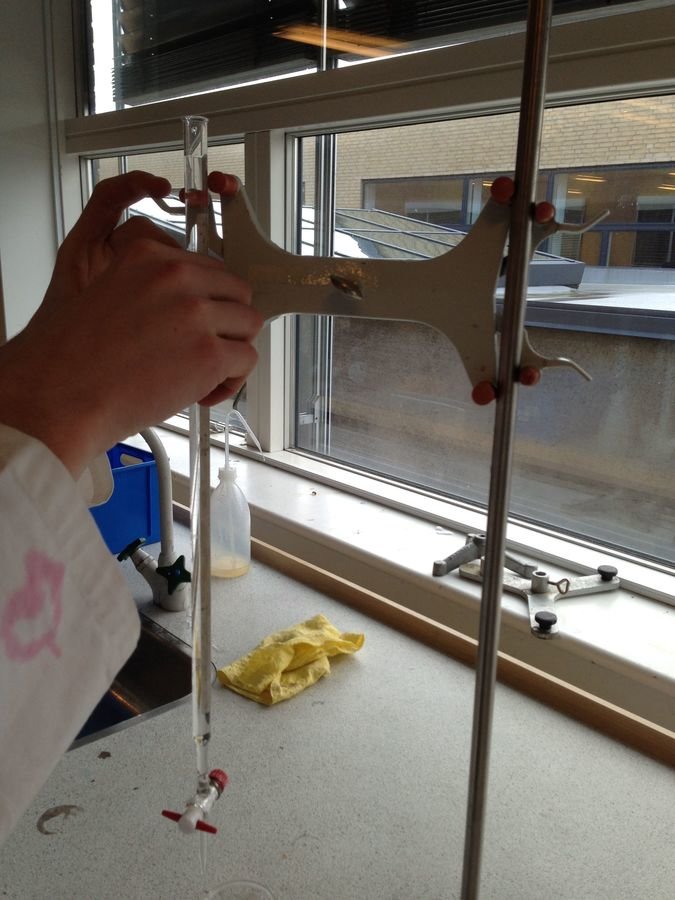

Fremgangsmåde

I den koniske kolbe er der blevet tilsat 10mL saltvand fra en anden gruppes opløsning. Der er yderligere blevet tilsat 5 dråber kaliumchromat-opløsning som en indikator og til sidst en magnet. Kolben er blevet sat oven på en magnetomrører. Buretten indeholder 0,1M AgNO3, som er blevet fyldt helt op til nulmærket.
Herefter sker tildrypning af sølvnitratet indtil én dråbe giver væsken en blivende rød farve.
Titreringen skulle laves to gange for at få et mere præcist resultat.
Resultater
Burettens væskestand ved ækvivalenspunktet blev målt til 9mL for hvert forsøg.
VAgNO3 = 9 mL = 0,009 L
cAgNO3 = 0,100 mol/L

Databehandling
Opgave 1
Udfra resultaterne kan vi starte med at udregne stofmængden af AgNO3. Vi ved at stoffets volume er på 9mL da vi ved begge forsøg fik buretten afmålt til dette. Vi får også at vide at koncentrationen af sølvnitratet er 0,100 mol/L. Vi kan herefter udregne stofmængden med formlen:
n = c·V
nAgNO3 = 0,1·0,009 = 0,0009 mol
Dette er også stofmængden af Cl da vi ved at alle chloridionerne er udfældet når ækvivalenspunktet er opnået.
-
-
Opgave 2
Nu hvor vi har stofmængden af Cl så ved vi også hvad stofmængden af NaCl er, da forholdet er 1:1. Efter at også have fundet molarmassen af NaCl kan vi finde massen af NaCl i den prøve vi har titreret på.
MNaCl = 58,4428 g/mol
nNaCl = 0,0009 mol
m = n·M
mNaCl = 0,0009/58,4428 = 0,0526 g
Vi kan nu gange den fundne værdi med 10, så vi får massen i en 100mL prøve.
mNaCl = 0,0526·10 = 0,526g
-
Opgave 3
Vi kan nu også beregne koncentrationen af NaCl i prøven, da vi kender stofmængden fra før, og også fordi vi kender volumen af prøven.
nNaCl = 0,0009 mol
Vprøve = 10mL = 0,01 L
c = n/V
c(NaCl) = 0,0009/0,01L = 0,09 mol/L
Opgave 4 + opgave 5
Vi fik vores koncentration af NaCl til 0,09 mol/L og den aktuelle værdi er 0,115 mol/L. Der er alligevel en stor forskel, men det er pga. fejlkilder. Dette diskuteres i den kommende diskussions slide.
Vi kan dog allerede nu beregne hvor stor en forskel der rent faktisk er i procent.
Diskussion
Massen af NaCl er overhovedet ikke tæt nok på den oprindelige 100mL prøve som den gruppe vi fik lavede i del 1. Hvis vi sammenligner den masse, som vi skulle have haft, 0,672g, med det resultat vi fik det til, som er 0,526g, så er der omkring 0,146 gram i forskel!
Den store forskel får vi også når vi sammeligner vores resultat af NaCl's koncentration i prøven med den aktuelle. Der er vi oppe på 21,739%, det er altså alt for meget. Man kan stille spørgsmålstegn ved hvor præcist vi har afmålt de forskellige væsker pga. vi jo bare har brugt øjemål. Dog har vi været meget omhyggelig med forsøget og har sørget for at afmåle helt præcist af. En stor faktor er at det ikke er vores egen prøve, men en anden gruppes. Vi ved ikke hvor omhyggelig prøvens gruppe har været, med at få afmålt præcist af.
Konklusion
Massen af NaCl omregnet til en 100mL prøve fik vi til 0,526g. Koncentrationen af NaCl fik vi til 0,09 mol/L. Den procentvise afvigelse mellem vores koncentrationsværdi og den aktuelle er 21,739%.
Selve udførelsen af vores forsøg gik som det skulle, men resultaterne blev ikke som forventet. Vi har konkluderet at den store faktor kan ligge hos den tildelte prøve som vi fik.
Kursusarbejde 5 - Mohrs titrering
By deam
Kursusarbejde 5 - Mohrs titrering
- 958



