Física
At mica

Sebastián Tabares
Pedro Rodriguez
Dairo Carrillo
¿Que es?
Aplicar la mecánica cuántica a los sistemas atómicos, mas que todo enfocarlo a el átomo de hidrógeno, que es el que se describe con mas presición
Introduccion
- Espectros atómicos
- Propiedades cuánticas átomo de hidrógeno
- estado cuántico de las órbitas de los elementos
- energía, espín, momento angular del electrón
Espectro Atómico de los gases
-
Espectro de línea discreto: Se observa cuando un gas a baja presión se somete a una descarga eléctrica.
-
Espectroscopia de emisión: Este espectro de línea discreto difiere en gran medida del arco iris continuo de colores observado cuando se examina un sólido resplandeciente con el mismo instrumento.
Espectros de emisión
Balmer
Lyman
Pacshen
Brackett
Espectros de Absorción
Modelos del Atómo
En la historia de la física
ha habido varios modelos atómicos

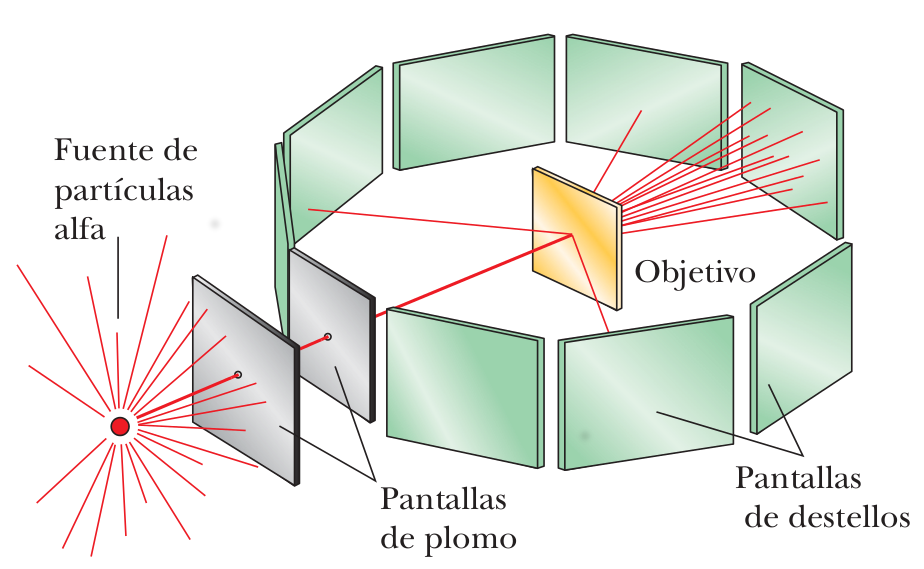
Modelo de Bohr
- el electrón se mueve en órbitas circulares
- solo ciertas órbitas son estables: estados estacionarios
-
solo la radiacion es emitida cuando cambia de una órbita de mayor energía a una menor
la frecuencia ƒ del
fotón emitida en la transición se relaciona con el cambio en la energía del átomo y
no es igual a la frecuencia del movimiento orbital del electrón
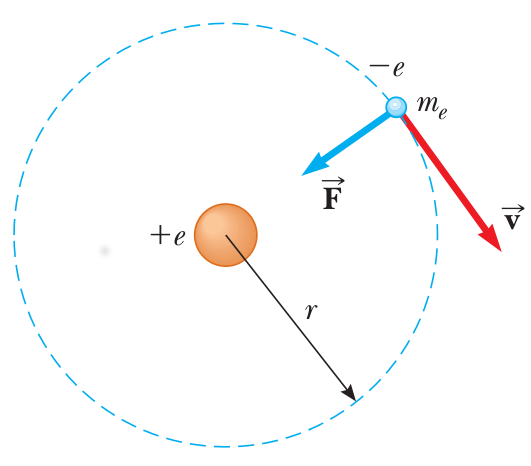
Cuantización Energía
La cuantización de los radios de la órbita conduce a la cuantización de la energía.
Frecuencia emisión fotón
Hidrógeno

Modelo Cuántico
El modelo de Bohr no predice con exactitud todas nociones experimentales que se ven, por eso surge un modelo mas aproximado a la realidad

Ecuación de Onda de Schrödinger
Modelo Cuántico

Ejercicio
Para un átomo de hidrógeno determine los estados permitidos que
correspondan al número cuántico principal n = 2 y calcule las energías de
estos estados.
Funcion Onda
Hidrógeno
Describe de manera aproximada la posición probabilística del electrón
Interpretacion Fisíca
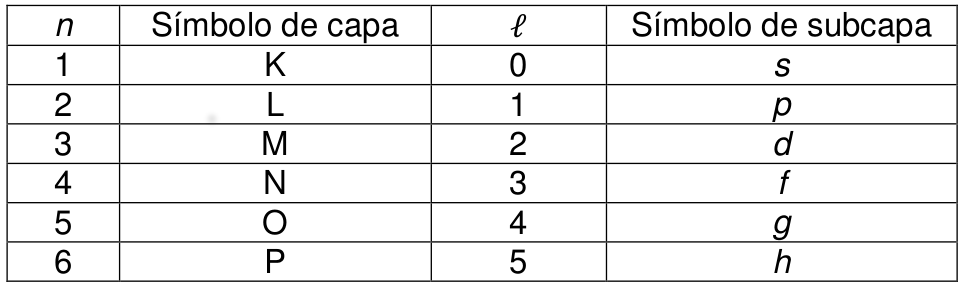
números Cuánticos
Movimiento Angular
Espín?
El espín no viene de las ecuaciones de Schrödinger, se coloca ad-hoc
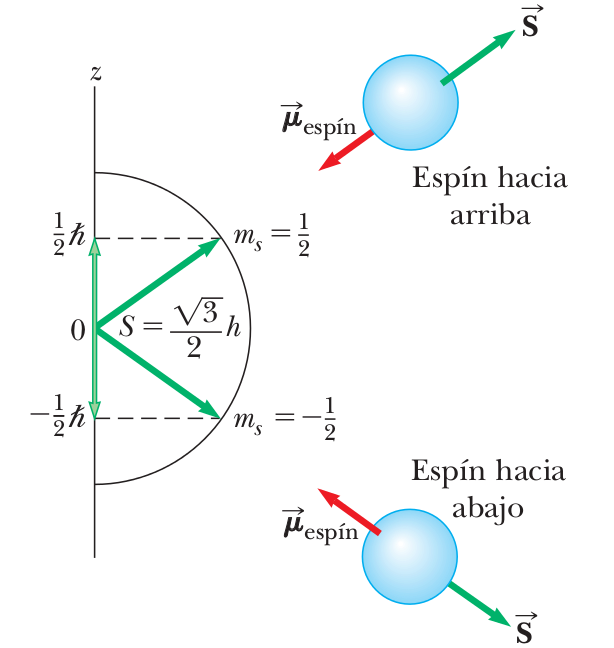
el espín está cuantizado
Principio Exclusion Tabla periodica
No puede haber dos electrones en el mismo estado
cuántico; debido a eso, dos electrones del mismo
átomo no pueden tener el mismo conjunto de
números cuánticos.

PAULI
Definiciones
-
ORBITAL: Estado atómico caracterizado por los números cuánticos n, l, m l . Según
el principio de exclusión sólo puede haber dos electrones presentes en cualquier
orbital. - Uno de estos electrones tiene un número cuántico magnético de espín , y
el otro es .
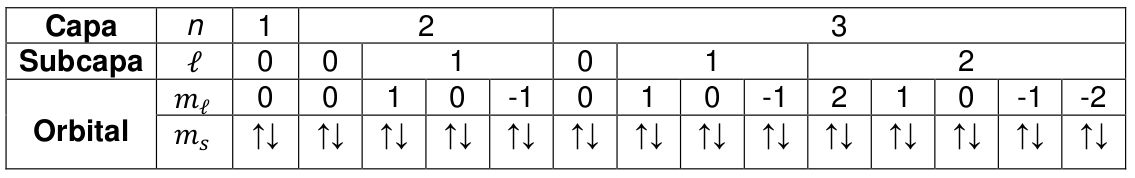
Ejercicio
Encontrar los números cuánticos y la configuración electrónica de:
- Berilio (z= 4).
- Carbono (z= 6).
Física Atómica
By Sebastian Yesid Tabares Amaya
Física Atómica
Exposición sobre la física atómica
- 1,475



