4ESO. Bloque 2. La materia
Unidad 1: Modelos atómicos

Estructura atómica
El modelo de Dalton
El 1803 Dalton estableció que los elementos estaban formados por partículas llamadas átomos, afirmando:
-
Los átomos son inalterables (por tanto son indivisibles y todas sus propiedades permanecen constantes).
-
Todos los átomos de un mismo elemento son iguales entre sí: tienen el mismo tamaño, la misma masa y las mismas propiedades químicas.
-
Los átomos de un elemento son diferentes a los átomos de todos los demás elementos.
-
Los compuestos están formados por átomos de más de un elemento.
-
La relación del número de átomos entre dos de los elementos presentes es un número entero o una fracción sencilla.
El modelo de Dalton
El modelo de JJ Thomson
El modelo de JJ Thomson
El modelo de JJ Thomson
El modelo de Rutherford
El modelo de Rutherford

El modelo de Rutherford


El modelo de Bohr


El modelo de Bohr
El modelo de Bohr
Postulados de Bohr
1) Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.
2) Solo hay determinadas órbitas permitidas para el electrón.
3) El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles.
Número atómico y másico

Isótopos

Número atómico, másico y configuración electrónica

Configuración electrónica


n=1
n=2
n=3
n=4
Configuración electrónica

La masa y la carga de las partículas subatómicas
| Masa (en reposo) | Carga | |
|---|---|---|
| protón | ~1 u | |
| neutrón | ~1 u | |
| electrón | ~ 1u/1820 | |
| partícula alfa | ~ 4 u | |
| partícula beta | ~ 1 u/1820 | |
| partícula gamma | 0 u |
La tabla periódica

1s
2s
3s
4s
5s
6s
7s
3d
4d
5d
6d
1s
2p
3p
4p
5p
6p
4f
5f
Metales de transición
Elementos representativos
Metales de transición interna
La tabla periódica
Metales
Semimetales
No metales
Gases nobles

La tabla periódica

Actividades

La tabla periódica
Actividades

Bloque 2. La materia

Unidad 2. El enlace
El enlace
Regla del octeto
Estructuras de Lewis
Sustancias Iónicas
Sustancias covalentes
Sustancia moleculares
Metales
El enlace

Actividades
¿Qué es el enlace?


¿Qué es el enlace?

Actividades
¿Qué es el enlace?

Actividades
El enlace covalente


Propiedades
El enlace covalente
Actividades




Algunos compuestos con enlace covalente


Actividad

Estos forman cristales
Estos forman moléculas
Compuestos con enlace covalente
Actividades



Polaridad del enlace covalente
La electronegatividad

Polaridad del enlace covalente

Molécula polar

Molécula apolar

Microondas y polaridad en las moléculas
Polaridad del enlace covalente

Fuerzas intermoleculares
Dipolo permanente- Dipolo permanente
Dipolo permanente - Dipolo inducido
Dipolo instantáneo - Dipolo inducido
Los puentes de hidrógeno
¡Qué exageración!
O
N
F
+H
V
a
n
d
e
r
W
a
a
l
s
Puentes de hidrógeno

Actividades


El enlace iónico
¿Entre qué elementos se da?
¿Cuáles son las propiedades de estos compuestos?

¿En qué consiste?
El enlace iónico
Actividades

TRANSICIÓN ENTRE EL ENLACE COVALENTE
Y EL IÓNICO

TRANSICIÓN ENTRE EL ENLACE COVALENTE Y EL IÓNICO


El enlace metálico
¿Qué es?
¿Qué elementos lo forman?
Propiedades de las sustancias metálicas
El enlace metálico



La molécula y el mol
Masa atómica
Masa molecular
El mol
Masa molar
Volumen molar
PV = nRT
Fórmula empírica
Fórmula molecular
Composición centesimal

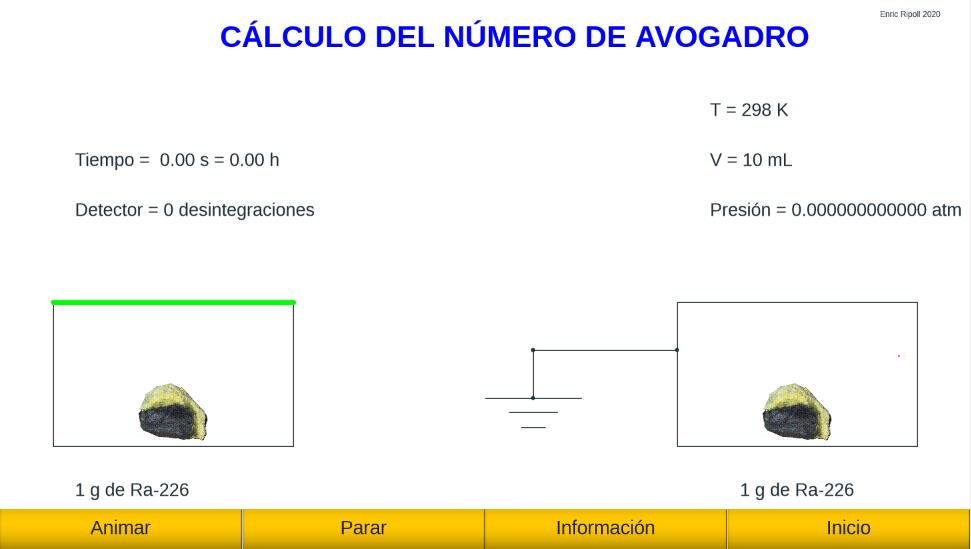
El número de Avogadro

El número de Avogadro
Actividades finales

Las fórmulas Químicas
Formulación
4ESO_02. La materia
By zorro2002
4ESO_02. La materia
- 2,431