Termoquímica
Relator: Enric Ripoll Mira. 2018

Definición de termoquímica
Calor a volume e presión constantes
O caso dos gases
Relación entre U e H
Entalpía dunha reacción
Concepto
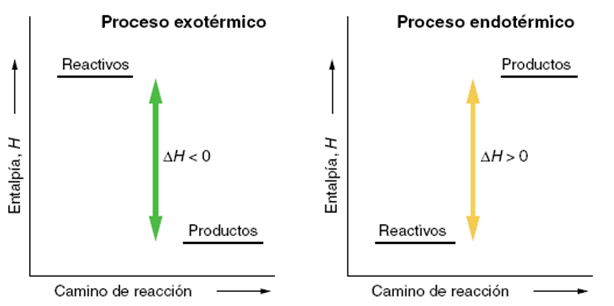
Reaccións exotérmicas e endotérmicas
Ecuacións termoquímicas
Estados estádar
Diagramas entálpicos
A lei de Hess
Entalpía de formación
Enerxía de enlace e entalpía de reacción
A entropía
Procesos espontáneos
Enerxía libre de Gibbs
Temperatura de equilibrio
A combustión
Fin
Enlace químico
•Son as forzas que manteñen unidos aos átomos entre si para formar moléculas ou ións.
•Son de tipo eléctrico.
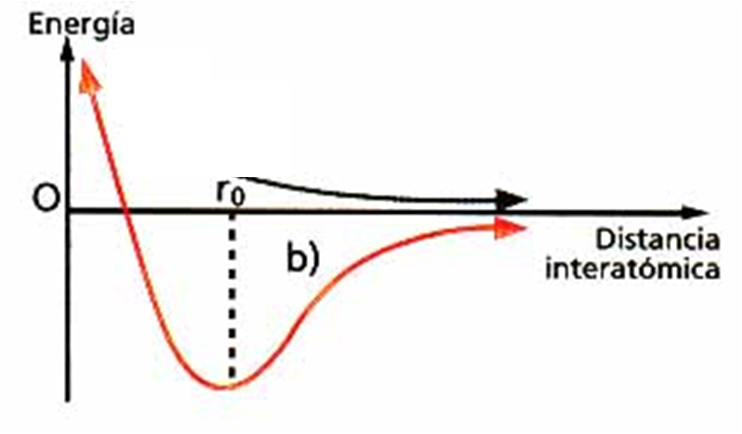
•Ao formarse un enlace despréndese enerxía.
•A distancia á que se colocan os átomos é á que se desprende maior enerxía producíndose a máxima estabilidade.
•Os átomos únense pois, porque así teñen unha menor enerxía e maior estabilidade que estando separado.
Estabilidade nun átomo. Teoría de Lewis
•Xeralmente, os átomos buscan a súa máxima estabilidade adoptando un a configuración electrónica similar á que teñen os gases nobres (1 s2 ou n s2p6).
•O comportamento químico dos átomos vén determinado pola estrutura electrónica da súa última capa (capa de valencia).
•Para conseguir a conf. electrónica de gas nobre, os átomos perderán, capturarán ou compartirán electróns (regra do octeto).
Tipos de enlaces
•Iónico: unen iones entre si.
•Covalente:
- •Cristais covalentes ou atómicos
- •Cristais moleculares
• Metálico
•Intermolecular: unen unhas moléculas a outras.
Enlace iónico
•Dáse entre metais e non-metais.
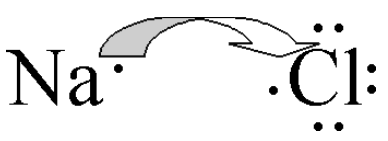
•Os metais teñen, en xeral, poucos electróns na súa capa de valencia e tenden a perdelos para quedar coa capa anterior completa (estrutura de gas nobre) converténdose en catións.
•Os non-metais teñen case completa a súa capa de valencia e tenden a capturar os electróns que lles faltan converténdose en anións e conseguir así mesmo a estrutura de gas nobre.
Reaccións de ionización
•Os metais ionízanse perdendo electróns:
M – n e– ® Mn+
•
•Os non-metais ionízanse gañando electróns:
N + n e– ® Nn–
Exemplos:
Metais: Na – 1 e– ®
Non-metais:
O enlace iónico
O enlace iónico dáse pola atracción electrostática entre cargas de distinto signo, formando unha estrutura cristalina.
Exemplo:
Na ––––––> Na+
1 e-
Cl ––––––> Cl-
•O catión Na+ rodéase de 6 aniones Cl- uníndose a todos eles coa mesma forza, é dicir, non existe unha forza especial entre o Cl- e o Na+ que lle deu o e–.
Estrutura dos compostos iónicos
•O índice de coordinación do catión e do anión nunha rede cristalina depende de :
•Tamaño dos ións. O valor do radio dos iones marcará a distancia á que se poden situar . Por exemplo, o sodio catiónico, Na+, ten un raio de 0.95A, e o cloruro de 1.81A. Esta diferenza de tamaños fai que cada sodio só se poida rodear de 6 cloruros. No caso de redes cuxos tamaños iónicos son máis semellantes, por exemplo o cloruro de cesio, CsCl (Cs+1.70A e Cl- 1.81A), os ións pódense rodear dun maior número de ións de carga oposta, e esta rede iónica presenta coordinación (8,8), que é a chamada cúbica centrada no corpo. Cada ión cesio rodéase de 8 cloruros, e cada cloruro de 8 cesios.

Estrutura dos compostos iónicos
•O índice de coordinación do catión e do anión nunha rede cristalina depende de :
•Carga dos ións. Como o cristal é eléctricamente neutro, si os ións teñen carga distinta isto condicionará a estequiometría e, polo tanto, a estrutura e o índice de coordinación. Por exemplo, no caso da fluorita, que é o fluoruro de calcio, CaF2, vemos que como a valencia iónica do calcio é 2, porque é un metal alcalinotérreo que pode perder dous electróns da última capa, e o F ten unha valencia iónica de -1, haberá 2 aniones F- por cada catión Ca2 . Isto fai que, neste composto, o calcio rodéase de 8 fluoruros e o fluoruro de 4 calcios, presentando unha coordinación (8,4). A este tipo de estrutura, por analoxía coa fluorita, denomínalla estrutura tipo fluorita.

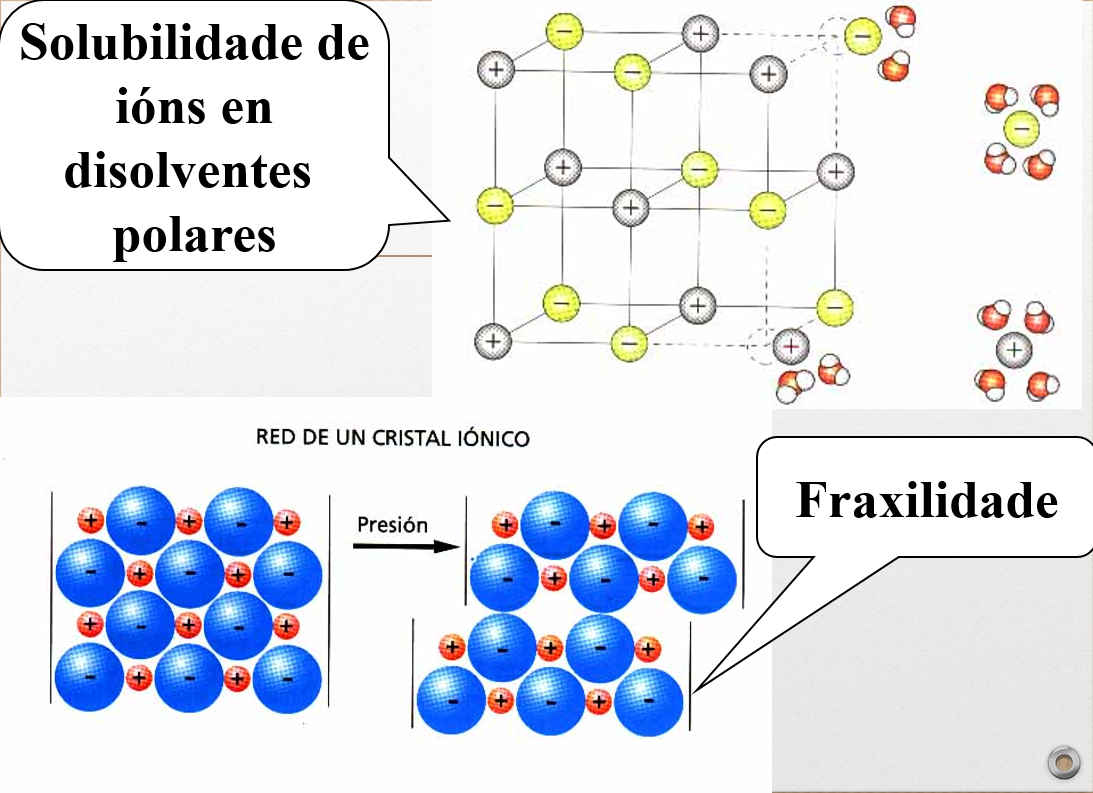
Propiedades dos compostos iónicos
•Duros.
•Punto de fusión e ebullición altos.
•Só solubles en disolventes polares.
•Condutores en estado disolto ou fundido.
•Fráxiles.

Propiedades dos compostos iónicos
Enerxía reticular
É a enerxía que se desprende na formación dun (mol de) cristal iónico a partir dos seus ións gasosos
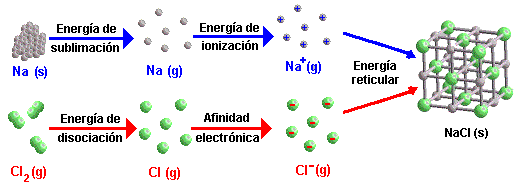
Ciclo de Born
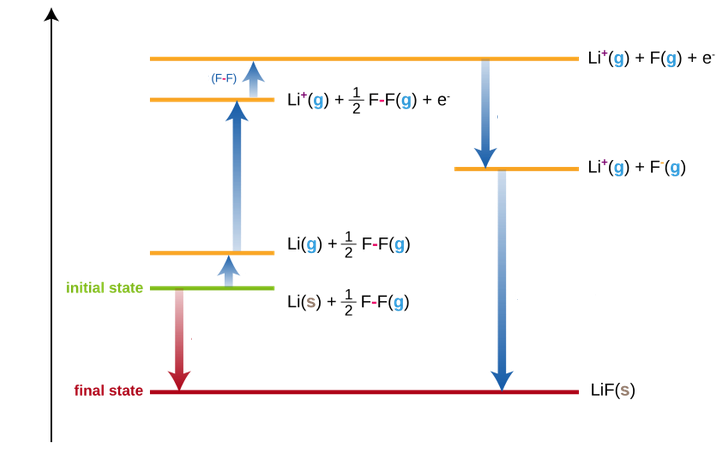
Entalpía
Actividades
0. A partir dos datos que se dan a continuación, cal é o valor correspondente a la enerxía reticular do bromuro de magnesio, MgBr2 (s)?:
|
Enerxía de formación do MgBr2 -283,5 kJ/mol |
Enerxía de vaporización do Br2(l) + 31 kJ/mol |
|
Enerxía de ionización do Mg (g) a Mg2+ (g) +2170 kJ/mol |
Enerxía de disociación do Br2 (g) + 190 kJ/mol |
|
Enerxía de sublimación do Mg (s) + 150 kJ/mol |
Afinidade electrónica do Br (g) -323 kJ/mol |
a) -2.178,5 b) -2.501,5 c) -2.375,5 d) -4.561 kJ/mol
Enlace covalente
•Dáse entre dous átomos non-metálicos por compartición de e– de valencia.
•A parella de e– (xeralmente un e– de cada átomo) pasan a ser compartidos mediante un orbital molecular.
•Si uno dos átomos pon os 2 e– e o outro ningún denomínase ”enlace covalente coordinado” ou “dativo”.
Estruturas de Lewis
Consiste en representar con puntos “·” ou “x” os e– da capa de valencia.
Exemplos:
Grupo: 17 16 15 14
Átomo: Cl O N C
Nº e– val. 7 6 5 4
·· · ·
: Cl · : O : : N : · C ·
·· ·· ·
Regras para establecer as estruturas de Lewis
•Contar os electróns de valencia que cada átomo achega á molécula. Todos eles deben aparecer na estrutura final, ben como electróns enlazados, ben como pares solitarios.
•Elixir o átomo de maior covalencia como átomo central e dispoñer o resto dos átomos ao redor deste. O hidróxeno sempre ocupa un lugar periférico
•Colocar arredor de cada átomo pares de electróns de acordo coa regra do octeto. Exemplo. no Cl2O con 20 e-
•Se se precisan enlaces múltiples, estes asígnanse preferentemente aos elementos de maior valencia. Estes elementos ocupan. así mesmo, a posición central en estruturas con tres ou máis átomos:
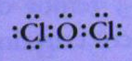
Enlace covalente
Pode ser:
•Enl. covalente simple: Compártense unha parella de electróns.
•Enl. covalente dobre: Compártense dúas parellas de electróns.
•Enl. covalente triplo: Compártense tres parellas de electróns.
•Non é posible un enlace covalente cuádruplo entre dous átomos por razóns xeométricas que estudaremos cando estudemos o modelo mecanocuántico do enlace.
Actividades
•1. Cantos electróns hai que engadir ou quitar á suma dos de valencia dos átomos implicados para escribir as fórmulas de Lewis das especies CO2, CO32-, NO2+, NH3 e PO43-?
2. É correcto afirmar que a regra do octeto esixe que todos os átomos teñen que alcanzar oito electróns de valencia?
3. Escribe fórmulas de Lewis que cumpran a regra do octeto para as especies: CH2O, H2Cl+, NO2+, SF4, CO32-e HNO3.
4. Por que se elixe o nitróxeno como átomo central no NO2?
Limitacións e melloras da teoría de Lewis
•Octeto incompleto
•BF3
•Expansión do octeto
•SF6
•Especies con número impar de e-
•NO
•Resonancia
O3
- Orde de enlace
Actividades
•5. Explica o concepto de orde de enlace fraccionario.
6. Escribe as estruturas resonantes e obtén a orde de enlace nas especies: C6H6 e NO2-
Teorías Cuánticas do enlace covalente
•A ecuación de Schrödinger
•Describe a evolución dunha partícula. É de importancia central na teoría da mecánica cuántica xa que describe o comportamento dos electróns, sistemas de partículas...
•Lembrade que os electróns no átomo na actualidade son tratados coma ondas estacionarias.
•Estas ondas estacionarias son descritas por funciones chamadas orbitais Ψ que son solucións da ecuación de Schrödinger.
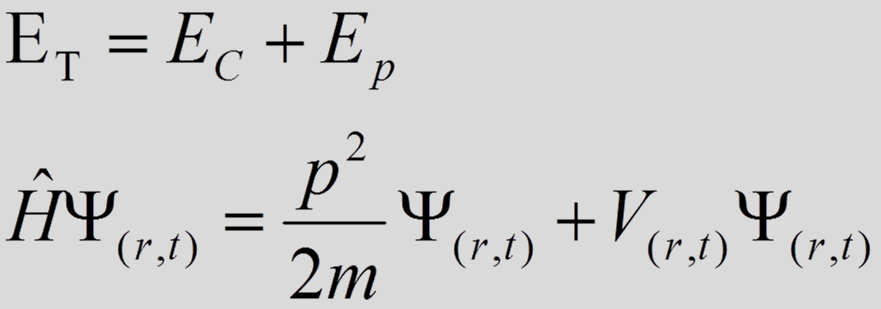
Teorías Cuánticas do enlace covalente
•Orbitais moleculares (TOM)
•Considera a molécula como un conxunto de núcleos e electróns. Ecuación de Schrödinger
•Enlace de Valencia (TEV)
•É máis intuitiva e considera a molécula como un conxunto de átomos enlazados: o OM fórmase por solapamento dos orbitais atómicos da capa de valencia.
•Xustificación das valencias
•Enlace sigma
•Enlace pi
•Enlaces simples
•Enlaces múltiples
Actividades
•7. Poden unirse dous átomos cun enlace dobre no que os OM sexan de tipo sigma, σ?
8. Explica en que se diferencia un enlace covalente ordinario dun dativo.
9. A molécula de auga fórmase no proceso: H+ + OH- → H2O mediante enlace covalente coordinado. Significa isto que os dous enlaces O—H da auga non son idénticos?
Tipos de enlace covalente
•Enlace covalente puro
• Dáse entre dous átomos iguais.
•Enlace covalente polar
• Dáse entre dous átomos distintos.
• É un "híbrido" entre o enlace covalente puro e o enlace iónico.
Actividades
10. Para a molécula CO, a lonxitude do enlace C—O, será maior ou menor de 120 pm?
11. A lonxitude do enlace C—C no benceno é de 139 pm. Escribe a súa estrutura de Lewis óptima e xustifica a lonxitude de enlace experimental.
12. Calcula, en eV, a enerxía necesaria para separar os cinco átomos dunha molécula de metano, CH4.
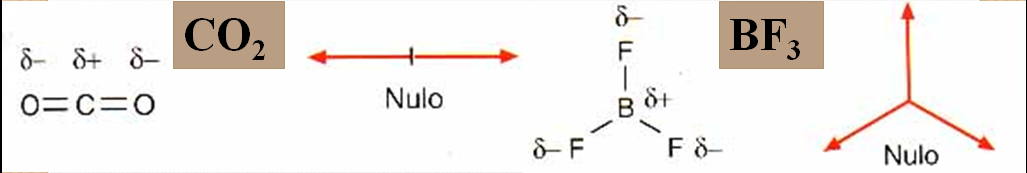
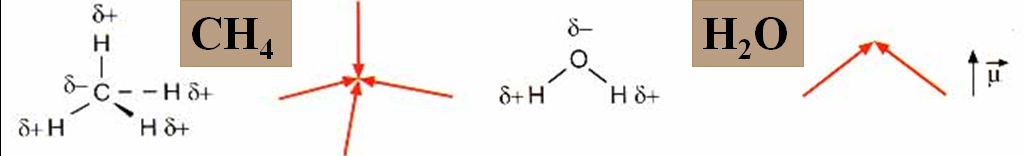
Momentos dipolares.
Xeometría molecular.
•É un vector que depende da diferenza de electronegatividade dos átomos.
A punta de frecha diríxese cara ao átomo con “δ–”.
•Cada enlace polar ten un μ, pero a molécula será polar só si a suma dos momentos dipolares non se anula.
Así a H2O e o NH3 teñen μ neto diferente de 0, mentres que moléculas como o CO2 ou o CH4 teñen
μ neto = 0 e son apolares.
Momentos dipolares.
Xeometría molecular.

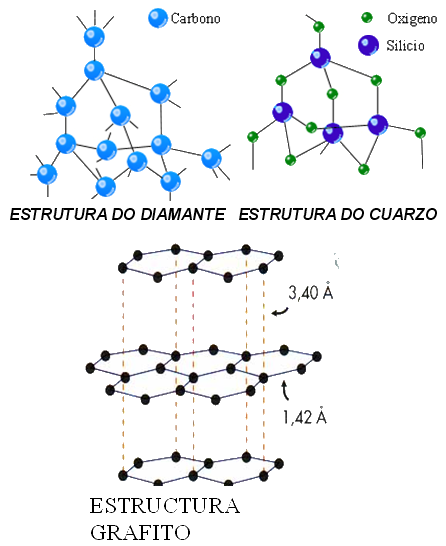
Compostos covalentes atómicos.
•Forman enlaces covalentes simples en dous ou tres dimensións do espazo con átomos distintos.
Exemplos:
SiO2, C (diamante),
C (grafito)
Propiedades dos compostos covalentes
Moleculares
•Puntos de fusión e ebulición baixos.
•Os compostos covalentes apolares (puros) son solubles en disolventes apolares e os polares en disolventes polares.
•Conductividad parcial só en compostos polares.

Atómicos
•Puntos de fusión e ebulición moi elevados.
•Insolubles en todos os disolventes.
•Non condutores (o grafito si presenta conductividad pola deslocalización dun e– de cada átomo).
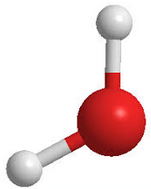
Enlace metálico, modelo do mar electrónico
Empaquetamento de catións metálicos.
•Dáse entre átomos metálicos.
•Todos tenden a ceder e–
•Modelo do gas electrónico
•Os catións forman unha estrutura cristalina, e os e – ocupan os intersticios que quedan libres nela sen estar fixados a ningún catión concreto (mar de e– ).
•Os e – están, pois bastante libres, pero estabilizan a estrutura ao ter carga contraria aos catións.
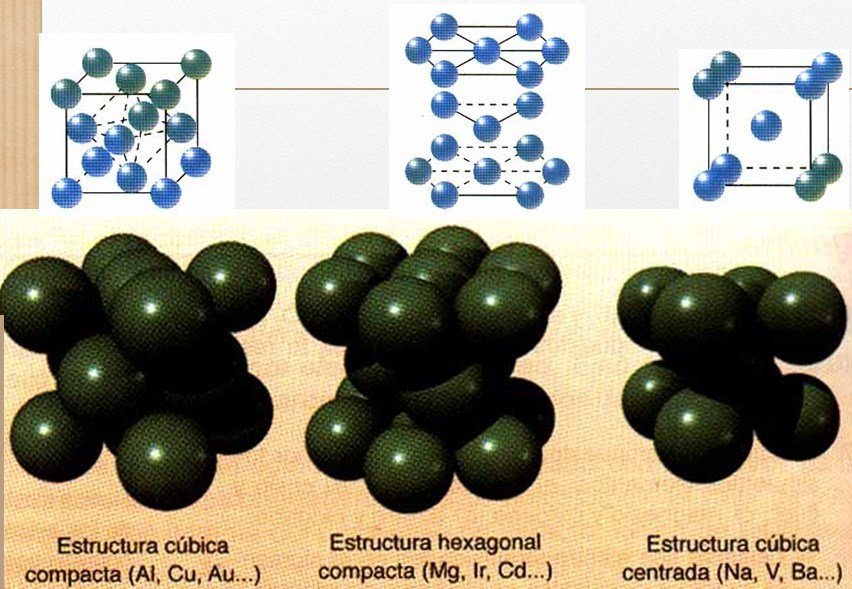
Propiedades dos metais
•Punto de fusión e ebulición moi variado (aínda que adoitan ser máis ben alto)
•Son moi solubles en estado fundido noutros metais formando aliaxes.
•Moi bos condutores en estado sólido.
•Son dúctiles e maleables (non fráxiles).
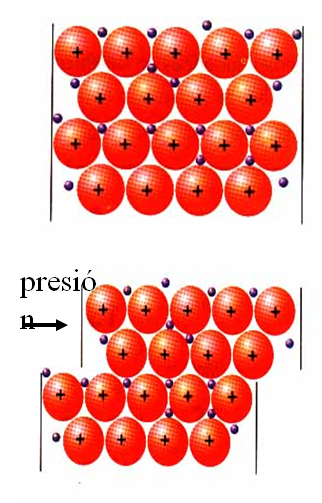
Modelo de bandas
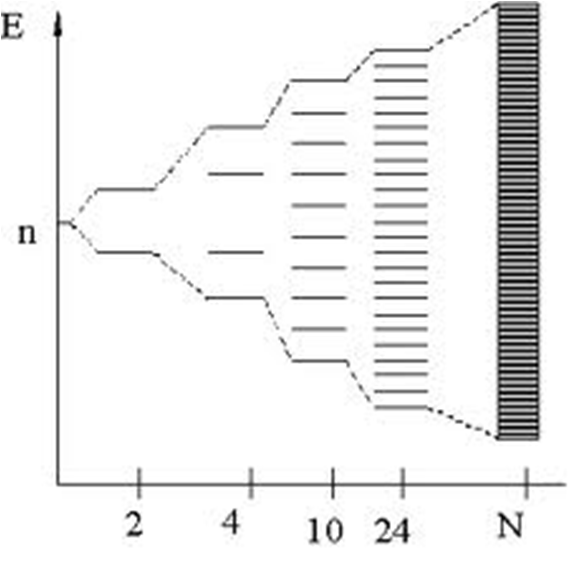
Modelo de bandas
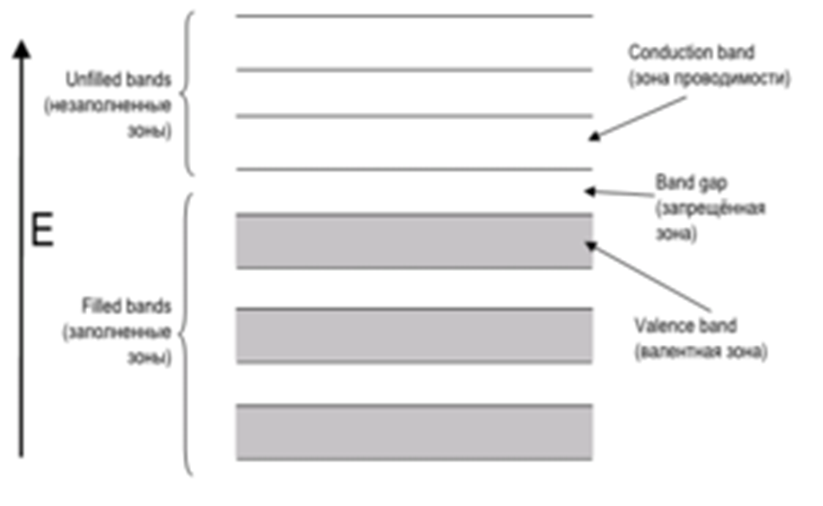
Modelo de bandas
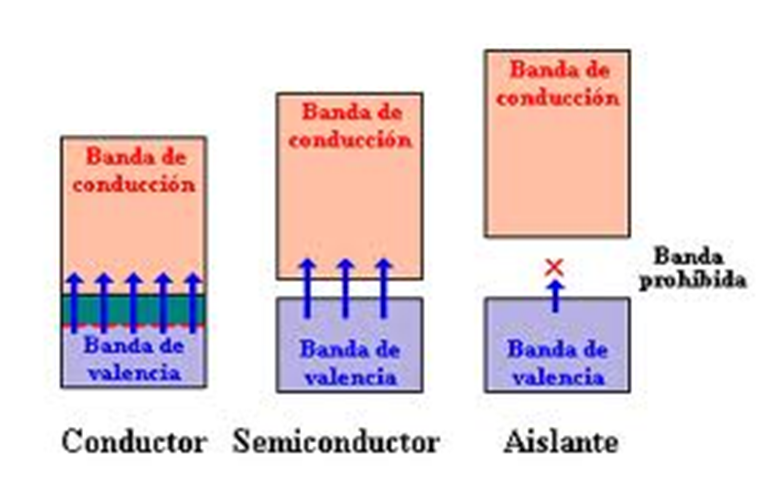
Actividades
•Xustifica por que os semiconductores conducen mellor a corrente eléctrica en quente que en frío.
•14. É correcto pensar que preto de 0K o Si e o Ge son aislantes?
•15. Ordea razoadamente o punto de fusión dos compostos iónicos: LiF, MgO, KF, CaS e CaCl2.
•16. Cales das seguintes sustancias disólvense en auga: SiO2, NaBr, Hg, CaCl2?
•17. Indica cales destes sólidos son condutores eléctricos: NaCl, C (diamante), Cu, Al2O3, Pb e C (grafito).
Actividades do fin da unidade
Xeometría molecular
Limitacións das estructuras de Lewis
As estruturas de Lewis non dan información de la forma das moléculas. Tampouco serven en xeral para determinar si a especie química existe.
La forma das moléculas está determinada polos ángulos de enlace.
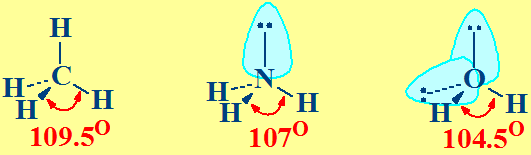
Exemplo: molécula de CCl4, experimentalmente atópase que os ángulos de enlace Cl-C-Cl son todos iguais e de 109,5°
Pode ser plana a molécula de CCl4?
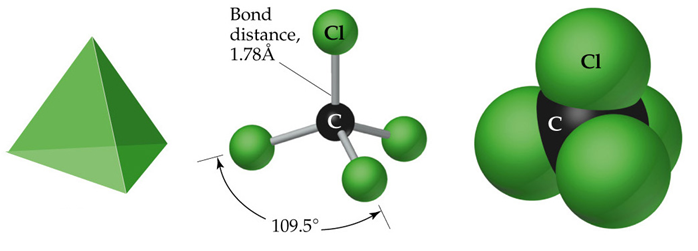
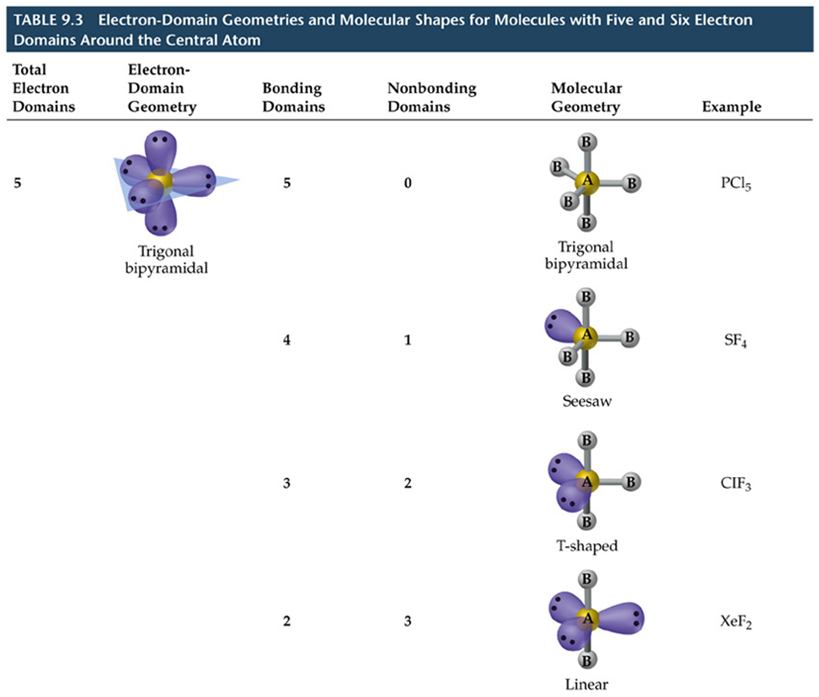
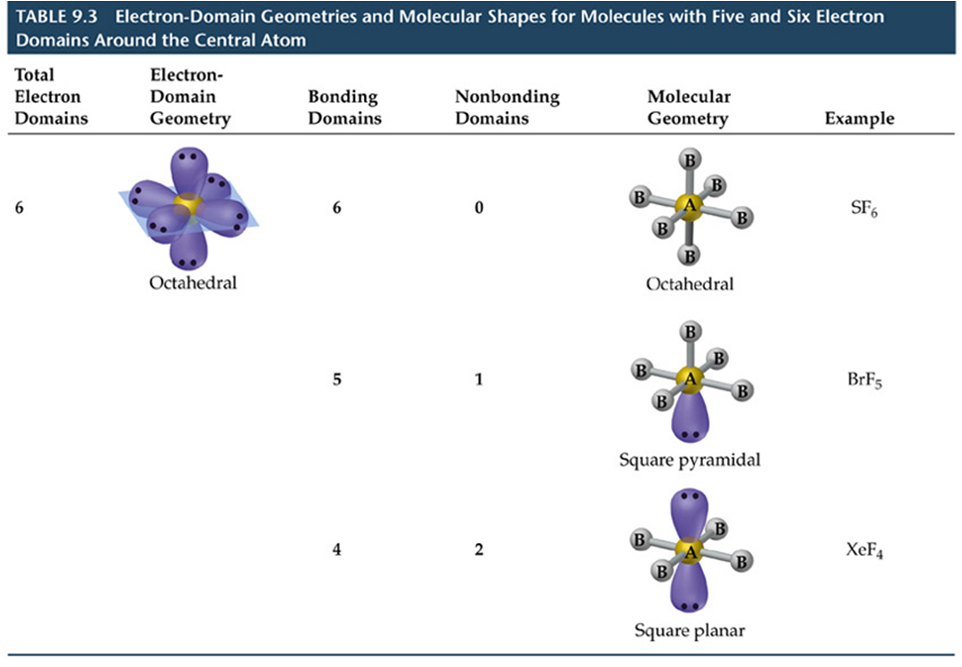
Teoría Valence Shell Electron Pair Repulsion (VSEPR)
A TREPEV (teoría de repulsión dos pares electrónicos de valencia)
Asúmese que os electróns de valencia repélense entre si. A forma ou xeometría tridimensional (3D) da molécula será a que fai mínima as repulsións.
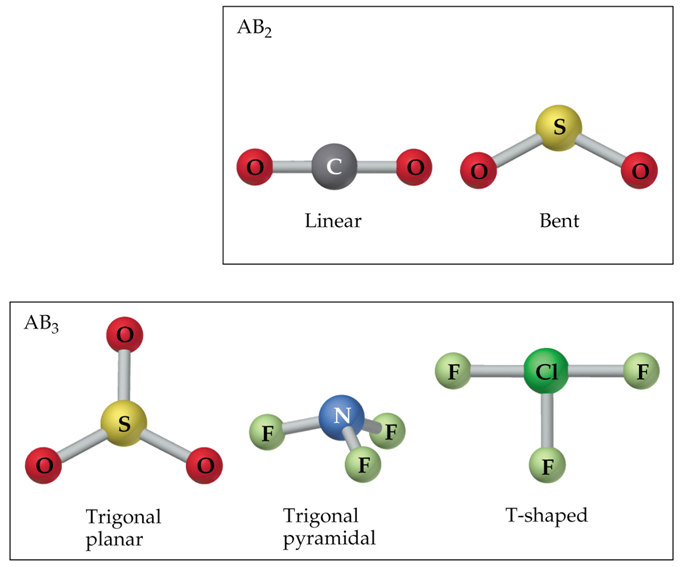
Teoría Valence Shell Electron Pair Repulsion (VSEPR)
•Para determinar a forma dunha molécula débense distinguir sobre o átomo central:
- os electróns dos pares libres ou pares non enlazantes,
- os electróns de enlace ou pares enlazantes (entre os átomos unidos).
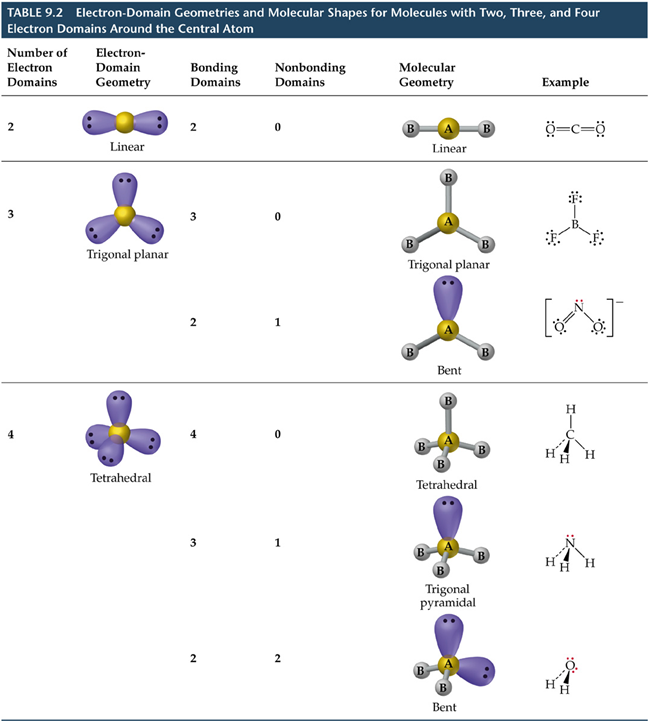
•Defínese a xeometría dos dominios de electróns pola posición no espazo de TODOS os pares de electróns (de enlace e non enlazantes)
•Os electróns adoptan una localización no espazo de xeito de minimizar la repulsión e- e-.
Teoría Valence Shell Electron Pair Repulsion (VSEPR)
Para determinar a xeometría dos dominios de electróns:
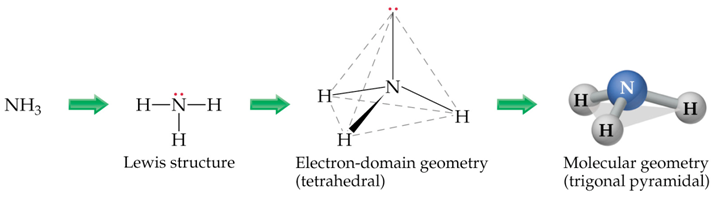
a) Debuxar a estrutura de Lewis da molécula,
b) Contar o número total de pares de electróns ao redor do átomo central.
c) Acomodar espacialmente os pares de electróns para minimizar a repulsión e--e-.
d) contar os enlaces múltiples como unha única rexión.
e) A intensidade da repulsión ordénase segundo:
par libre-par libre > par libre- par de enlace> par de enlace- par de enlace
Teoría Valence Shell Electron Pair Repulsion (VSEPR)
Teoría Valence Shell Electron Pair Repulsion (VSEPR)
Teoría Valence Shell Electron Pair Repulsion (VSEPR)
Teoría Valence Shell Electron Pair Repulsion (VSEPR)

Teoría Valence Shell Electron Pair Repulsion (VSEPR)
MODELO VSEPR (IV):
Moléculas con más de un átomo central

Asígnase a xeometría a cada átomo central independentemente.
Actividades

•1. Por que na táboa 1 non fixemos mención a moléculas do tipo AB?
•2. Predí a xeometría das seguintes moléculas ou ions a partir do modelo RPECV: CHCl3; SiF4; SO3; CO32-
•3. Unha forma de predicir a xeometría dunha molécula é comparala con outra isoelectrónica de xeometría coñecida. Segundo isto, e á vista das dúas actividades anteriores, que xeometría é de esperar que presente o ión SiO32-
•4. Predí a xeometría das seguintes moléculas ou ions a partir do modelo RPECV: H2S; PH3; H3O+
Hibridación

Por que necesitamos o concepto de hibridación?
Actividades

•5. Expón brevemente as analoxías e as diferenzas entre o método RPECV e a teoría de hibridación.
•6. Explica o tipo de hibridación proposto para o átomo central nas moléculas de H2O; NH3; PF3; HgCl2.
•7. Como se pode xustificar, a partir da teoría de hibridación, a distinta estrutura do C diamante e a do C grafito?
•8. Xustifica, a partir da teoría de hibridación, a xeometría triangular plana do trióxido de xofre.
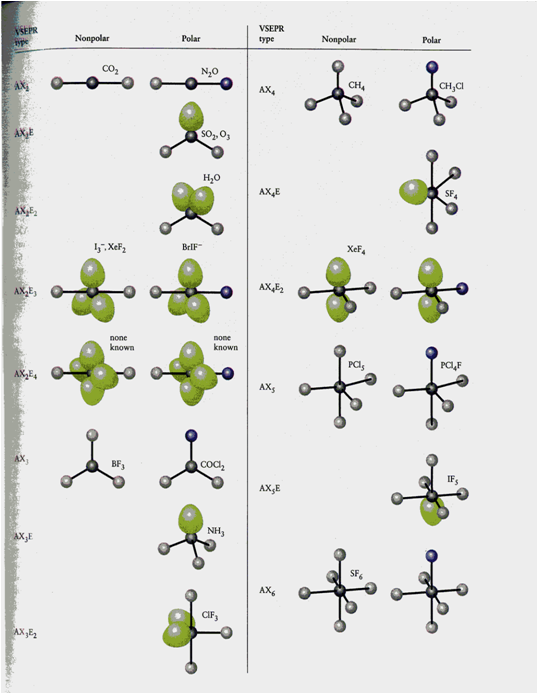
Polaridade molecular

Actividades

•11. Explica por que a molécula BeF2, malia ter dúas enlaces Be—F moi polarizados, é apolar.
•12 Predí a polaridade das seguintes moléculas: SO2, SO3, CS2, HCN, O3.
•13. A molécula de CO2 non presenta momento dipolar e, con todo, a de SO2, sí. Como se pode xustificar este aspecto cando ambas moléculas responden á mesma fórmula molecular XO2?
Forzas intermoleculares

•Enlace (ponte) de hidróxeno
• Dáse entre moléculas moi polarizadas por ser un dos elementos moi electronegativo (segundo período) e o outro un átomo de H, que ao ter “d+” e ser moi pequeno permite achegarse moito a outra molécula.
•Forzas de Van der Waals:
• Forzas de dispersión (London)
• Atracción dipolo-dipolo
Pontes de hidróxeno
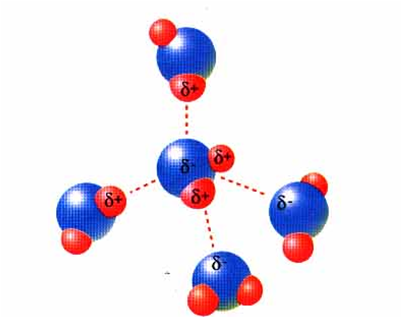
Danse ente as moléculas dos hidruros de N, O, F
Á enerxía de enlace das pontes de hidróxeno varía de 5 a 30 kJ/mol
Dipolo-dipolo
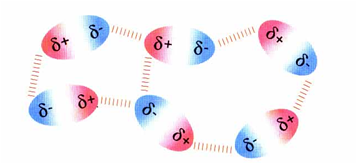
A enerxía de interacion é sensiblemente menor que no caso das pontes de hidróxeno: uns 4 kJ por mol
Dipolo instantáneo-dipolo inducido
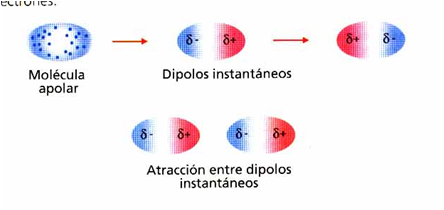
A enerxía de interación entre un dipolo e un dipolo inducido inversamente proporcional á distancia que separa os dous átomos elevada á quinta potencia.
Actividades
•14. Xustifica por que o metano é unha molécula apolar e, con todo, o clorometano,
•coa mesma xeometría, tetraédrica, é polar.
•15. Elixe, de cada un dos seguintes pares de sustancias, aquela que teña o punto de ebulición máis alto:
•a) Br2 ou ICl
•b) CH4 ou C2H6
•c) CH3F ou CH3Cl
Actividades
•16. Dadas as seguintes sustancias, NO; CCl4; C8H18:
•a) Explica o tipo de forza intermolecular que presenta cada unha.
•b) Indica o estado de agregación que é previsible esperar para elas en condicións ambientais.
•17. Dispoñemos dunha sustancia que pode ser nitróxeno, N2 ou triiodometano, CHI3. Sabendo que en condicións ambientais é un sólido, xustifica de que sustancia trátase.
•18. Das seguintes substancias, cales poden formar enlace de hidroxeno: CH4;
•CH3—CH2OH; HBr; (CH3)3N.
Actividades
•19. Razoa que sustancia terá o punto de ebulición máis alto, a auga ou o sulfuro de hidróxeno.
•20. Por que forma dímeros o ácido acético, CH3—COOH, e, con todo, non os forma a acetona, (CH3)2CO?
•21. Debuxa un esquema na formación de enlaces de hidróxeno entre as moléculas de metanol, CH3OH.
•22. Disolverase o lodo en auga? E en tetracloruro de carbono? Xustifica as respostas.
•23. Xustifica porque o metanol, CH3OH, é totalmente soluble en auga e, con todo, o n-pentanol, CH3(CH2)3 CH2OH, non o é. Disolveranse ambos en acetona?
Actividades do fin da unidade
Follas de estilo
By zorro2002
Follas de estilo
A enerxía que acompaña as reaccións químicas
- 636



