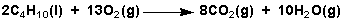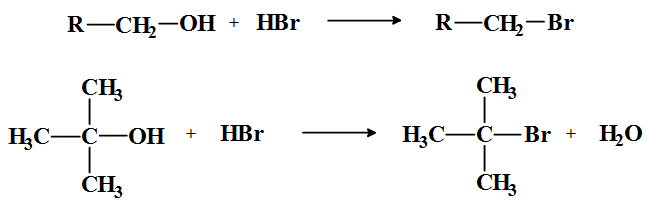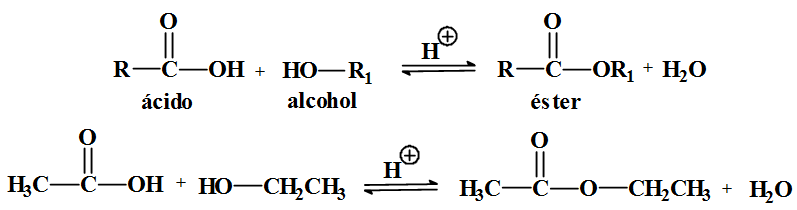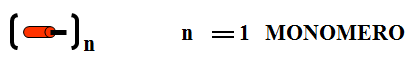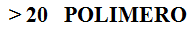Revisión Campo eléctrico 2º Bacharelato
Relator: Enric Ripoll Mira. 2018
B3.1. Campo eléctrico.
B3.2. Intensidade do campo.
B3.3. Potencial eléctrico.
B3.4. Diferenza de potencial.
B3.5. Enerxía potencial eléctrica.
B3.6. Fluxo eléctrico e lei de Gauss.
B3.7. Aplicacións do teorema de Gauss.
B3.8. Equilibrio electrostático.
B3.9. Gaiola de Faraday.
Xeración das claves pública e privada
Temos a mensaxe M, por exemplo M = 9
Eliximos dous número primos ao chou: p = 3; q = 11
Calculamos n = p · q = 33
Calculamos os dous primos relativos: (p-1)=2; (q-1)=10
Calculamos m = (p-1)·(q-1) = 20
Escollemos un número que non teña divisores comúns con 20, por exemplo o e=7
A clave pública é Kpu=(7,33)
Buscamos un número d que cumpra: 7 · d = 1 mod(20), este número pode ser 3. (xa que o resto de 21:20 é 1)
A clave privada é: Kpr = (d, n) = (3,33)
Encriptación coa clave pública
Temos a mensaxe M, por exemplo M = 9
A clave pública é: Kpu = (e, n) = (7,33)
Encriptamos a mensaxe:
C = M^7 mod(n)
C = 9^7 mod(33) = 15
Desencriptación coa clave privada
Temos a mensaxe M encriptada, C = 15
A clave privada é: Kp = (d, n) = (3,33)
Desencriptamos a mensaxe:
M = C^3 mod(n)
M = 15^3 mod(33) = 9
1. Primeiras ideas
Pensábase que todas as substancias orgánicas proviñan de seres vivos.

Foi professor da Universidade de Goettingen. Conseguiu obter pela primeira vez (1828) urea por síntese a partir do isocianato de amonio, contrariando as ideas entón en vigor de que era necesaria unha "forza vital" para a síntese dos compostos organicos.

1. Características do carbono
- Electronegatividade intermedia
- Enlaza facilmente tanto con metais como con non metais
- Posibilidade de unirse a sí mesmo formando cadeas.
- Enlaces moi fortes, despréndense 830 kJ/mol ao formar 2 enlaces C–H
- Tamaño pequeno, polo que é posible que os átomos se aproximen o suficiente para formar enlaces dobres e triplos (isto non é posible no silicio que pertence ao mesmo grupo).

1. Características do carbono

Os enlaces do carbono
O carbono ten unha capacidade inmensa para formar longas cadeas.
Debido a súa configuración electrónica, pode hibridar os seus orbitais:



Hibridación
Hibridación
2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

2. Hidrocarburos

3. Funcións orgánicas

3. Funcións orgánicas

3. Funcións orgánicas

4. Funcións orgánicas: características

4. Funcións orgánicas: características

4. Funcións orgánicas: características

4. Funcións orgánicas: características

4. Funcións orgánicas: características

4. Funcións orgánicas: características

4. Funcións orgánicas: características

4. Funcións orgánicas: características

4. Funcións orgánicas: características

5. Funcións orgánicas: orde de preferencia


6. Nomenclatura con grupos funcionais

6. Nomenclatura con grupos funcionais: os alcois

6. Nomenclatura con grupos funcionais: os éteres

6. Nomenclatura con grupos funcionais: aldehidos

6. Nomenclatura con grupos funcionais: cetonas

6. Nomenclatura con grupos funcionais: ácidos

6. Nomenclatura con grupos funcionais: ácidos

6. Nomenclatura con grupos funcionais: ésteres e sales

6. Nomenclatura con grupos funcionais: aminas
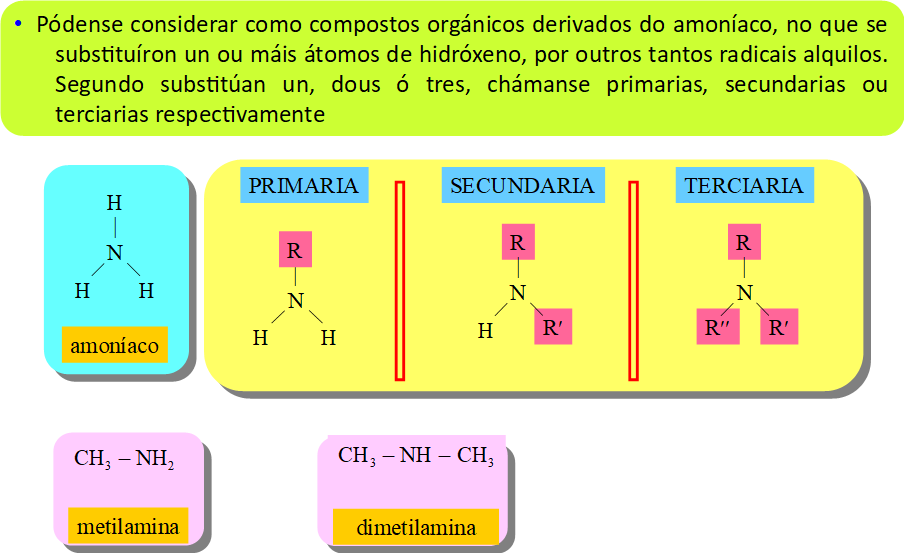
6. Nomenclatura con grupos funcionais: amidas

6. Nomenclatura con grupos funcionais

7. Isomería

Clasificación das substancias con carbono
- Variedades alotrópicas do carbono
- Compostos inorgánicos
- Compostos orgánicos
- Polímeros
- Naturales
- Sintéticos


Actividades
1. Explica brevemente que entendemos por variedades alotrópicas cristalinas. O osíxeno presenta dúas variedades alotrópicas aínda que non cristalinas; saberías dicir cales son?
2. Busca a diferenza entre adsorber e absorber, investiga sobre as aplicacións na sociedade do carbón activo e prepara un breve escrito para expoñer ante os teus compañeiros e compañeiras.
3. No pé da figura da esquerda dixemos que a chuvia ácida «ataca» e destrúe os monumentos feitos de pedra caliza. Busca o tipo de cambio, físico ou químico, que ten lugar.
4. Dentro dos polímeros sintéticos, ocupan un lugar relevante os plásticos. Busca información de por que se lles chama así e nomea algún máis dos aquí sinalados.
O átomo de carbono
- Configuración electrónica
- Cadeas carbonadas
- Carbonos primarios, secundarios...
- Representación de moléculas orgánicas
- F. condensadas
- F. expandidas
- Modelos moleculares


Actividades
5. Utilizando o código numérico que se recolle nas figuras, indica nestes compostos os átomos de carbono primarios, secundarios, terciarios e cuaternarios.


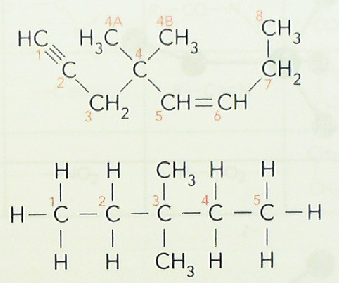
Podes visualizar os modelos moleculares de distintos compostos de carbono sinxelos.
3. Grupos funcionais e series homólogas
- Grupo funcional
- Serie homóloga
- Propiedades dos compostos dunha serie
- Compostos orgánicos
- Compostos polifuncionais
Grupos funcionais e series homólogas

Grupos funcionais e series homólogas


Grupos funcionais e series homólogas


Actividades
Identifica a función ou funcións que aparecen nos segulntes compostos:
a) CH3COOH.
b) CH3CH=CHCHO.
c) HCHO.
d) CH3COCH2CH3.
e) CH3OCH3.
f) CH3CH2NH2·
g) CH20H,CH2CH20H.
h) CH3-C≡N.
4. Regras xerais de formulación e nomenclatura

4. Regras xerais de formulación e nomenclatura

4. Regras xerais de formulación e nomenclatura

4. Regras xerais de formulación e nomenclatura
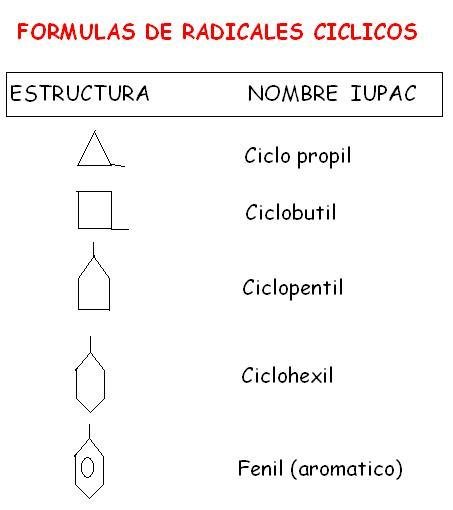
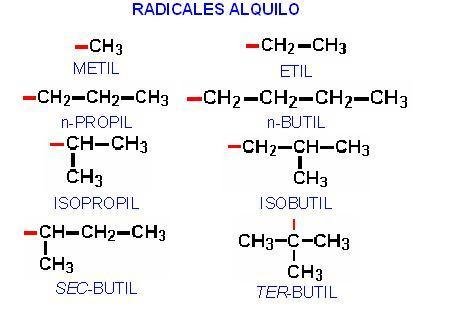
Actividades
7. Escribe a fórmula semidesenvo/vida dun comosto con catro átomos de e que conteña:
a) Un grupo hidroxilo.
b) Un grupo amino.
c) Un grupo carboxilo.
8. Podería existir un hidrocarburo, composto de e e H, co nome de 2-etil-propano? Por que?
Podes atopar contidos que completan as regras dadas nesta epígrafe.
5. Hidrocarburos
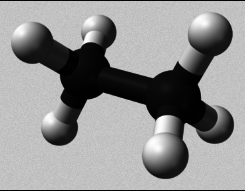
- Os hidrocarburos son compostos orgánicos formados por carbono e hidróxeno.
- Os enlaces covalentes entre dous átomos de carbono poden ser sinxelos, duplos ou triplos, segundo compartan un, dous ou tres pares de electróns, se todos os enlaces C-C son sinxelos, os hidrocarburos denomínanse alcanos ou hidrocarburos saturados. Se as moléculas conteñen un ou máis dun enlace duplo ou triplo entre dous átomos de carbono, os hidrocarburos denomínanse insaturados.
Hidrocarburos saturados (alcanos)
- Propiedades físicas
- Os hidrocarburos son substancias pouco polares ou non polares (as forzas entre as súas moléculas son de Van der Waals). A falta de polaridade é xeral nos hidrocarburos, e iso fai que sexan practicamente Insolubles en auga, xa que esta é un disolvente moi polar. Pola contra, son solubles noutros disolventes orgánicos como o benceno, o éter, o cloroformo, a acetona, etc.
- Propiedades químicas
- Os hidrocarburos saturados son quimicamente moi estables. A escasa capacidade de reacción débese á pouca polaridade das moléculas e a que os enlaces C-C e C-H son moi fortes.
- No entanto, sí que reaccionan fronte a axentes oxidantes (reaccións con o oxíxeno, cloro...)
Hidrocarburos saturados
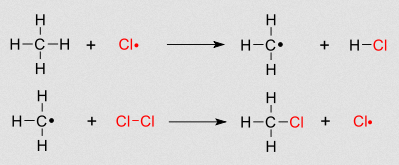
- Reaccións
- Cos halóxenos e en presencia de luz producen reaccións de substitución. Así, ao reaccionaren co cloro, un átomo de hidróxeno substitúese por un de oxíxeno:
- Todos os hidrocarburos son combustibles e arden en presenza de oxíxeno:
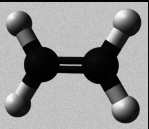
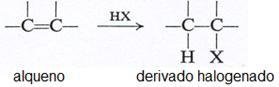
Hidrocarburos etilénicos (alquenos)
- Obtención
- Actualmente obtéñense por cracking (rotura) das fraccións lixeiras do petróleo. )
- Propiedades físicas
- Os puntos de fusión e ebulición aumentan a medida que crece a lonxitude da cadea tal como ocorre cos hidrocarburos saturados. Son insolubles en auga e menos densos ca esta.
- Propiedades químicas
- A presencia dun enlace ou máis confire unha gran reactividade química. A reacción máis característica é a adición ao duplo enlace:
Actividades
- 2.-Dado el siguiente compuesto, identifica el tipo de hibridación que utiliza cada átomo de C, así como cuáles de ellos son carbonos primarios, secundarios, terciarios o cuaternarios:
- 13. O acetileno e o benceno teñen a mesma fórmula empírica; con todo,mentres que o primeiro é moi reactivo, o segundo non o é. Explícao.
6. O petróleo

6. O petróleo como materia prima






Codificación
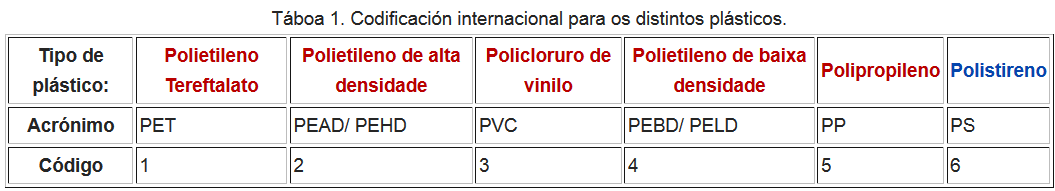
- Existe unha grande variedade de plásticos e para clasificalos existe un sistema de codificación que se mostra na Táboa 1.
- Os produtos levan unha marca que consiste no símbolo internacional de reciclaxe co código correspondente no medio segundo o material específico.
7. O gas natural
Que é? O cheiro
Orixe e obtención
Coma combustible
O metano; hidratos de metano


Actividades
13.-Contesta brevemente as seguintes preguntas:
- Por que cheira mal o gas natural doméstico?
- Que vantaxe te licuar o gas natural?
- Que é o hidrato de metano? Por que arde certo tipo de xeo?
14. Busca información sobre a localización dos principais depósitos de gas natural no noso planeta e constata se nalgunha ou nanlgunhas desas zonas hai conflictos bélicos. Valora entón como pode verse afectado o fornecemento de gas natural a outros lugares.
8. Outros compostos de carbono. Compostos oxixenados: Alcois, fenois e éteres
- Propiedades físicas
- Os alcois son compostos incoloros e os primeiros termos son líquidos. A molécula dos alcois, como xa se indicou, é polar, pero a polaridade decrece nos alcois superiores porque, ainda que teñen o grupo -OH polar, o resto da molécula non o é, e por iso que os alcois con poucos átomos de carbono son solubles en auga, mentres que os de masa molecular elevada non o son
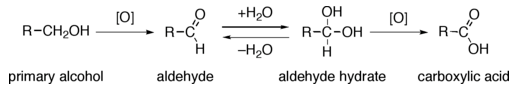
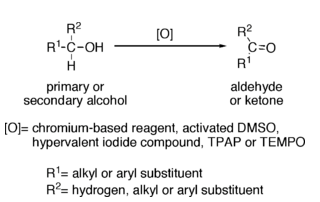
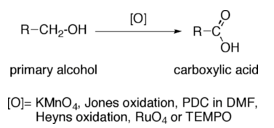
Reaccións dos alcois: oxidación a aldehídos e cetonas
Reaccións dos alcois: con HCl e HBr
Reaccións dos alcois: esterificación
Actividades
15.Formula ou nomea, segundo corresponda, os seguintes compostos osixenados:
- 2,4-pentanodiol
- 3-metilfenol
- Metanoato de metilo
- Ácido 2-metilbutanoico
- Etilpropiléter
- 2-butenal
- 3-metilo-2-heptanona
- CH3-CO-CH2-CH2-CH3
- CH3-CH(CH3)-COOH
- CH3-(CH2)4-CHO
- CH3-CO-CH=CH-CH3
-
Propiedades dos compostos osixenados
As pontes de hidróxeno coa auga
-
Propiedades dos compostos nitroxenados
Aminas e amidas:
- Básicas
- Pontes de hidróxeno
- Polaridade
Actividades
15.Formula ou nomea, segundo corresponda, os seguintes compostos osixenados:
- Trimetilamina
- Dietilamina
- Acetamida
- N-metilpropilamina
- N-etilpropanamida
- 3-metilbutanamida
- CH3CH2CH2CONH2
- (CH3CH2)3N
- HCONHCH3
- C6H5CONHCH3
- CH3CH2CH2N(CH3)2
Derivados haloxenados
Actividades
17.-Formula:
a) Fluoroetano
b) Triclorometano
c) 1,1-dicloroetano
d) 2-cloro-2-metilpentano
e) 3,4-diclorohex-1-eno
f) Cloruro de isopropilo
g) o-clorometilbenceno
h) 1,2 dicloroeteno
i) Tetrafluoroeteno (teflón)
18.-Nomea:
a) CH3-CHBr-CH3
b) CH2=CHCl
c) CH2Br-CH=CHBr
d) e)


Ácidos orgánicos
- Propiedades
- Os primeiros termos son líquidos solubles en auga. O punto de ebulición aumenta coa masa molecular. Son ácidos débiles e a súa forza de acidez diminúe ao aumentar a lonxitude da cadea carbonada.
- Obtención:
- Como acabamos de ver, os ácidos obtéñense a partir da oxidación de aldehídos, cetonas ou alcois.
- A oxidación do alcol, CH3-CH2OH, do viño a ácido acético, CH3-COOH, é a causa de que o viño se transforme en vinagre.
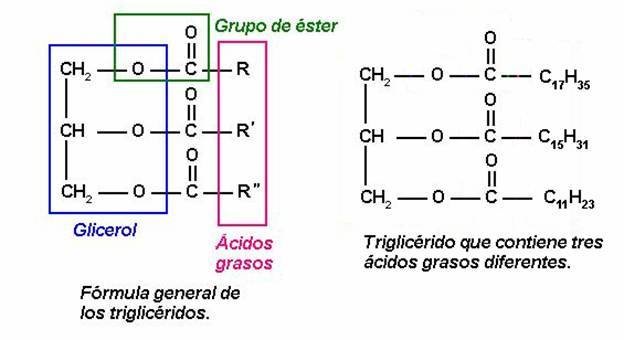
Os ésteres
- Son compostos de fórmula xeral: R-COOR'
- Observa que os ésteres pódense considerar derivados dos ácidos carboxílicos: nos que o hidróxeno protonizable foi substituido por un radical alquílico R'.
- Obtención e propiedades
- Os ésteres obtéñense facendo reaccionar un alcoI cun ácido. O proceso denominase esterificación. Os ésteres de peso molecular baixo son líquidos de olor agradable e insolubles en auga. O aroma das flores e as froitas debese en parte aos ésteres volátiles que conteñen.
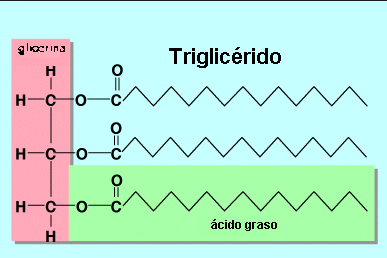
Ésteres importantes
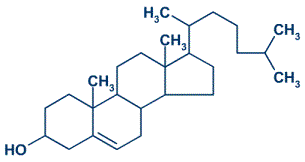
- Graxas e aceites
- Ésteres procedentes do glicerol e dun ácido carboxílico de peso molecular medio ou elevado.
- As graxas, que son esteres sólidos, e os aceites, que son líquidos, denomínanse frecuentemente glicéridos.
- Ceras
- Ésteres resultantes da combinación entre un alcohol e un ácido carboxibco, ambos de peso molecular elevado.
- Un exemplo típico de cera natural é a producida polas abejas, que a utilizan para construír o panal.
9 Isomería
- Dous compostos son isómeros cando, sendo diferentes, responden á mesma fórmula molecular

Isomería estrutural ou constitucional
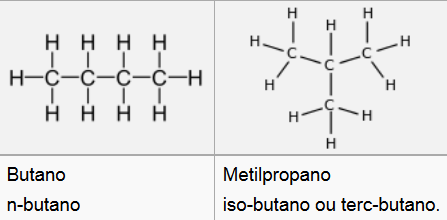
Isomería de cadea
- Varía a disposición dos átomos de C na cadea ou esqueleto carbonado, é dicir, a estrutura deste, que pode ser liñal ou ter distintas ramificacións.
- Por exemplo o C4H10 corresponde tanto ao butano como ao metilpropano (isobutano):
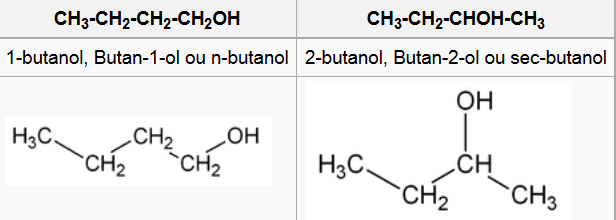
Isomería de posición
- Preséntana aqueles compostos que posúen o mesmo esqueleto carbonado pero nos que o grupo funcional ou o substituínte ocupa diferente posición.
- Por exemplo, a fómula molecular C4H10O pode corresponder a dúas substancias isómeras que se diferencian na posición do grupo OH: o 1-butanol e o 2-butanol.
Isomería de función
Esteroisomería
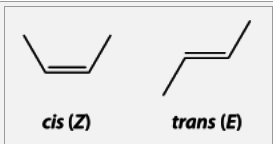
Xeométrica (cis-, trans-)
- Prodúcese cando hai dous carbonos unidos con dobre enlace que teñen as outras valencias cos mesmos substituíntes (dous pares) ou con dous iguais e un distinto.
- É característica dos enlaces dobres e dos ciclos e non se presenta isomería xeométrica ligada aos enlaces triplos ou sinxelos.
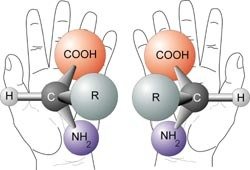
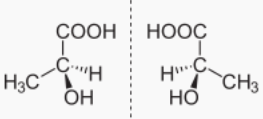
Óptica
- Cando un composto ten polo menos un átomo de carbono asimétrico ou quiral, é dicir, un átomo de carbono con catro substituíntes diferentes, poden formarse dúas variedades distintas chamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas ou formas quirais, aínda que todos os átomos están na mesma posición e enlazados de igual maneira.
Isomería óptica
- Os isómeros ópticos non se poden superpoñer e un é como a imaxe especular do outro, como ocorre coas mans dereita e esquerda. Presentan as mesmas propiedades físicas e químicas pero diferéncianse en que desvían o plano da luz polarizada en diferente dirección:
- un isómero desvía a luz polarizada cara á dereita (no sentido das agullas do reloxo) e represéntase co signo (+): é o isómero dextroxiro ou forma dextro;
- o outro isómero óptico desvíaa cara á esquerda (no sentido contrario ás agullas do reloxo) e represéntase co signo (-) (isómero levoxiro ou forma levo).
Actividades
19. Escribe a fórmula semidesenvolvida e nomea dous isómeros dos seguintes compostos:
a) 1-iodobutano
b) 1-pentanol
c) 2-hexanona
d) Metilciclobutano
20. Indica o tipo de isomería que presentan os seguintes compostos e escribe a fórmula semidesenvolvida dos compostos citados:
a) 2-butanol e dietiléter
b) Octano e 2,2,4-trimetilpentano
c) 2-pentanona e 3-pentanona
Actividades
21. Escribe a fórmula semidesenvolvida e o nome de todos os isómeros posibles con fórmula:
a) C4H10
b) C3H8O
c) C4H11N
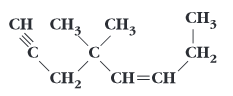
22. A figura mostra os modelos moleculares de dous compostos.
a) Identifícaos, escribindo a súa fórmula e o seu nome
b) Indica o tipo de isomería que presentan.


Formas alotrópicas do carbono
Lectura do libro

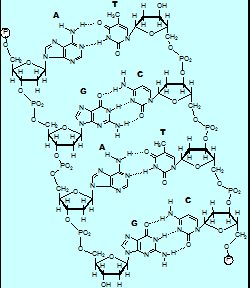
Polímeros
Definición
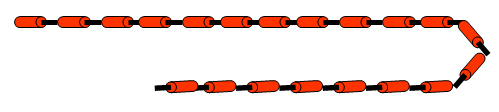
- Un polímero é unha macromolécula formada pola unión de moléculas de menor tamaño que se coñecen como monómeros
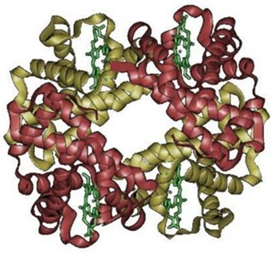
Polímeros naturais
- Entro os polímeros naturais máis importantes encontramos:
- - Proteínas
- - Polisacáridos
- - O DNA
- -Lípidos
Polímeros sintéticos
- Os polímeros sintéticos o artificiales son os fabricados porlo home. Clasifícanse en:
- Termoplásticos: polietileno, PVC, PS
- Elastómeros: caucho
- Termorrígidos: baquelita
- Fibras: poliéster, nylon (poliamida)
Plásticos
- Un plástico é un material polimérico. O termo vén do grego πλαστικός (plastikos), "apto para moldaxe", de πλαστός (plastos) "moldeado" [1] [2]. Isto refírese á súa plasticidade durante o procesado, que permite o uso dunha gran cantidade de métodos de conformado, porén moitos plásticos xa procesados non presentan comportamento plástico (isto é, rompen sen se deformaren previamente).
Clasificación segundo o comportamento fronte a temperatura
Termoplásticos
- Un termoplástico é un plástico que a temperatura ambiente é plástico ou deformábel, derrétese cando é quentado e endurécese nun estado vítreo cando é suficientemente arrefriado.
- Os principais son:
- Polietilenos e derivados: empregan como materia prima o etileno obtido do craqueo do petróleo, o PVC, o polistireno, o metacrilato etc.
Termoestábeis
- Os plásticos termoestábeis son materiais que unha vez que sufriron o proceso de arrequecemento-fusión e formación-solidificación, convértense en materiais ríxidos que non volven fundirse.
- Baquelita.
- Poliésteres
Clasificación segundo o método de síntese
- Polímeros de adición
- Implican sempre a ruptura ou apertura dunha unión do monómero para permitir a formación dunha cadea. (PE, CH2=CH2; PVC,ClHC=CH2;PS,Phe-CH=CH2;Caucho)
- Exemplo:
- 2n H2C=CH2 → [-CH2-CH2-CH2-CH2-]n
- Polímeros de condensación
- Son aqueles nos que a reacción ten lugar entre grupos funcionais reactivos presentes nos monómeros. Debe ter, cando menos, dous grupos reactivos por monómero para darlle continuidade á cadea. (poliamidas, poliésteres,PET)
- Exemplo:
- R-COOH + R'-OH → R-CO-OR' + H2O
Clasificación segundo o método de síntese
- Polímeros de adición
- Implican sempre a ruptura ou apertura dunha unión do monómero para permitir a formación dunha cadea. Na medida que as moléculas son máis longas e pesadas, a cera parafínica vólvese máis dura e máis resistente.
- Exemplo:
- 2n H2C=CH2 → [-CH2-CH2-CH2-CH2-]n
- Polímeros de condensación
- Son aqueles nos que a reacción ten lugar entre grupos funcionais reactivos presentes nos monómeros. Debe ter, cando menos, dous grupos reactivos por monómero para darlle continuidade á cadea.
- Exemplo:
- R-COOH + R'-OH → R-CO-OR' + H2O
Campo eléctrico 2º Bacharelato
By zorro2002
Campo eléctrico 2º Bacharelato
- 494