Conceptos de Química
Relator: Enric Ripoll Mira. 2018
1. A maioría dos materiais son mesturas
A mestura é unha combinación de dúas ou máis sustancias nas que cada sustancia conserva as súas propiedades.
A maioría dos materiais que atopamos son mesturas: mesturas de elementos, mesturas de compostos, ou mesturas de elementos e compostos.
O aceiro inoxidable, por exemplo, é unha mestura dos elementos de ferro, cromo, níquel e carbono.
A auga de Seltzer é unha mestura do composto líquido auga e composto gaseoso dióxido de carbono.
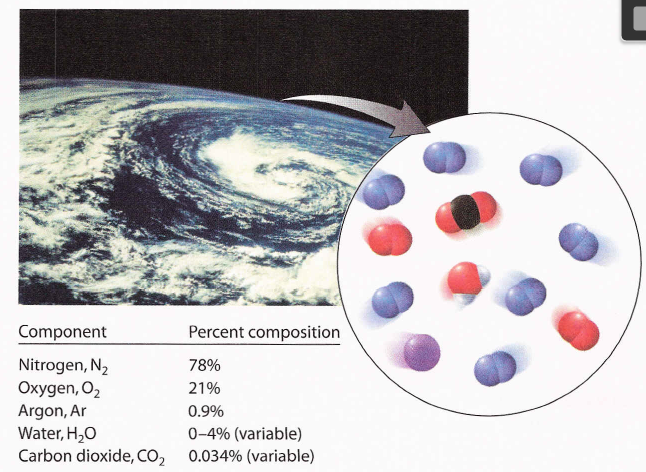
A nosa atmosfera é unha mestura dos elementos nitróxeno, osíxeno e argón ademais de pequenas cantidades de compostos como o dióxido de carbono e o vapor de auga.
A auga do grifo é unha mestura que contén principalmente auga, pero tamén moitos outros compostos.

Pregunta
Até agora, aprendiches que hai tres tipos de materia: elementos, compostos, e mesturas.
Que caixa de debaixo contén só un elemento?
Cal contén só un composto?
Cal contén unha mestura?
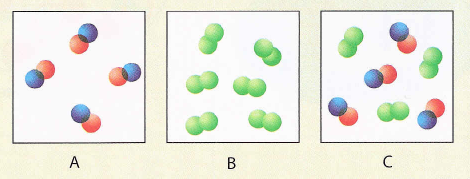
Resposta
¿Foi esta a túa resposta?
As moléculas da caixa A conteñen dous diferentes tipos de átomos e son representativas dun composto.
As moléculas na caixa B consta dos mesmos átomos e por iso son representativas dun elemento.
A caixa C é unha mestura de composto e de elemento.
Observa como as moléculas do composto e as do elemento
permanecen intactos na mestura. É dicir, despois da formación da mestura, non hai intercambio de átomos entre os compoñentes.
Os químicos clasifican a materia como pura ou impura
Se un material é puro, consiste só nun único elemento ou nun único composto.
En ouro puro, por exemplo, non hai máis que o elemento ouro. En sal de mesa pura, non hai máis que o cloruro de sodio composto.
Se un material é impuro, é unha mestura e contén dous ou máis elementos ou compostos.
As mostras poden ser "purificadas" por varios métodos, porén, como a destilación. Cando dicimos puro, enténdese que é un termo relativo. Comparando a pureza de dúas mostras, o máis puro contén
menos impurezas. Unha mostra de auga que é 99.9% pura ten un maior grao de impurezas que outra que ten 99.99999%

A parte por millón
Unha maneira habitual de indicar a pureza dunha substancia é a parte por millón (normalmente en masa.
Os niveis típicos de fluoruro que se atopan na auga potable pública fluorada é de aproximadamente 0,1 ppm. Se bebemos un cuarto de litro (250 ml) desta auga, cantos microgramos de fluoruro se inxerirían?

As leis da química
- Lei de Lavoisier
- Lei das proporcións definidas
- Lei das proporcións múltiples
- Lei de Gay-Lussac




As leis dos gases
- Lei de Charles
- Lei de Boyle
- Lei de Avogadro
- Lei de Gay-Lussac




A hipótese de Avogadro
En 1811, o físico e avogado italiano Amadeo Avogadro (1776-1856) deu unha brillante explicación para os resultados experimentais de Gay-Lussac.
Avogadro supoñía que as partículas fundamentais do hidróxeno e o osíxeno non eran átomos, senón moléculas diatómicas, onde o termo diatómico indica dous átomos.
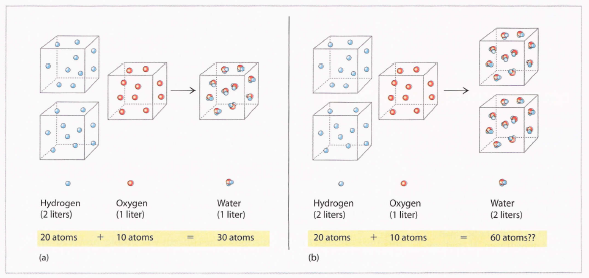
A hipótese de Avogadro
En 1811, o físico e avogado italiano Amadeo Avogadro (1776-1856) deu unha brillante explicación para os resultados experimentais de Gay-Lussac.
Avogadro supoñía que as partículas fundamentais do hidróxeno e o osíxeno non eran átomos, senón moléculas diatómicas, onde o termo diatómico indica dous átomos.
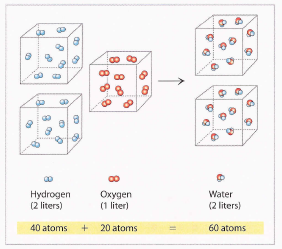
A solución de Avogadro
A hipótese de Avogadro
- O mol
- Número de avogradro
- Factores de conversión

A solución de Avogadro
El mol

Composición porcentual.
Determinación de fórmulas
Un composto está representado pola súa fórmula química, na que os símbolos dos elementos están escritos xuntos. A fórmula química do cloruro de sodio é NaCl e a do amoníaco é NH3. Os subíndices numéricos indican a proporción na que se combinan os átomos. Por convención, enténdese o subíndice 1 e omitido. Así, a fórmula química NaCl nos di que no sodio composto cloruro hai un átomo sodio para cada átomo de cloro, e a fórmula química NH3 dinos que no amoníaco hai un átomo de nitróxeno por cada tres átomos de hidróxeno.
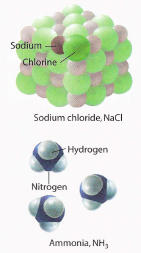
Composición porcentual.
Determinación de fórmulas
Para determinar a fórmula empírica dun composto, podemos partir da súa composición porcentual en masa convertendo as porcentaxes nunha masa determinada e a partir de aí calcular os moles de átomos correspondentes de cada elemento. Por exemplo: a composición do metano en masa é de 75% en C e 25% en H.
Si tomásemos 100 g deste composto, teríamos 75 g de C e 25 g de H, polo tanto os moles de átomos de cada un serían:

Dividimos polo menor... CH4
Composición porcentual.
Determinación de fórmulas

Determinación de fórmulas
Determinación de fórmulas

Leyes de los gases
Determinación de fórmulas


Mezclas de gases
Ley de Dalton

Mezclas de gases
Ley de Dalton



Que é unha solución?
Unha solución ten unha única fase
Mestura homoxénea
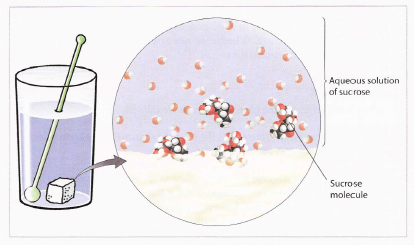
¿Que pasa cando o azucre de mesa, coñecido quimicamente como sacarosa, é axitado na auga?
¿É destruída a sacarosa? Sabemos que non é porque se adoza a auga.
A sacarosa desaparece porque de algunha maneira deixa de ocupar espazo ou porque encaixa dentro dos recunchos da auga?
Non é así, porque a adición de sacarosa cambia o volume. Isto pode non ser notábel nun principio, pero continúa engadindo sacarosa a un vaso de auga e verás que o nivel de auga sobe do mesmo xeito que se estiveses agregando area.
A sacarosa disolta en auga perde a súa forma cristalina. Cada cristal de sacarosa consiste de miles de millóns de millóns de moléculas de sacarosa embaladas xuntos. Cando o cristal está exposto á auga establécense pontes de hidróxeno entre a sacarosa e as moléculas de auga e, coa axitación térmica, fica disolta.
Disolucións
Unidades:
Molaridade,
Molalidade,
Normalidade,
% en masa
% en volume
Fracción molar
ppm
Na solución chamada ar, cal é o soluto e o disolvente?
Disolucións


Disolucións


Cálculos estequiométricos
A estequiometría é a ciencia do cálculo da cantidade de reactivos
ou produtos en calquera reacción química.
É un método que se desenvolve moito máis aló dos cursos de química xeral. Por suposto, todo o que tes que facer é estar familiarizado co que se trata a estequiometría, que é manter o número de átomos e moléculas a medida que reaccionan para formar produtos.
A ecuación química: significado
Actividades
- O carburo de calcio, CaC 2, reacciona co auga para dar hidróxido de calcio e acetileno. Calcula os gramos de CaC 2 necesarios para obter 10 L de acetileno, a 5 °C e 700 mmHg.
- Calcula a pureza, expresada en % en masa, dunha mostra de sulfuro de ferro (II) sabendo que, ao tratar 0.50 g de mostra con HCl (en exceso), despréndense 100 mL de sulfuro de hidróxeno gas, medidos a 27 °C e 760 mmHg. (O outro produto da reacción é cloruro de ferro (II)).
- Mestúranse 10 mL de H 2SO 4 ao 98% en masa e densidade 1.84 g/mL con 60 g de cinc. Sabendo que o rendemento da reacción é do 45%, calcula os litros de hidróxeno, medidos a 20 °C e 705 mmHg, producidos na reacción.
- Fanse reaccionar 100 mL dunha disolución 0.5 M de hidróxido de calcio con 100 mL doutra disolución 0.5 M de ácido nítrico. Calcula os gramos de nitrato de calcio que se forman.
- Nun recipiente pechado e baleiro de 20 L introdúcense 0.3 g de etano, 2.9 g de butano e 16 g de osíxeno, producíndose a combustión a 225 °C. Calcula a composición en gramos da mestura final.



Actividades

Termoquímica
¿Qué es?
La entalpía
El ciclo (la ley) de Hess

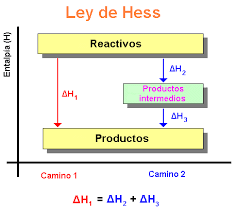
La entalpía
El ciclo (la ley) de Hess

La entropía

Ludwig Eduard Boltzmann
La entropía

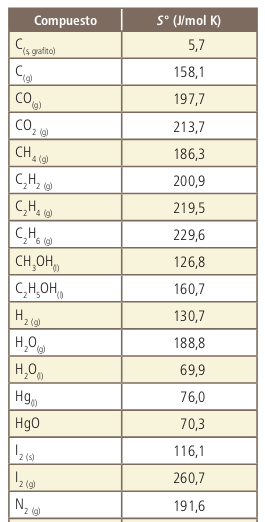
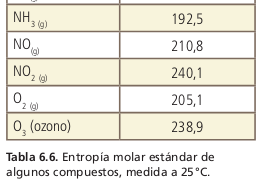
La energía libre de Gibbs

La energía libre de Gibbs

Prácticas de laboratorio
Prepárate bien los ejercicios del cuadernillo del tema previo

Actividades
- A masa atómica da prata atopada nas táboas é 107,87 u. determinade a abundancia relativa dos dous isótopos, sabendo que súas masas son 108,90 e 106,91 u. Pista: lembra o concepto de media ponderada.
- Cantos átomos de cloro hai en 1,00 g desta substancia? Tendo en conta os átomos de cloro como esferas de raio 9,9· m, se os aliñásemos un despois do outro, que lonxitude tería a liña formada?
-
Calcula os átomos de osíxeno nunha sala de 4,8 m × 3,5 m × 2,2 m, con as condicións atmosféricas de 20 º C e 740 mm Hg. Supor o ar que contén 21% de osíxeno en moles.
-
Un matraz de vidro baleiro pesa 17,7248 g. Cheo de hidróxeno, H2, pesa 17,7660 g, e cun gas descoñecido, baixo as mesmas condicións de p e T, 18,5462 g. Calcula:
a) A masa molecular do gas descoñecido.
b) A densidade relativa ao hidróxeno.
c) Se en cn 22,4 L de ar pesan 29 g, canto pesará o matraz cheo de aire na mesmas condicións que antes?
Sol.: a) 40.19; b) 19.94; c) 18.3176
Actividades
-
Canto pesan 1.025 mol de amoníaco máis 6.02• átomos de prata? Expresa o resultado en gramos. Dato: 1 u=1.66• g.
-
Onde hai máis átomos en 1 L de metano, medido en cn, ou en 1 mol de fósforo, P4, ou en 1 g de sulfato de cromo (III)?
-
Certa cantidade de aire que ocupa 12.0 L a 50 kPa, é comprimida a unha presión 0.70 atm, mantendo a temperatura constante. Calcula o novo volume. Que lei temos aplicado?
-
Nunha reacción química prodúcese hidróxeno 12.5 medido a 20 ºC e 750 mm Hg. Se agora aumentamos a temperatura ata 35 º C, manténdose constante de presión, cal será o volume que ocupa o gas? Indica a lei que foi usada.
-
Nun matraz de 2.5 L recóllense 15 g de osíxeno e 15 g de dióxido de carbono. Sabendo que a temperatura á que se atopa a mestura é de -3 °C, calcula a presión parcial de cada gas nela, así como a presión total
Actividades
-
Téñense dous depósitos de vidro pechados, co mesmo volume e á mesma presión e temperatura. Un deles contén hidróxeno, e o outro, dióxido de carbono. Razoa a veracidade ou a falsidade das seguintes proposicións:
a) Ambos pesarán o mesmo.
b) Conterán o mesmo número de átomos.
c) Conterán o mesmo número de moléculas.
d) Ningunha das anteriores é certa. -
Disponse de tres recipientes nas mesmas condicións de presión e temperatura.
O primeiro contén 1 L de CH4; o segundo, 2 L de N2, e o terceiro, 1,5 L de O3. Razoa: a) cal contén maior número de moléculas; b) cal contén maior número de átomos; c) cal ten maior densidade. -
Sabendo que a composición dos gases maioritarios do aire, expresada en porcentaxe en volume moles, é: 78.09% N2, 20,95% O2, 0,93% Ar e 0,03% CO2:
Calcula a composición do aire en fracción molar e en porcentaxe en masa.
Si a presión parcial de nitróxeno é 540 mmHg, calcula a presión parcial de cada un dos restantes gases.144.9 mmHg O2; 6.4 mmHg Ar; 0.2 mmHg CO2
Actividades
-
Unha mostra de 1,28 g dunha sustancia se vaporizou nun matraz de 250 mL a 90 °C. Sabendo que a presión exercida polo gas é de 786 mmHg, determina a masa molecular de devandita sustancia.
Sol.:147.36 u
-
Acha a masa molecular dun gas, cuxa densidade, a 27 °C e 780 mmHg, é 1,35 g/L.
Actividades
- Determina a composición centesimal da sacarosa, C12H22O11. Que masa de sacarosa é necesaria para ter 10 g de C?
- O etilenglicol é un composto de C, H e O moi utilizado como anticonxelante e na fabricación de fibras de poliéster. A combustión completa de 6,38 mg de sustancia orixinou 9,06 mg de CO2 e 5,58 mg de H2O. Determina a súa fórmula empírica.
- Un certo anestésico contén 64.9% de C, 13.5% de H e 21.6% de O. A 120 °C e 750 mmHg, 1,0 L do composto gasoso pesa 2,3 g. Acha a súa fórmula molecular.
- Determina a fórmula molecular dun composto que contén C, H e O, sabendo que:
- En estado de vapor, 2 g do composto recollidos sobre auga a 715 mmHg e 40 °C ocupan un volume de 800 mL.
- Ao queimar completamente 5 g de composto, obtéñense 11,9 g de dióxido de carbono e 6.1 g de auga. Dato: pvapor H2O (40 °C) 55 mmHg
Experimento caseiro
Que hai nun vaso de auga?
Imos separar os compoñentes da auga da billa para descubrilo.
O QUE NECESITAS
Agua da billa, espello, vaso de precipitados, isqueiro Bunsen, coitelo.
NOTA DE SEGURIDADE
Usa anteollos de seguridade para o paso 1 porque pode ocorrer algunha proxección.
PROCEDEMENTO
1. Coloca os vasos de precipitados e engade auga da billa.
Pon a auga a evaporar. (Apaga o queimador antes de que a auga desapareza. A calor da pota finalizará a evaporación).
2. Examina o residuo resultante raspándoo co coitelo.
Estes son os sólidos que inxires con cada vaso de auga que bebes.
3. Tira os gases disoltos na auga, enche un pote de cocción limpo con auga e deixa que estea a temperatura ambiente durante varias horas.
Observe as burbullas que se adhiren aos lados internos da pota.
• 2.5 Farmacias clasifican a materia como pura ou impura. De onde proviñan as burbullas do paso 3? Que supoñen que conteñen?
Actividades
- Indica como se prepararías 3 L dunha disolución de hidróxido de sodio ao 1%.
- Cal é a concentración de ións Al +3 e ións SO 4 -2 nunha disolución 0.01M da Al 2(SO 4) 3?
- Prepáranse 250 mL dunha disolución amoniacal diluíndo na cantidade de auga necesaria 5 mL de amoníaco ao 29% en masa e densidade 0,895 g/mL. Calcula: a) a concentración molar da disolución diluída; b) a fracción molar do amoníaco na mestura.
- En 1 kg de auga disólvense 727 mL de amoníaco medidos a 20 °C e 744 mmHg. Si a densidade da disolución resultante é 0.882 g/mL, calcula a súa concentración expresada en: a) g/L; b) molalidade; c) fracción molar do soluto.
- Disponse dunha disolución acuosa de hidróxido de potasio ao 26% en masa e densidade 1.25 g/cm3. Calcula o volume desta disolución necesario para preparar 100 mL de disolución de hidróxido de potasio 0.01 M.
2BAT_QUIM_01. Conceptos de Química
By zorro2002
2BAT_QUIM_01. Conceptos de Química
Revisión dos conceptos fundamentais en Química
- 897




