Termoquímica
Relator: Enric Ripoll Mira. 2020

Definición de termoquímica
Escalas termométricas.
Equivalente mecánico del calor
Variables del sistema: p,T,V,Q,W
Proceso termodinámico
Sistemas termodinámicos e paredes
Grado Fahrenheit (simbolizado como °F). Es una unidad de temperatura propuesta por Daniel Gabriel Fahrenheit en 1724, cuya escala fija el cero y el cien en las temperaturas de congelación y evaporación del cloruro amónico en agua. Similar a lo que fija la escala Celsius con la congelación y evaporación del agua.
Variables y funciones de estado
Text
En termodinámica, una función de estado es una magnitud física macroscópica que caracteriza el estado de un sistema en equilibrio, y que no depende de la forma en que el sistema llegó a dicho estado. Dado un sistema termodinámico en equilibrio puede escogerse un número finito de variables de estado, tal que sus valores determinan unívocamente el estado del sistema.
Variables y funciones de estado
Text
Variables y funciones de estado
Text
Son funciones de estado:
Energía interna
Entalpía Entropía
Sistema abierto
Sistema cerrado
Sistema cerrado
Sistema aislado
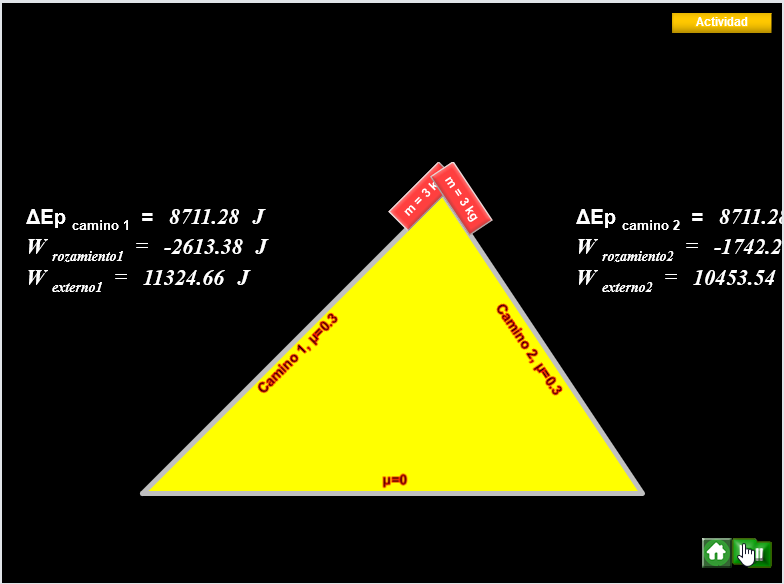
Actividades

Principio cero de la termodinámica
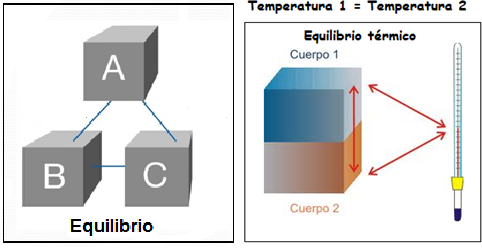
Principio cero de la termodinámica

- Isobáricos
- Isocóricos
- Isotérmicos
- Adiabático
Procesos termodinámicos
Actividades

¿Qué es una función de estado?
¿Qué es una función de estado?
¿Qué es una función de estado?
Actividades

Actividades

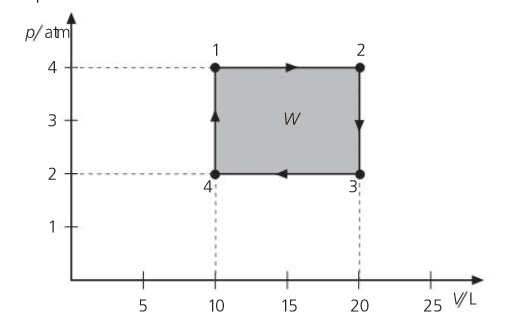
Sentido agujas reloj W<0
Error en la solución del libro: el trabajo es negativo
Actividades


¿Qué es la energía interna?
Primer Principio de la termodinámica
Hacia 1797, el conde Rumford había observado en el arsenal de Múnich, Alemania, el calor de fricción que se generaba al perforar los cañones. Rumford sumergió un cañón en un barril de agua y dispuso una herramienta de perforación especialmente embotada. Demostró que el agua podía ser hervida en cuestión de dos horas y media y que el suministro de calor de fricción era aparentemente inagotable.
Este hecho proporcionó un reto importante a las teorías establecidas de calor dio origen a la revolución del siglo XIX en termodinámica.
El experimento inspiró el trabajo del físico inglés James Prescott Joule en la década de 1840, que demostró que trabajo y calor eran interconvertibles.

Conde de Rumford

J.P. Joule
Primer Principio de la termodinámica

Conde de Rumford

J.P. Joule
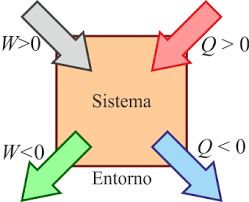
Primer Principio de la termodinámica
Actividades



Calor a volume e presión constantes
O caso dos gases
Relación entre U e H
Entalpía de reacción
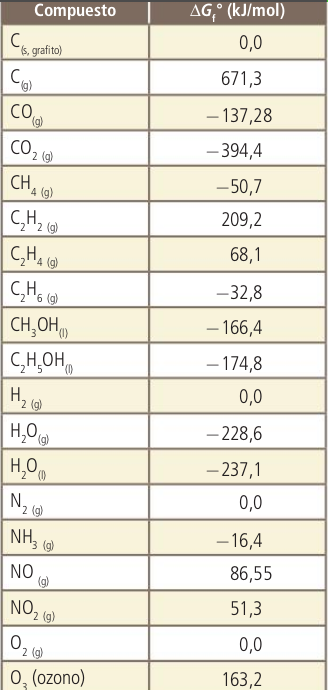
Entalpía de formación,
Entalpía de sublimación,
Entalpía de lo que sea...
Text
Condiciones estándar
La entalpía
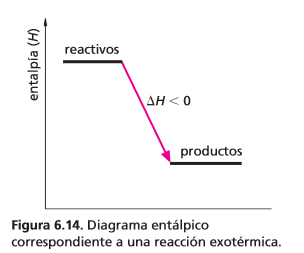
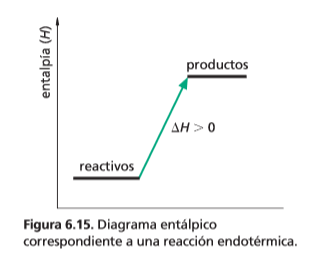

La entalpía

Entalpía dunha reacción
Concepto
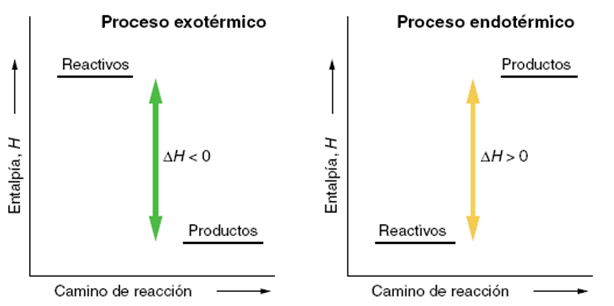
Reaccións exotérmicas e endotérmicas
Ecuacións termoquímicas
Estados estádar
Diagramas entálpicos
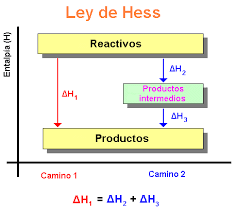
A lei de Hess
Entalpía de formación


Enerxía de enlace e entalpía de reacción
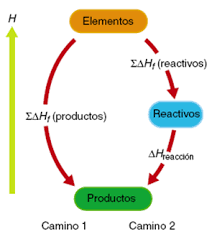
Enerxía de enlace e entalpía de reacción
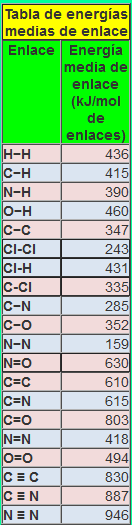
Calcula la entalpía de esta reacción:
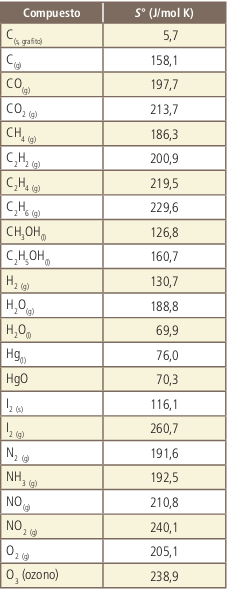
A entropía
La entropía
(Una medida del desorden)

Segundo principio de la termodinámica
Enunciado de Clausius
Enunciado de Clausius: no es posible ningún proceso, absorbiendo una cantidad de calor, realice una cantidad igual de trabajo.
Enunciado de Kelvin-Planck: no es posible proceso alguno cuyo único resultado sea transferir calor desde un cuerpo frío a otro más caliente.
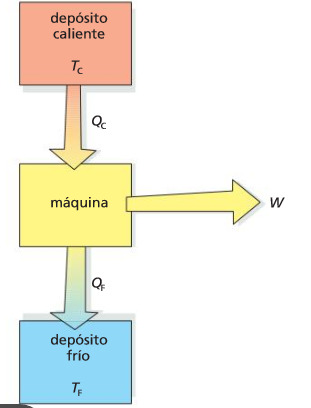
El enunciado de Kelvin-Planck afirma que es imposible construir una máquina que tenga un rendimiento del 100%. Siempre habrá calor de desecho.
Segundo principio de la termodinámica

Nota del profesor: rendimiento y eficiencia, en este contexto, son sinónimos
Segundo principio de la termodinámica
¿Y si hacemos que la máquina térmica funcione al revés?

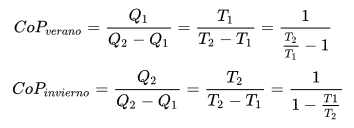
Conceptualmente el concepto de eficiencia cambia
Cop coeficiente de eficiencia
Procesos espontáneos
Enerxía libre de Gibbs
Temperatura de equilibrio
Un proceso espontáneo es capaz de proceder en una dirección dada, tal como se escribe o es descrita, sin necesidad de que dicho acto sea realizado por una fuente exterior de energía. El término es usado para referirse a procesos macroscópicos en los cuales la entropía se incrementa; tal como la difusión de una fragancia en un cuarto, la fusión de hielo en agua tibia, la disolución de sal en agua, o la oxidación del hierro.
Procesos espontáneos

Procesos espontáneos

Procesos espontáneos

La combustión
Desde el punto de vista de la teoría clásica, la combustión se refiere a las reacciones de oxidación que se producen de forma rápida, de materiales llamados combustibles, formados fundamentalmente por carbono (C) e hidrógeno (H) y en algunos casos por azufre (S), en presencia de oxígeno, denominado el comburente, y con gran desprendimiento de calor.
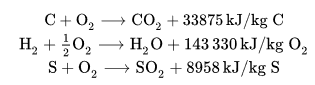
Realmente, ¿los procesos son reversibles?

Tercer principio de la termodinámica
Si la entropía de cada elemento en algún estado cristalino (perfecto) se tomáse como cero en el cero absoluto de temperatura, cada sustancia tiene una entropía finita y positiva, pero en el cero absoluto de temperatura la entropía puede llegar a ser cero y eso lo convierte en el caso de una sustancia cristalina perfecta.
Fin
Actividades do fin da unidade
1BAT_FIS_QUIM_04. Termoquímica
By zorro2002
1BAT_FIS_QUIM_04. Termoquímica
A enerxía que acompaña as reaccións químicas
- 693