Formulación inorgánica 4 ESO
Relator: Enric Ripoll 2020
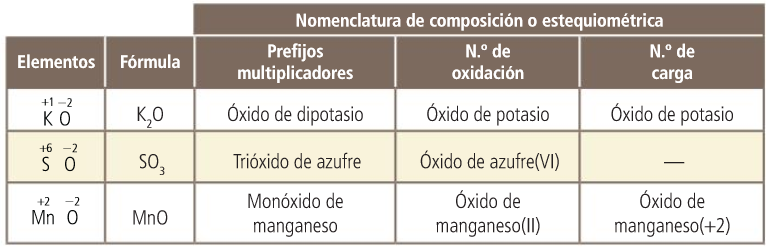
Los números de oxidación
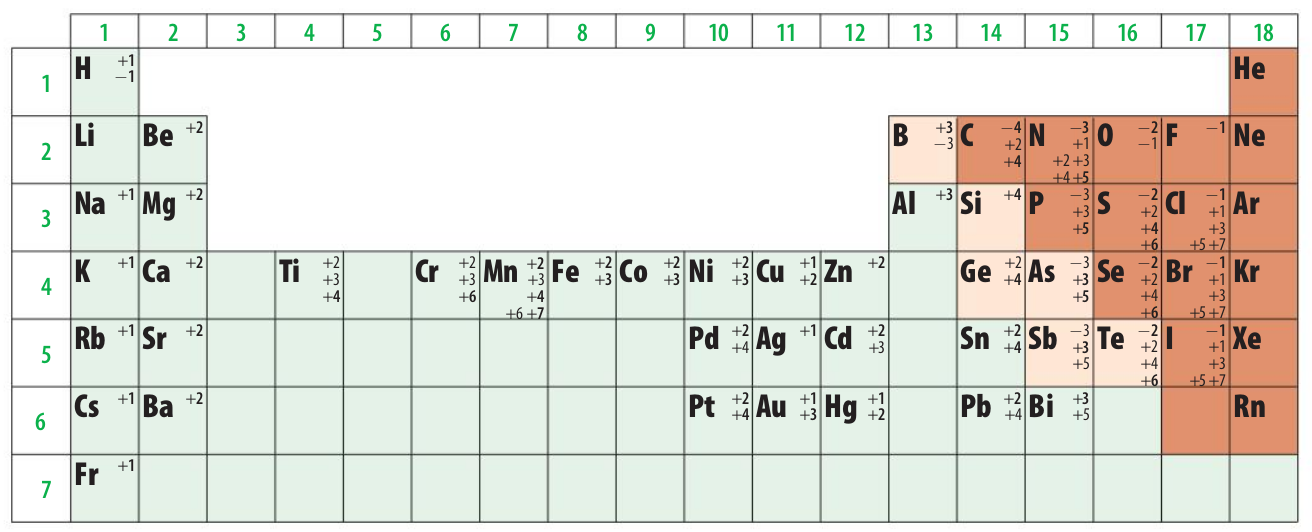
Tabla IUPAC de electronegatividades
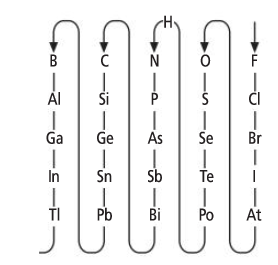

Cómo se formula
Para formular intercambiamos los números de oxidación de los dos elementos (sin signo) colocando en primer lugar el elemento menos electronegativo
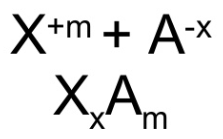
Cómo se formula
Para formular intercambiamos los números de oxidación de los dos elementos (sin signo) colocando en primer lugar el elemento menos electronegativo (más metálico)

Cómo se formula
Para formular intercambiamos los números de oxidación de los dos elementos (sin signo) colocando en primer lugar el elemento menos electronegativo (más metálico)

Formulación y nomenclatura de compuestos binarios
Lo que se indica a continuación es válido para compuestos que no llevan oxígeno en su composición:
- A la izquierda se escribe el nombre del elemento con número de oxidación positivo y a la derecha el que lo tiene negativo.
- El símbolo de cada elemento lleva el subíndice necesario para que la suma de los números de oxidación de todos los átomos sea cero.
- El nombre del compuesto comienza con el del elemento con nº de oxidación negativo terminado en -uro, le sigue la preposición de y, luego, el nombre del elemento con nº oxidación positivo.
- La composición se puede indicar haciendo uso de prefijos multiplicadores, con el número de oxidación o el número de carga, si el elemento con nº de ox. positivo puede actuar con varios.
Formulación y nomenclatura de compuestos binarios
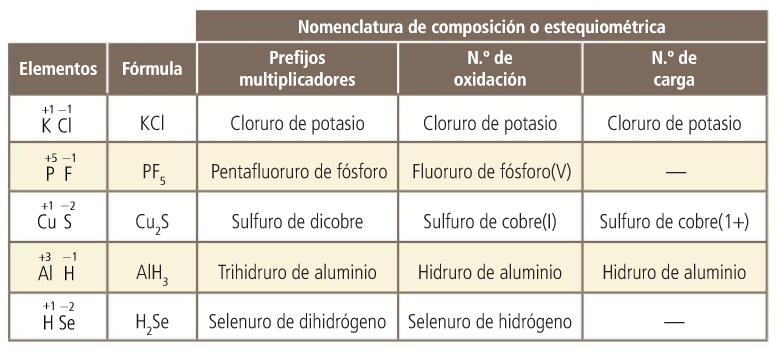
Cómo se nombra
Mediante prefijos multiplicadores que indican el número de átomos de cada elemento (mono, di, tri, tetra, penta, hexa...).
Ejemplos: CO2 dióxido de carbono; CrCl3 tricloruro de cromo
El prefijo mono en segundo lugar se omite.
Ejemplo: CO, monóxido de carbono
Mediante el número de oxidación. Si uno de los elementos (el positivo) puede actuar con más de un número de oxidación, se especifica el que utiliza en este compuesto. En este caso, se escribe en números romanos y entre paréntesis, a continuación del nombre y sin dejar espacio.
Ejemplo: CO2 óxido de carbono(IV)
Si el elemento solo puede actuar con un número de oxidación, no se especifica.
Hidruros de los metales
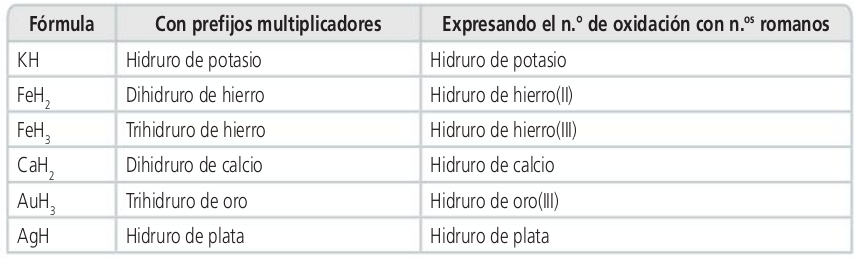

Actividades
Hidruros de los grupos 13,14,15
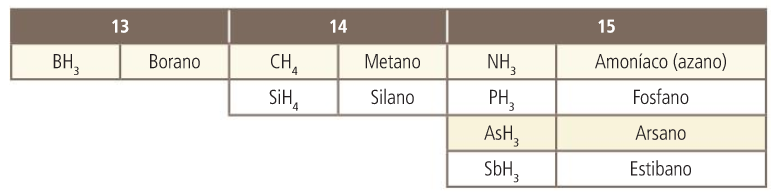
Tienen carácter básico

Hidruros de los grupos 16 y 17
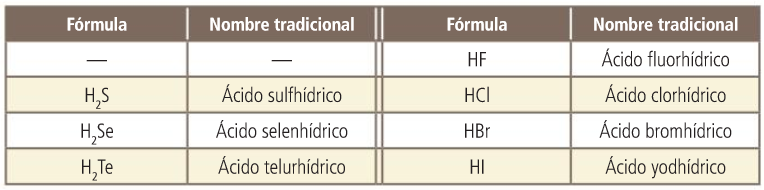
Tienen carácter ácido



Ácido cianhídrico

Actividad
Óxidos
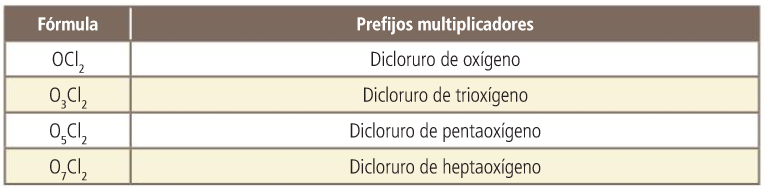

Actividad

Peróxidos

Los peróxidos son el único caso en que el oxígeno actúa con número de oxidación -1.

Hidróxidos


Sales binarias
Son combinaciones de un metal y un no metal
El no metal actúa con su número de oxidación negativo:
F, Cl, Br, I... -1
O, S, Se, Te... -2
N, P, As... -3
C, muy variado
Se nombran con la terminación en -uro del no metal seguido del nombre del metal:



Actividades
Tienen carácter ácido
Nomenclaturas:
- Tradicional: Ácido sulfúrico
- De hidrógeno: Dihidrogeno(tetraoxidosulfato)
Hay que aprender los más importantes
Ácidos oxoácidos
Ácidos oxoácidos. Truco para la nomenclatura tradicional
| 13 | 14 | 15 | 16 | 17 | |
|---|---|---|---|---|---|
| B(+3) | C(+4) | N(+3,+5) | F(1-), no tiene | ||
| Si, Ge (+4) | P,As,Sb (+3,+5) | S, Se, Te (+2,+4,+6) | Cl,Br, I (+1,+3,+5,+7) | ||
| hipo---oso | H2SO2 | HClO | |||
| ---oso | HNO2 | H2SO3 | HClO2 | ||
| ---ico | H3BO3 | H2CO3 | HNO3 | H2SO4 | HClO3 |
| per---ico | HClO4 |
Fíjate, cuando el número de oxidación en un elemento cambia de dos en dos, lo único que hacemos es añadir un oxígeno más para completar la serie de los oxoácidos.
Para los ácidos de fósforo, arsénico, silicio y de boro, tienes que añadir una molécula de agua más al ácido de referencia.
Además, debes conocer los oxoácidos de los metales cromo y manganeso:
H2Cr2O7, Á. dicrómico; H2CrO4, Á. crómico
H2MnO4, Á. mangánico; HMnO4, Á. permangánico
Ácidos oxoácidos

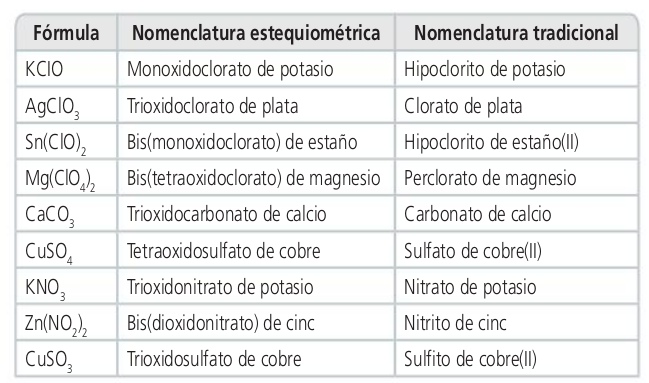
Oxosales
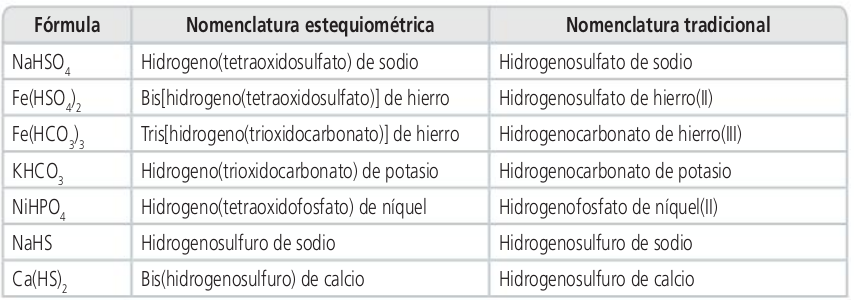
Sales ácidas

Oxosales y sales ácidas
Cianuro de amonio
Actividades finales
8 y 9
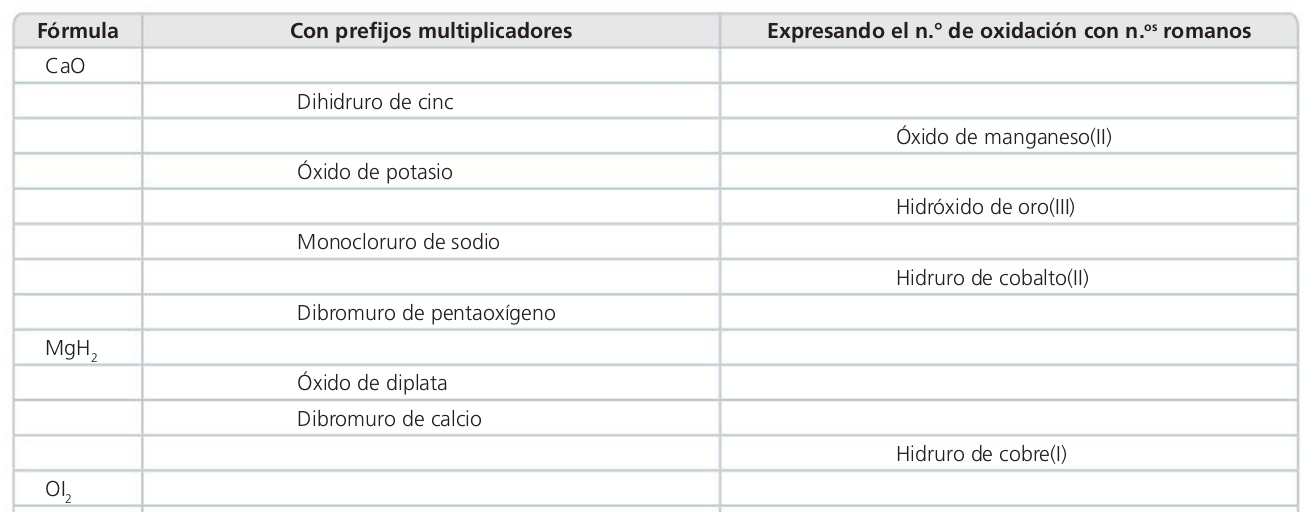


Monóxido de calcio
Óxido de calcio
Hidruro de cinc
Monóxido de manganeso
Óxido de potasio
Trihidróxido de oro
Cloruro de sodio
Dihidruro de cobalto
------------------
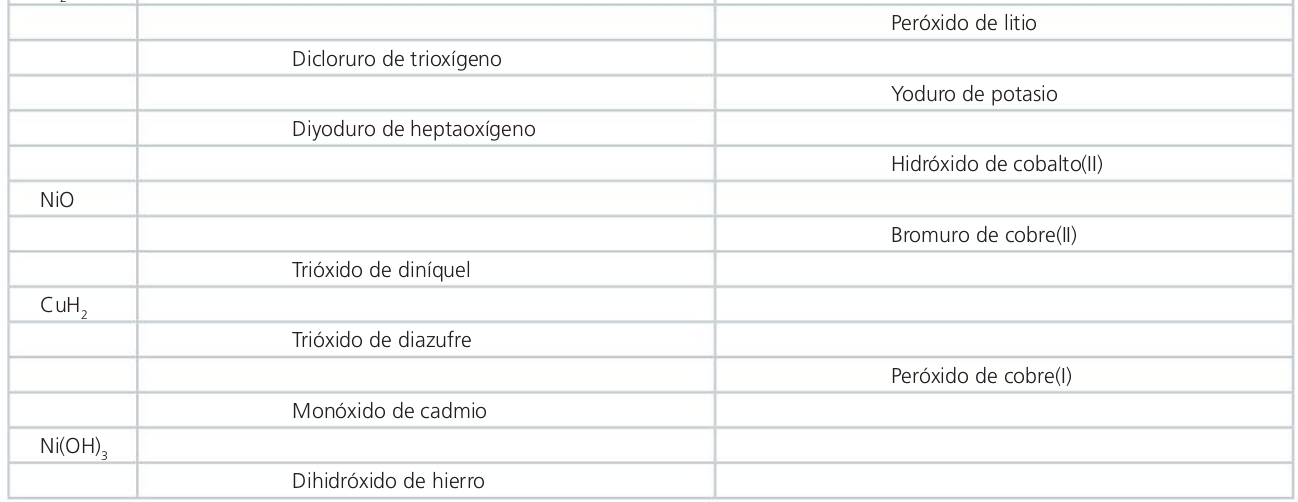
Dihidruro de magnesio
Hidruro de magnesio
Óxido de plata
Bromuro de calcio
Monohidruro de cobre
Diyoduro de oxígeno
------------------
Dióxido de dilitio
------------------
Yoduro de potasio
------------------
Dihidróxido de cobalto
Monóxido de níquel
Óxido de níquel (II)
Dibromuro de cobre
Óxido de níquel (III)
Dihidruro de cobre
Hidruro de cobre (II)
Óxido de azufre (VI)
Trióxido de azufre
Dióxido de dicobre
Óxido de cadmio (II)
Trihidróxido de níquel
Hidróxido de níquel (III)
Hidróxido de hierro (II)
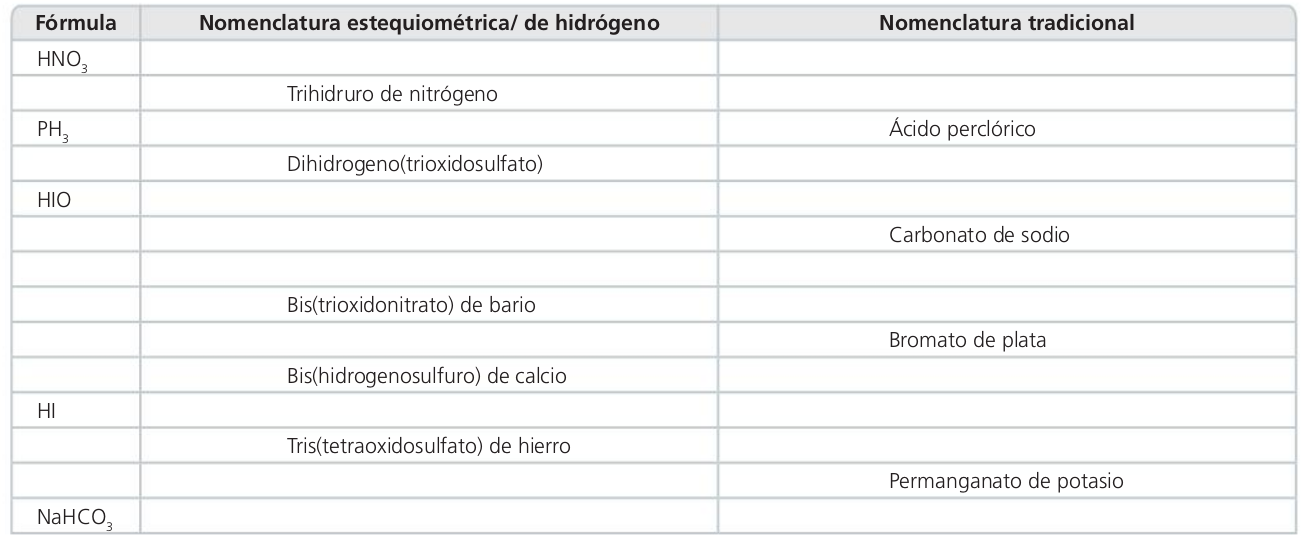

Hidrogeno(trioxidonitrato)
Ácido nítrico
Amoníaco, azano
Trihidruro de fósforo
Fosfano
Ácido sulfuroso
Hidrogeno(oxidoyodato)
Ácido hipoyodoso
Trioxidocarbonato de disodio
Hidrogenosulfuro de bario
Trioxidobromato de plata
Nitrato de bario
Yoduro de hidrógeno
Yoduro de hidrógeno
Sulfato de hierro (III)
Hidrogeno(tetraoxidoclorato)
Hidrogeno(trioxidocarbonato) de sodio
Hidrogenocarbonato de sodio
Ácido perclórico
Tetraoxidomanganato de potasio
4ESO_03. Formulación
By zorro2002
4ESO_03. Formulación
Nesta unidade coñecerás as últimas normas de formulación e nomenclatura da IUPAC (International Union of Pure and Applied Chemistry)
- 2,255



