Atomer och spektrum
Kort historik - några nedslag
- Demokritos (400-talet f.kr) – Världen består av odelbara partiklar, atomer.
- Aristoteles (300-talet f.kr) – Världen består av de fyra elementen Jord, Eld, Luft och Vatten. Denna filosofi stod sig i nästan 2 000 år(!).
- John Dalton: Tabell över atomvikter som förklarade vissa kemiska reaktioner och kombination av atomer till molekyler. (1803)
- Mendelejev (1834 – 1907) – Systematiserade de kända grundämnena i det som sedan skulle bli det periodiska systemet. Undersökte egenskaper som liknade varandra hos olika ämnen. (1869)
- Robert Brown: Slumpmässig rörelse av pollenkorn (1827). Einstein 1905: Visade att det berodde på kollision med atomer.
Atomens storlek
- En vanlig modell av atomen är att den är sfärisk med en diameter i storleksordning \(10^{-10}\) m.
- Kärnan är i sin tur i storleksordningen \(10^{-15}\) m. Det innebär att atomen utgörs till 99.9999999999999 % av tomrum.
- I och med att så stor del är tomrum så kommer de ingående partiklarna ha en enorm densitet. T ex har en proton en densitet i storleksordning \(10^{18}\) kg/m\(^3\).
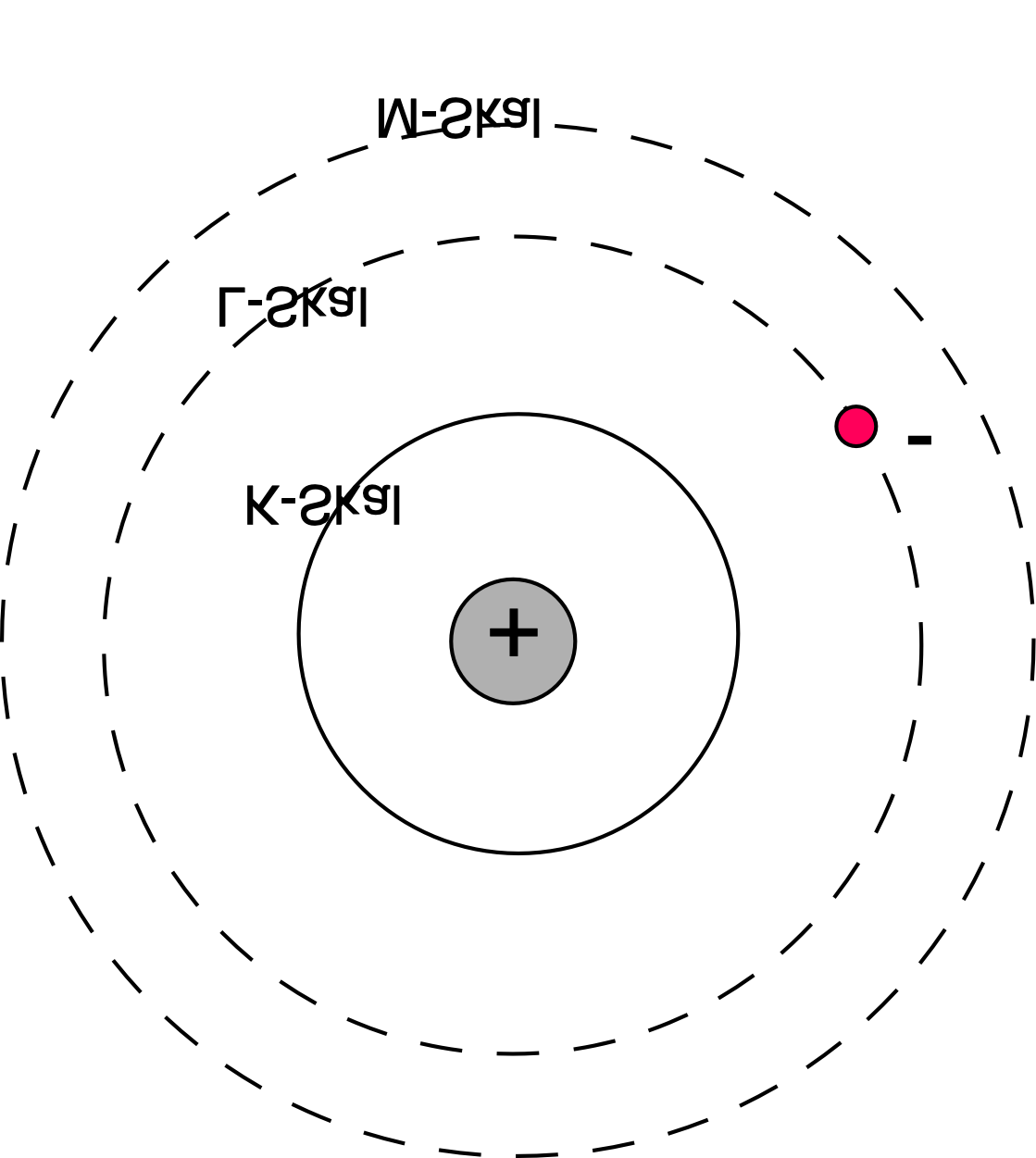
Bohrs postulat\(^*\)
-
Elektronen rör sig i cirkelrunda banor runt atomkärnan, där den elektriska kraften (Coulombkraften mot kärnan på den negativt laddade elektronen positivt laddade kärnan) utgör centripetalkraften.
-
Endast vissa omloppsbanor för elektronen är stabila (de andra är otillåtna), där inte elektronerna förlorar energi och faller in mot kärnan.
-
När en elektron övergår från en högre energinivå till en lägre avges en foton med den våglängd som svarar mot energiskillnaden mellan energinivåerna.
-
Omkretsen på elektronens bana måste vara ett helt antal de Broglie-våglängder.
(*) Postulat: Obevisat, men rimligt, antagande
Atomers excitering och deexcitering
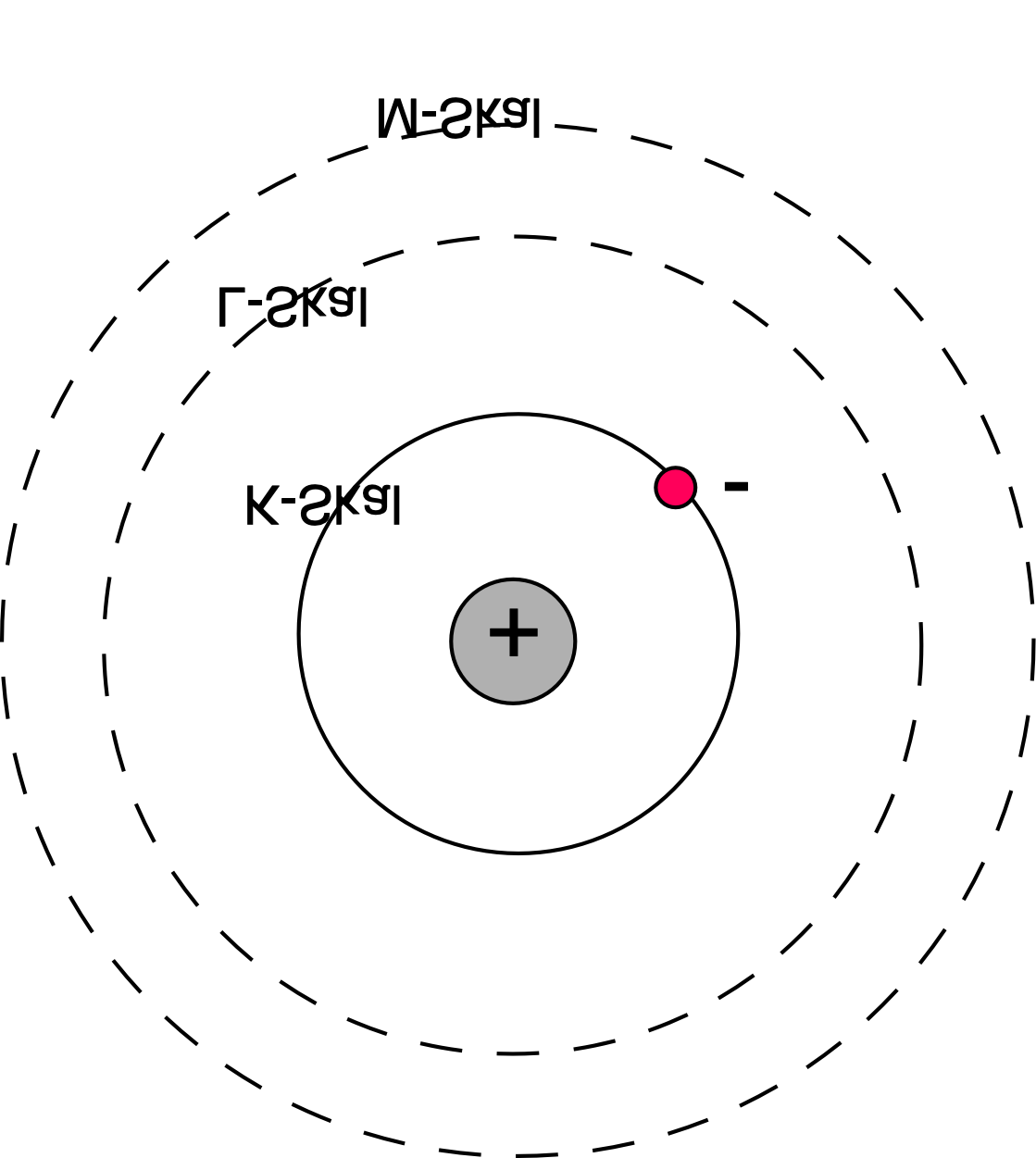
Väteatom i grundtillståndet
Väteatom i exciterat tillstånd
Atomers excitering och deexcitering




Väteatom i grundtillståndet
Väteatom i exciterat tillstånd
Väteatomens övergångsserier
-13,6
-3,39
-1,51
-0,85
E [eV]
Lymanserien
Balmerserien
Paschenserien
\(91.18\text{ nm}\leq\lambda\leq 121.6\text{ nm}\)
\(364.6\text{ nm}\leq\lambda\leq 656.5\text{ nm}\)
\(820\text{ nm}\leq\lambda\leq 1875\text{ nm}\)
Emissionsspektrum
- de färgade linjer som uppstår när en gas blir varm, eller dess atomer på annat sätt har exciterats

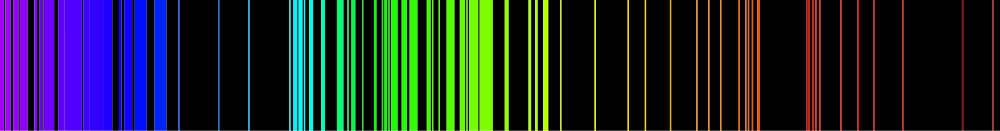
Den synliga delen i väteatomens spektrum
Den synliga delen i järnatomens spektrum
Emissionslinjer uppstår då en atom deexciteras.
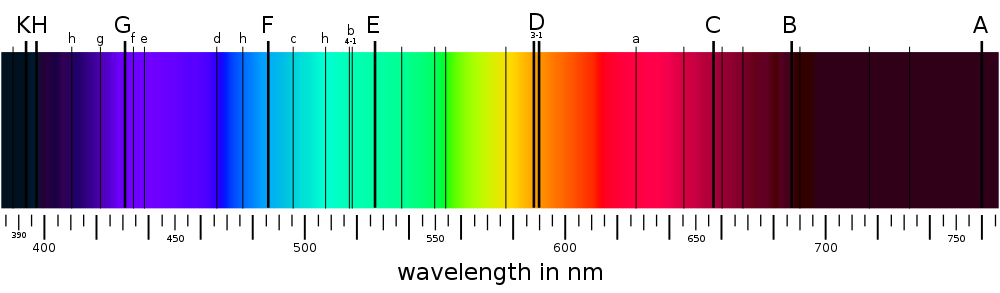
Absorptionsspektrum
- de mörka linjer som uppstår när en gas absorberar energi från en ljuskälla
Den synliga delen av solens absorptionsspektrum
Absorptionslinjer uppstår då en atom exciteras.
"Fluorescens innebär att ett ämne som har absorberat ljus eller annan elektromagnetisk strålning, återutsänder (återemitterar) ljus. Det är alltså en process där atomer eller molekyler först exciteras genom absorption av ljuskvanta (fotoner)."

Fluorescens - "ljus i andra hand"

Fluorescerande mineral
Hur atomer kan exciteras
- Partikelbombardemang, t ex elektroner
- Värme
- Fotoner
Om en atom ska kunna exciteras av en foton måste fotonens energi precis stämma överens med den energiskillnad som atomer kommer att öka i och med excitationen. Fotonen absorberas helt.
Från värme och partikelbombardemang kommer atomerna att ta den energi som behövs för att excitera. En partikels hastighet minskar alltså i samband med att atomen exciterar.
Atomer och spektrum
By Nikodemus Karlsson
Atomer och spektrum
Fy2
- 557



